Способ получения эфиров о-пиразолопиримидин-(тионо)- фосфорной(фосфоновой)кислоты
Иллюстрации
Показать всеРеферат
ОП ИСАНИ Е
ИЗОБРЕТЕН ИЯ
Союз Советских
Социалистических
Республик
К ПАТЕНТУ (6l) flîí0ë8èòåëüíûé к патенту (22) Занвлено 050771 (21) 1676299/23-04 (5l) M. Кл. (23) ПриоритЕт - (32) 08.07. 70 (3l) Р 2033947. 3 (33) ФРГ
С 07 1) 487/02
//А 01 14 9/20
Государственный номнтет
Совета Инннстроа СССР но делам нзобретеннй н отнрытнй (43) ОпУбликовано 25.1177. Бюллетень № 43 (53) УДК 547 ° 779.07 (088.8) (45) Дата опубликования описания f17.1177
Иностранцы
Гельмут Гоффманн, Ингеборг Хамманн, Вольфганг Беренц, Бернхард Хомейер и Вильгельм Штендель (ФРГ) (72) Авторы изобретения
HHoc ðàHHàR фирма Байер Al" (ФРГ) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ЭФИРОВ 10-ПИРАЗОЛОПИРИМИДИН-(ТИОНО)ФОСФОРНОЙ(ФОСФОНОВОЙ)КИСЛОТЫ
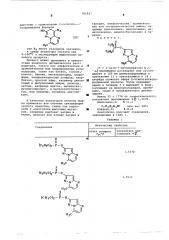
RO +i
Р— Hal, Rs
Изобретение относится к способу получения новых эфиров О-пиразолопири, " мидии- (тионо) фосфорной (фосфоновой) кислоты формулы б где R1 - прямой или разветвленный алкильный радикал с 1-6 атомами угле16 рода;
R>- алкильный радикал с 1-4 атомами углерода или алкоксирадикал с 1-6 атомами углерода;
R>- атом водорода, хлора или брома;
Х вЂ” кислород или сера, которые обладают биологически активными свойствами и могут найти применение в сельском хозяйстве. 26.
Известны сложные эфиры 0-пиразолопиримиднн- (тионо) фосфорной (фосфоновой ) кислоты, которые получают взаимодействием галогенида эфира (тионo) фосфорной (фосфоновой ) кислоты с ок сипи- З0 разолопиримидином и которые обладаютбиологической aKTHBHoqTbN (lj.
Целт изобретения — способ получения новых эфиров 0-пиразолопнримидин(тионо)фосфорной(фосфоновой)кислоты
Формулы I, которые обладают улучшеной биологической, активностью по сравению с известными эфирами 0-пиразолопиримидин-(тионо)фосфорной(фосфоновой) кислоты.
Предлагаемый способ получения соединений формулы Х, основанный на известной в органической химии реакции взаимодействия галогенидов кислоты с оксипроизводным соединением заключается в том, что галогенид эфира (тноно)фосфорной(фосфоновой) кислоты формулы где Й1, Наи Х имеют указанные значения, Hat — атом галогена, или ее соответствующую соль щелоч.ного или, щелочно-земельного металла, или аммониевую соль подвергают вэаимо5818á7
N iN
Н,С
Таблица 1 физические свойства
Соединение
1,5170
1 5515 действию с производным 2-оксипир < лопиримидина формулы где Из имеет указанное значение, я среде акцептора кислоты при 10
0-100 С с последующим выделением целевого продукта.
Процесс можно проводить в присутствии инертного органического раст ворителя, такого как алифатические и 16 ароматические или хлорированные углеводороды, такие как бензол, толуол, ° ксилол, бензин, метиленхлорид, хлороформ, четыреххлористый углерод, хлор бензол,>простой эфир, например диэти- 20 ловый и дибутиловый эфиры, диоксан, кетоны, например ацетон, метилэтил-, метилизопропил-, и метилизобутилке" тон, или нитрилы, например ацетонитрил. 35
В качестве акцепторов кислоты мощно применять все обычные связывающие кислоту средства, такие как карбонаты и алкоголяты щелочных металлов, например карбонат натрия и калия, метилат или этилат натрия и
S
II (СН O) — Р— P
< ( 3 кальция, алифатические, ароматические или гетероциклические амины, например триэтиламин, диметиламин, диметиланилин, диметилбензиламин и пиридин.
Пример 1.
S н,с
15 r 2-окси-7-метилпиразоло (1, 5- ) пиримидина растворяют или суспендируют в 100 мп диметилформамида и прибавляют 11 г триэтиламина и 18 г хлорида сложного эфира 0-этилэтантионофосфоновой кислоты. После перемешивания в течение 3 ч выливают в воду, поглощают ее метиленхлоридом, про<ывают, сушат и предварительно дистил— лируют.
Выход 22 r (77% от теоретического); показатель преломления n g 1,5670.
Вычислено,%: S 11,2
Си H«;0@N з8Р (мол, вес 285)
Найдено<%< S lli8
Аналогично получают соединения, приведенные в табл 1. чка вспыш <азатель прерр с мления, пв м
Р<
58 J 867
Продолжение табл. 1
Соедине нне
86-88
51Tl0p С Q И90 1
44-46
1, 5354
S и3О СЗН70 1. P — О
С 145 бО-62
НО
М
Получение исходного продукта.
В раствор из 40 г 3-аминопиразолона и 108 г ацетоацетальдегиддиметилацеталя в 300 мп сухого зтанола вводят сильный поток хлористого водорода до 60 окончания осаждения. Затем отсасывают осадок, растирают с 2 н. натровым щелоком, снова отсасывают и высушивают.
Вык >и 25 г (424 от теоретического); т,пл. 20 ) С. 65
Вычислено, Ъ: N 28,2
C Н.,ON 3 (мол. вес 149)
Найдено, t: N 28, 1
При мер 2.
55 г 2-окси-3-хлор-7-метилпираэоло (1, 5- <) пиримилина растворяют в
300 мл ацетс .нтрила и перемешивают с 45г карбоната калия и 57г хяорида .сложного эфира 0 О-диэтилтионоф
Таблица 2
Соединение
Точка плавления, С
58-60 сгнЪ I
N N
59-61
74-77
Пример 3 ной кислоты в течение 3 ч при 50-60 С затем наливают смесь в воду, поглощают бензолом, промывают, высушивают и предварительно дистиллируют.
Выход 47 г (47% от теоретического)) точка вспышки 54 С.
S с я,о
С1 (С РН50) РР— О С1
Получение исходного продукта.
НО С1
75 г 2-окси-7-метилпиразоло (1,5- яя
- o() пиримидина растворяют в 1600 мл ледяной уксусной кислоты и при 70 С вводят 38 г хлора в раствор. После перемешивания при комнатной температуре
: течение 30 мин прибавляют 40 r гидроокиси натрия, растворенной в 100 мл воды. Эатем некоторое время нагревают смесь до 90 С, охлаждают, отсасывают осадок, промывают простым эфиром и сушат на глине.
Выход 62 r (67% от теоретического);
Вычислено,%: Н 12,5) С(10,6;
8. 9,5; Р 9,2
СнН„0 N 0 8Ð (мол.вес 336)
Найдено, %: )Ч 11 9) С 10,5;
3 10,0) Р 9,7
Аналогично получают соединения, приведенные в табл.2
46 r 2-окси-3-бром-7-метилпиразолоj1,5- А) пиримидина суспендируют или растворяют в 200 мл ацетонитрила и в течение ночи перемешивают с 22 r триэтиламина и 33 г хлорида сложного эфира 0,0-диэтилтионофосфорной кислоты.
Эатем наливают смесь в воду, поглощают бензолом, промывают, сушат и предварительно дистиллйруют.
Выход 42 r (55% от теоретического); т.пл. 72-74 С.
581867
Таблица 3 плавления, OÑ
II (2 50)2 P 0 ВГ
"-я м н,о 1
100-103
Ger„ ) р-С„НО II — О ВГ
С%
М, 62
115-118
ИЭΠ— СЗН70 ц. Р— О Вг
135
II
3 2 Р— О ВГ
N к нзС Ъ
55
К 45 r 2-окси-7-метилпиразоло (1, 5 - ) пиримидина в 1200 мл ледяной уксусной кислоты прибавляют 48 r
60 брома. После перемешивання при комнатной температуре в течение 20 мин прибавляют 24 г гидроокиси натрия, растворенной в бО мл воды. Затем нагревают смесь некоторое время до
65 100 С, охлаждают, отсасывают осадок, Вычислено,4. М 11,1; 8 8,4; У 8,2
Снй вОЗМ 5r39 (мол.вес. 380)
Найдено, В: И 11,0; Ь 8,31 У 8,3
Получение исходного продукта.
НО 8r
Аналогично получают соединения, приведенные в табл.3.
%818б7
Х
RO
-- P — На1, Rg
Н0
Составитель Т.Якунина
Редакто т.загребельнак техред м.леаклкак ко ектор л.Макареанн
Заказ 3941/3 Тираж 553 Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытиЯ
113035 Моокаа М-35 Ракшскан наб. да 4л5
Филиал ППП Патент, г. Ужгород, ул. Проектная, 4 нроьжвают простым эфиром и сумет иа глине.
Выход 40 f (594 от теоретического) у т.пл. 186 С (при разлакеики).
Вычислено, Вг N 18,41 ®» 35,1
Q Н40М В» (мол.еес 228}
Найдено, В: М 18,71 Ir 35,2
Формула ызобретенхЯ
1. Способ получения зфиров (1-пиразолопиримидин-(тиоио) фосфорной (фосфоновой) кислоты общей формулы Т
%10 g
Р-О 3
М.
НЗС где В1 — прямой или разветвленный алкильный радикал с 1-6 атомами углерода;
R® — алкильныЯ радикал с 1-4 ато" мами углерода или алкоксирадикал с
1-6 атомами углерода;
R>- атом водорода, хлора или бромаа
Х вЂ” кислород или сера, отличающийся тема что гаяогеиид эфира (тиоио) фосфорной (фосфоиовой) кислоты общей формулы и где и, R и X имеют указанные
1О значения, Hat атом галогена, или ве соответствующую соль ще.лочного или щелочно-земельного металла, или аммониевую соль, подверга» ют взаимодействию с производным
2-оксипиразолопиримидина общей формулы Ш где И имеет указанное значение в среде акцептора кислоты при
0-100 C с последующим выделением целевого продукта.
Источники информации, принятые во внимание при экспертизе:
1. Выложенная заявка ФРГ 912,39695, кл. 12р, 10/10, 24.12.64.