Способ получения производных циклопентана
Иллюстрации
Показать всеРеферат
О П И С А Н И Е <10 582754
ИЗОБРЕТЕН ИЯ
Союэ Советских
Социалистических ресяубпик
И ОАТЕН1У (61) Дополнительный к патенту (22) Заявлено 1306.72 (21) 1803942/04 (23) Приоритет (32) 140671 (31) 27844 р 2) Велик обрит ани я (43) Опубликовано 30,1177. Бюллетень № 44 (45) Дата опубликования описания 060),78 (51) М. Кл, С07 С 6 1/06
Гесударстеееявй кееехтет
Сеевте Меаетрее СССР ее делам ееебретеек к еткрепее (53) Уйк
547.514.48.07(088.8) (72) АВТО Ы
Иностранцы () вторы
Майкл Петер Лир Катон, Эдваод Чарльз 71жон Ко@фи изобретения и Гордон Леонард Уоткинс (Великобритания) (71) Заявитель
Иностранная фирма Мэй энд Бэйкер Лимитед, (Великобритания) (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦИКЛОПЕНТАНА (-Н 2}уР з
Х вЂ” СНК
I оя
K-сопь
СООС Н5
B r (CH ) < CO 0 C
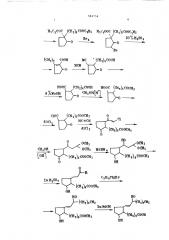
Данное изобретение относится к спо1 собу получения новых производных циклопентана общей формулы
Яе где Й4- алкил С вЂ” С е с нормальной или разветвленной цепью, который мок ет быть алкоксилом, или представляет циклоалкил СВ -C7 адамантил, R — водород, алк ил, ацил
Q5 — карбоксил, алкоксикарбонил
С> -С1 с нормальной или разветвленной цепью, карбомоил, незамещенный или замещенный одним или двумя алкилами карбазоил, R4 — кислород, оксиимино, алкоксиимино, гидразоногруппа, замещенная илн незамещенная двумя алкилами7
Иа алкил водород
Х вЂ” п7тзс нс -виниленовая или этиленовая группат
A — 5, 6, 7 или 8, Ip которые обладают ценными медикобиологическими свойствами и могут найти применение как фармакологические препараты. известен (1 1 способ получения 7«
Ib -(5 — (3-оксиокта-1-енил-2-оксициклопентил)- энантовой кислоты из 7-,бром- гептаноата и калиевого енолята 2-зтоксикарбоциклопентанона, включающий последовательность из одиннадцати
20 стадий:
582754
НЗC300C (CH3)3Ñ0003H3 НЗС,ООС (СН )3СООСР3 яр 20 o MgSOy
-О О (СН )8 СООН мс (сн,),ооон
НООС (СН3)3СООН НООС (СН )3 СОРН
3 %Но ОН СНЗОН (Н )
=0
Cl,соосн, СНЗОН (ОН) С 5И11 И93 > L33.Н $04
6соосн3
HO
М)3СН3 (CH3)4CH3 цСООИ
Оп
С10С
80С1 (СН3) 6СООСК3
НС =-CH
=О
А1С13
ОСН, ОСН3 yaHH
СООСН3
ОСН 3
0 3
СООСН3
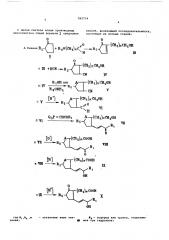
582754
О (® а)ион он о
+ н о(он )пс — к5 н
A. Енамин R (m,),он,он
° К +НСВТ R, (сн,)„он,он
a,г- сиов 5
Е Rg
О
СоОМ (н) m %lit =н, (н1
slX Rg
ОК укаэанные выае эна- ФЭ вЂ” водород или группа, отщепляе64 мая йри гидролиэе где М,,R4,n чения
С целью синтеза новых производных циклопентана общей формулы предложен
К ОН или Ю
В 80351
Ы л
rY 4iR5 способ, включающий последовательность, состоящую иэ восьми стадий.
v (он,),он,он о
С 71 н
582754
@7 0 7 б б мок
Н или С
/X
ХИ. где Я - одинаковые алкилы или оба
7 вместе эамещенная. или незамещенная этиленовая группа) и — алкил.
Предлагаемые соединения формулы 1 имеют такую конфигурацию, в которгй боковые цепи, присоединенные к атомам углероде кольца в 1 и 2-положениях, имеют птроис-расположение.
Иэомерные формы соединений изобретения,возникающие из центров изомеризации,можно разделять известными способами,например,диастереоизомерные фор-о0 мы можно разделять хроматографией с применением избирательной адсорбции из раствора или иэ паровой фазы на подходящие адсорбенты. Энантиомерные формы кислотных соединений с формулой f, где Я - карбоксильная группа, можно разделять путем образования солей с оптически активным основанием и последующим разделением полученных пар диастереоизомеров, например фракционированной кристаллизацией из подходящей системы растворителей с последующей регенерацией энантиомерных кислот формулы f.
Для осуществления предлагаемого способа применяют альдегиды формулы! 35
l5 н,о(сн,)„сно n
Полученные оксиалкилциклопент-2ен-1-сны(ш) гидроцианируют, например, ацетонциангидридом, в присутствии основания, например карбоната натрия 65 где Я в водород или группа, легкс 40 отщепляемая при гидролизе, например
2-тетрагидропиранил, незамещенный или замещенный алкилом; и - виаеукаэанное значение.
Реакцию альдегида с формулойII и енамина (например, морфолиненамина) циклопентанона до получения 2-оксиалкилциклопент-2-ен-1-онов Щ проводят в инертном органическом растворителе, например ароматическом углево- 50 дороде (бвизол) при непрерывном удалении воды при 60-120 С с последующим гидролизом в водной кислоте (например, соляной кислоте) при комнатной температуре. Затем реакционную смесь нагревают с кислотой, например концентрированной соляной до 100 С в таком инертном растворителе; например бутаноле, ооо перемещения двойной связи из экзоциклическо-, го в эндоциклическое положение. в водном органическом растворителе, например в водном метаноле, при температуре 50-110 С или кипении растворителя с обратным холодильником до образования кетонитрилов )ч).
Кетонитрилы(1Ч)превращают в кетали1У) взаимодействием соединения с формулой 1Ч и соответствующего спирта в присутствии кислого катализатора, например я -толуолсульфокислоты с одновременной отгонкой воды. Этот процесс ведут в среде инертного огранического растворителя, например бенэола при температуре кипения. Кроме того, кетонитрилы)Чмогут быть превращены в оксимы взаимодействием с соответствующими алкоксиаминами в присутствии основания.
Далее, нитрилы IV восстанавливают в инертном органическом растворителе, например низшем диалкиловом эфире (диэтиловом эфире), предпочтительно при температуре от - Sd до ЗО С до соединений(Ч)), с помощью известных комплексных металлических восстановителей, предпочтительно раствора гидрида диизобутилалюминия, в инертном органическом растворителе, например ароматическом углеводороде (бенэол). Получаемые
2-(оксиалкил)-циклопентанкарбальдегиды)Ч являются новыми соединениями и основными промежуточными продуктами процесса, предусмотренного изобретением.
При реакции альдегида(Ч))и фосфорана общей формулы
® Н, Х1П
-4 где Q — фенил, алкфеннл, алкил, например бутил; вышеуказанное значение, в инертном органическом растворителе, например тетрагидрофуране, при температуре кипения реакционной смеси с обратным холодильником, получают непредельные кетоваi (ml).
Далее, кетоныЧ1)окисляют в органическом растворителе, например, трехокисью хрома в днметилформамиде, предпочтительно при температуре от -5 ао
+10 C до образования цнклопентанал-. кановых кислот(ч)н).
Циклопентаналкановые кислоты(ЧН))в инертном органическом растворителе, например зтаноле, восстанавливают боргидридом металла, например боргидридом натрия, желательно в присутствии основания, например гидроокиси щелочного металла (гидроокиси натрия) до получения (оксиалкенил) циклопентилалкановы кислот (И).
Затем кетали!Х, где А группа формулы ф, подвергают кислотному гидролизу, например, в разбавленной водной соляной кислоте при 45-70 С до получения о
5- (3-оксналкенил)-2-оксоциклопентилалкановых кислот ф .
582754
Этот гидролиз выгодно проводить совместно с превращением соединенийЧ) в соединения)Х с изменением условий для протекания гидролиэа кеталя до кетона X . За счет этого уменьшается количество стадий реакции до семи.
Оксимы с общей формулы Й,,где A группа, имеющая формулуф, являются новыми соединениями, иэ входящих в ряд соединений формулы ) . Их можно превращать в соединения формулы Х изве10 стными способами превращения оксимов в кетоны, например обработкой водного Органического раствора оксима с формулой!X предпочтительно смесью водной уксусной кислоты и диоксана, водным раствором треххлористого титана и атмосфере инертного газа, например азота.
Производные соединений общей формулы 7, где Я вЂ” алкоксикарбо, можно получить при реакции соответствующей карбоновой кислоты с общей формулойф где Rz - карбоксил, со спиртом, имеющим общую формулу гДейэ- алкил С -C», избыток ко» ЯP. торого можно испольэовать в качестве растворителя, в присутствии неоргани- 30 ческой кислоты, например соляной или еерной, предпочтительно при температуре кипения реакционной смеси.
В случае, когдаЦ представляет Фор9 мулу СН Яюй, 35 где й»в и R водород или низший алкил, с диазоалканом общей формулы
10 11 2 где и о Р„вышеуказанные значения, в среде инертного органического растворителя, предпочтительйо диалкнлового эфира, например диэтилового эфира.
С другой стороны, можно проводить реакцию серебряной соли карбоновых кислот с формулой ) с галоидалкилом
RsZz, где 2 галоген и Яэ вьиаеуказанное значение, 60 в Присутствии органического растворителя, например ароматического углеводорода (бензол) при теипературе кипения реакционной смеси.
Амиды. с формулой» где R>-карбамоил, неэамещенный или замещенный одним или двумя алкилами, можно получить:
1) flpg реайции соединения, имеющего общую формулу где R»> »j к — водород или алкил, с соединением, имекации общую формулу Ее (сн,)ÄcooR„ — СН вЂ” Я
1 1 ов
» 2 ° 4 5 и Х вЂ” вышеукаэайные значения, R»4 — алкил, С» С, в инертном органическом раствор).теле, нагример низшем алканоле (этаноле) или бенэоле при температуре кипения реакционной смеси желательно в присутствии основного катализатора, например алкоголята щелочного Металла, в низшем алканоле, например этилате натрия в этаноле)
2) при:реакции соединения, имеющего
Формулу Q, с формамидом или.алкилированным формамидом в присутствии основного катализатора, например метилата натрия;
3) или амиды с общей формулой, эа исключением тех, у которых R — водород
I можно получить при реакции соответствующего галондангидрида, имеющего общую формулу
Х- СНЯ1
ОИ где 1t,, 9<, Й, и, Х- вышеуказан- q ные значения и R> - алкил или ацил, и например алканонл, или бенэоил, 2 — хлор, бром, с соединением, имеющим формулуХ Ч, предпочтительно при комнатной температуре, и иногда в инертном органическом растворителе,. например диалкиловои эфире °
;Гидраэогндраэиды с формулой, где
Й карбазоил, неэамещенный или замещейный одним илн двумя алкилами, R,, R»» з, ю и Х вышеуказанные значения, получают, например, прн замене соединений с формулой XlV соединениями, имеющими общую формулу Фи 1Р 13 где R, и R»> - вышеукаэннЫе значения, прн процессах проведения по пунктам 1) и 3), описанных выше для приготовления амидов с формулой .
ГидРаэиды с фоРмУлой 1, где Яз представляет карбаэоил, незамещенный
582754
12 или замещенный одним или двумя алкилами, R g — кислород и Я 1, И у, Р
t} v 3(, — вышеуказанные значения, можно получать при реакции соединений, имеющих формулу ХЧН, с соединениями общих формул я,о о
CHajACOOR H
10 или
Х-Сна, 1 оя
l5
XV18 7ООИ7
Х- CHB
i l
ОИ, Х и Zz — вышеуказанные значения,в условиях, описанных для при- а0 готовления амидов при реакции соединений с формулой Я с соединениями формул @ и Х% в процессах 1) и 3), с последующей конверсией соответствующих кетоиов в условиях, похожих на описанные выше, для конверсии соединений с формулой g, где A представляет группу, имеющую формулу M в .соединении с формулой М;
СоеДинения формул ХЧ, XVI,)(VII, XIX 40 можно получать иэ соединений формулы@иТ известными способами.
Соединения формулы 1,гдеЯ представляет ацильную группу, можно получить из соответствующих спиртов формулы, где g - водород, например, при реакции
3 счсоответствующий ангидридом кислоты, предпочтительно в присутствии основания, например пиридина, и при окру-:. жающей температуре иногда в присутствии такого инертного органического растворителя, как ароматический углерод (беизол).
Соединения формулы1, где Ð вЂ” алкил иЯ алкоксикарбо, у которого алкильная часть соответствует R >, можно получать при реакции соединений, имеющих
Формулу)Х,где А имеет формулуф, с соединейиями, имеющими общую формулу где Я з- алкил,С,- С ;
Ч вЂ” кислотный остаток, например атом брома, хлорида или иода, сульфонатная или сульфатная группа, бб или с соединением, имеющим формулуХЩ и кислотой Льюиса, например трехфтористым бором, в инертном растворителе предпочтительно диалкиловом эфире, например диэтиловом эфире предпочтительно при температуре от -50 до +20ОC до получения сое,инений, у которых Й имеет формулу
СНй й,, где Н«ц И, — вышеуказанные значейия, с последующим превращением в соответствующие кетоны в условиях, аналогичных описанным выше, для превращения соединенйй @ в соединенияХ.
Кетоны с формулой I, где И - кислород, можно превращать в такие их производные как оксимы, алкоксиимины и гидразоны, которые могут быть эамещенными одним или двумя алкилами, известными способами, например, при реакции с соответствующими гидроксиламином, алкоксиамином или гидразином или с алкилйрованными производными их.
Соединения с формулой 1,где Х представляет этиленовую гРуппу Я, — R и и - вышеуказанные значения, можйо полу чать, например, при восстановлении со ответствующих соединений формулы 1, где Х представляет виниленовую группу, известными способами, например при гидрогениэации, в присутствии катализатора гидрогениэации, например палла дня на древесном угле, иногда при повышенном давлении.
Соединения формулы, где R — карбоксил, можно получать при щелочном гидролиэе соответствующих соединений формулы g, где R -карбоалкокси.
Согласно изобретению получают следующие новые соединения:
7- (5-(3-оксигекс-1-енил)-2-оксоциклопентил)-энантовая кислота;
7- (4-(3-оксигепт-1-енил)-2-оксоциклопентил -энантовая кислота)
7- (5-(3-оксинон-1-энил)-2-оксоцик" лопентил -энантовая кислота;
7- j5-(3-оксидец-1-енил)-2-оксоциклопентил}-энантовая кислота;
2-(aL †(6-карбоксигексил)-3- ф (3fj оксиокт-1-еннл -циклопентанон;
7- {5-(3-окси-5-метилгекс-1-енил) -2«оксоциклопентил -энантовая кислота;
7- (5-(3-циклопентил-3-оксипроп-1 нил)-2-оксоциклопентил)-энантовая кислота:
7- 5-(3-оксидодец-1-енил) — 2-оксоциклопентил -энантовая кислота;
7- (5-(3-окси-5-метилокт-1-енил)-2 оксоциклопентил — энантовая кислота;
7- (5-(3-окси-b-метилокт-1-енил)-2-оксоциклопентил — знантовая кислота;
7- (5-(3-окси-i-метилокт-1-енил)—
«2-оксоциклопентил) -энантовая кислота;
7-(5-(3-циклогексил-3-оксипроп-1-енил)-2-оксоциклолентил -энантовая
1 кислота;
582754
13 „
7- (5- (3-окси-8-метоксиокт-1-енил)—
-2-оксоциклопентил1 -энантовая кислота;
7- 5-(3-адамантил-3-оксипроп-1-енил)—
-2-оксоциклопентил -энантоная кислота;
7- 15-(3-циклопентил-3-оксипроп-i5 ил)-2-оксоциклопентил -энантовая кислота;
1-(5-(3-оксиокт-1-енил)-3-метил- -оксоциклопентил) -энантовая кислота;
7-2- метоксиимино-ь-оксиокт-1-енил)—
-циклопентил -знантовая кислота,—
7- 15- (3-ацетокси-4-метилокт-1йнил)I
-2-оксоциклопентил) -энантовая кислота; метил-7- (5-(3-циклогексил-3-оксипроп-1-енил)-2-оксоциклопентил -этантоат
t ,метил-7- (5-(3-циклопентил-3-оксипроп-l-вменил)-Z-оксоциклопентил — энантоат, метил-7-(5-(3-оксидодец-1-енил)-2-оксоциклопентил))-энантоат, И -метил-7-(5-(3-оксидодец-1-енил)—
-2-оксоциклопентил -знантоат;
20 гептил-7-(5-(3-цикле:ексил-3-оксипроп-1-енил)-2-оксоциклопентил -энантоат.
Следующие примеры поясняют изобрете.ние.
Пример l. 1-{5-(3-окси-4-метилокт-1-енил)-2-оксоциклопентил — энантовая кислота.
g. Получение 2- (7-оксигептил) -циклопент-2-ен-1-она ° 30
Смесь 7-.(2-тетрагидропиранилокси)»
-гептаналя (22 r) и 1-морфолинциклопентена (21,4 г) н бензоле (25 мл) на грев ают с о брат ным холод иль н ик ом в течение 12 час в атмосфере азота и :ц выделяющуюся воду непрерывно удаляют прибором Дина — Старка. Затем добавляют бенэол (10 мл) и по каплям пркбанляют 18%-ную соляную кислоту (28 мл) и смесь перемешивают 2 час. Органи-,р ческий слой отделяют и выпаривают. K остатку добавляют конц. соляную кислоту (72 мл). и бутанол (300 мл).
Смесь нагревают при температуре 100 С в течение 1 час и после концентрирования раствора получают масло. К маслу добавляют диэтиловый эфир, эфирный раствор промывают водным раствором бикарбоната натрия,. а затем водой и сушат сульфатом натрия. После упаривания растворителя получают 2-(7 оксигептил)-циклопент-2-ен-1-он. (11,7 г) т. кип. 125-170 С (0,15 мм рт. ст. ); n 1,490, Получение 2- (7-оксигептил) -3-оксо-циклопентанкарбонитрила.
Смесь 2-(7-оксигептил)-циклопент-2-ен-1-она (17 г), циангидрида ацетона Q,5 z) 6Ъ-ного водного раствора карбоната натрия (8 мл) и метанола 60 (50 мл) нагревают с обратным холодильником в течение 4 час при перемешивании. После удаления метанола в вакууме добавляют воду (100 мл) и смесь экстрагируют дизтиловым эфиром, затем 85 сушат сульфатом магния. После испарения растворителя остаток перегоняют в вакууме, получают 2-(7-оксигептил)—
-3-оксоциклопентанкарбонитрил (11,3 г) (т.пл. 144-182 С,0,15 мм рт.ст),п
1 4795.
11l,Получение 7-циан-б-(7-оксигептил)—
«1,4-диоксаспиро-(4,4(-нонана.
Смесь 2-(7оксигептил) -3-оксоциклопентанкарбонитрила 20 r, зтиленгиколя (5,6 г), паратолуолсульфокислоты (1 г) и бензола (160 мл) нагревают с обрат— ным холодильником в течение 3,5 час при непрерывном удалении воды. После охлаждения смеси добавляют безводный карбонат натрия, фильтруют через слой карбоната натрия и удаляют растворитель при пониженном давлении . Остаток перегоняют в вакууме и получают 7-циан-6i(7-оксигептил) — 1,4-диоксаспиро(4,41нонан (19,3 г); т.кип. 166-182 С (0,1 мм рт.ст.). Этот продукт используют в качестве исходного для следующей стадии; аликвотную часть его перегоняют при 177-179 С (0,1 мм рт.ст.)
Найдено,Ъ: С 67,1; Н 9,2; ((4,89.
С15 HÌ 03N
Вычислено,Ъ: С 67,37; Н 9,42;
М5,24. .Получение 7-формил-б-(7-оксигептил)-1,4-диоксаспиро(4,41нонана.
Раствор гидрида диизопропилалюминия (53 г) в безводном бензоле (145 мл) добавляют при быстром перемешинании к раствору 7-циан-6-(7-оксигептил)—
-1,4-диоксаспиро- (4,4)-нонана (43,2 r) в абс. диэтиловом эфире (432 мл) при
10-15 С. Перемешивание при комнатной ь температуре продолжают 1,5 час и смесь добавляют к 2 н. уксусной кислоте (1 л) при температуре ниже 15 С.
Органический слой отделяют и водный слой экстрагируют дизтилоным эфиром.
Объединенные органические слои промывают водным раствором бикарбоната натрия, сушат сульфатом натрия, удаляют растворитель н накууме и остаток перегоняют при пониженном давлении; получают 7-формил-6-(7-оксигептил)— .1,4-диоксаспйро- (4,4) нонан (25,3 г); т.кип. 164-200 С (0,04 мм рт.ст), 7 . Получение 6-(7-оксигептил) — 1,4-диокса-7-(3-оксо-4-метилокт-1-енил)—
-спиро- t4,4) -нонана.
Смесь 7-формил-7-(7-оксигептил)-1,4 диоксаспиро f4,4j-нонана (3,88 г) и
2-метилгексаноилметилентрифенилфосфорана (6,0 г) в безводном тетрагидрофуране (30 мл) нагревают с обратным холодильником в токе азота в течение
18 час.
После удаления растворителя в вакууме остаток растирают.. с петролейным эфиром (т.кип. 60-80 С), выдерживают . при 0 С и отфильтровывают от трифенилфосфиноксида, Фильтрат выпаривают® 582754
16 получают 6- (7-оксигептил) -1,4-диокса-7- (3-оксо-4-метилок т-1-е нил) cnupof4,4) -нонан (5,56 г); макс 1660 см
Этот продукт используют йа следующей стадии для приготовления 7- {1,4-диокса-7- (3-оксо-4-метилокт-1-енил) -спиро4,4 -нон-б-ил энантовой кислоты без дополнительной очистки.
Ч . Получение 7- (1, 4-диокса-7- (3-оксо-4-метилокт-1-енил)-спиро(4,43 нон-б-ил -энантовой кислоты. 10
Трехокись хрома (6,0 г), высушенную над пяТиокисью фосфора, добавляют порциями при перемешивании к раствору
7-. (7-оксигептил)- 1,6-диокса-7-(3-оксо
-4-метилокт-1-енил)-спиро(4,4J нонана (5,56 r) в безводном диметилформамиде (70 мл) при температуре ниже 0 С.
Затем добавляют концентрированную серную кислоту (2 мл) в диметилформамиде (70 мл) и смесь перемешивают при тем- 20 пературе ниже 10 С в течение 1 час, добавляют диэтиловый эфир и минимальное количество воды для получения двух отдельных слоев. Эфирный слой отделяют и промывают 2 н. раствором карбона- 25 та натрия. Водный слой отделяют, экстрагируют эфиром, покрывают слоем диэтилового эфира и подкисляют до рН 4 при добавлении по каплям концентрированной соляной кислоты. Эфирный слой 3() отделяют, а водный слой снова экстра гируют диэтиловым эфиром. Объединенные эфирные слои сушат сульфатом натрия и выпаривают до получения сырой 7- (1,б-диокса-7-(3-оксо-4-метилокт-1- ;.5
-енил) пиро (4,41 нон-б-ил)-энаитовой кислоты 1(1,6 г);
,макс . 1620, 1660, 1700 см
Этот продукт используют для получения 7-(5-(3-окси-4-метилокт-1-енил) — 4(1
-2-оксоциклопентил}-энантовой кислоты без ополнительной очистки.
Приготовление 7- 5-(3-окси-4-метилокт-1-енил)-2-оксоциклопентил
-энантовой кислоты. 45
Раствор борогидрида натрия (0,07 r) в 0,2 н. водном растворе гидроокиси натрия (0,7 мл) по каплям добавляют к раствору 7-(1,4-диокса-7-(3-оксо-4-метилокт-1-енил)спиро (4,4(íîí-б-ил)-энантовой кислоты (0,7 г) в смеси этанола (10 мл) и 1 н. раствора гид-. роокиси натрия (0,65 мл). Полученный раствор перемешивают 4,5 час, затем в вакууме удаляют этанол. Добавляют 55
10 мл воды, раствор промывают диэтиловым эфиром, водный слой под слоем эфира подкисляют до рН 1, добавляя по каплям концентрированную соляную кислоту. Эфирный слой отделяют, водный слой дважды экстрагируют эфиром. Объе-; диненные эфирные экстракты сушат суль- фатом магния и испаряют растворитель.
Остаток смешивают с 2 н. соляной кислотой (10 мл), нагревают при перемешивании в течение 1,2 час при 65-75 С. 65
После охлаждения смесь дважды экстрагируют диэтиловым эфиром, объединенные экстракты сушат сульфатом магния и выпаривают. Остаток хроматографируют в тонком слое на силикагеле,применяя в качестве элюента смесь бензола,диоксана и уксусной кислоты (65 15:1), получают 7-(5-(3-окси-4-метйлокт-1I енил) -2-оксоциклопентил — энантовую кислоту (0,33 г).
Найдено,%г С вЂ” 71 8; Н вЂ” 10,2;
Су Н„О, Вычислено, %: С вЂ” 71,6; Н вЂ” 10,3.
Пример 2. 7-(5-(3-оксиокт-1-енил)-2-оксоциклопентил -энантовая кислота.
).Получение б-(7-оксигептил) -1,4-диокса-7-(3-оксоокт-1-енил).спиро(4,4) нонана.
Смесь 7-формил-б-(7-оксигептил)—
-1,4-диоксаспиро (4,4)нонана (б г), приготовленного, как описано в примере 1, и гексаноилметилентрифенилфосфорана (8,5 r) в безводном тетрагидрофуране (50 мл) нагревают с обратным холодильником в течение 16час в токе азота. После удаления растворителя в вакууме остаток растирают с петролейным эфиром (т.кип. 60-80 С), охлаждают до О С .в течение дня, отфильтровывают от трифенилфосфиноксида и фильтрат выпаривают. Остаток снова растирают в петролейном эфире (т.кип. 60-80 C) для удаления остатYà трифенилфосфиноксида, отфильтровывают и выпаривают; получают 6-(7-оксигептил)-1,4-диокса-7-(3-оксоокт-1-енил)-спиро14,4) нонан (7,5 r);
И„Получение 7- $1,4-диокса-7-(3-оксоокт-1-енил) -спиро14, 41 нон-б-ил)-энантовой кислоты. Трехокись хрома (2,80 г), высушенную над пятиоксисью фосфора, добавляют порциями при перемешивании к раствору
6-(7-оксигептил)-1,4-диокса-7-(3-оксоокт-1-енил)-спиро (4,4)нонана (2,5 г) в безводном диметилформамиде (40 мл) при температуре ниже 0 С. После добавления концентрированной серной кислоты (1 мл) в диметилформамиде (30 мл) смесь перемешивают при температуре ниже О С в течение 15 мин. Затем добавляют диэтиловый эфир (50 мл) и минимальное количество воды, необходимое для образования двух легко разделяющихся слоев.
Эфирный слой отделяют, сушат сульфатом магния и выпаривают, получают 7- jl „4-диокса-7-(3-оксоокт-1-енил)с:пирс (4,4) ион-6-ил1-энантовую кислоту (2,23 г).
Продукт используют для получения 7-(5-(3-оксиокт-1-енил)-2-оксоциклопентил -энантовой кислоты без дополнительной очистки.
Й. Получение 7- (5-(3-оксиокт-1-енил)
-2-оксоцнклопентил)-энантовой кислоты.
582754
17
Раствор борогидрида натрия (0,54 г) в 0,2 н. растворе гидроокиси натрия . Ю. (5,4 мл) по каплям добавляют к раствору 7- 1,4-диокса-7- (3-оксоокт-1-енил) спиро 4,4 нон-б-ил -энантовой кисло- 5 ты (2,23 г) в смеси этанола (54 мл) и 1н. раствора гидроокиси натрия ( (5,4 мл) . Полученный растнор перемешивают в течение 1 дня, а затем в вакууме удаляют этанол. 10
Водный слой под слоем диэтилового эфира подкисляют до рН 1, добавляя по капг лям концентрированную серную кислоту.
Эфирный слой отделяют, а водный слой дважды экстрагируют диэтиловым эфиром. 15
Объединенные эфирные экстракты сушат сульфатом магния и испаряют растворитель.
Остаток (1,09 г), смешивают с водой (5 мл) и 2 н. соляной кислотой (10 мл), перемешивают при 50 С в течение 3 час °
Охлаждают, дважды экстрагируют диэтиловым эфиром, объединенные экстракты сушат сульфатом магния и выпаривают.
Остаток (0,89 r) хроматографируют в тонком слое на силикагеле, применяя в качестве элюента смесь бенэола, диоксана и уксусной кислоты (65:15".1), получают 7-$5-(3-оксиокт-1-енил)-2-оксоциклопейтил),-энантовую кислоту З0 (0,7 г) .
Найдено,В С 70,7; Н 10,0 .
СЩНУ 04
Вычислено, Ъ: С 70,96; Н 10,12. чнакс 980, 1700, 1720 см 1
Пример 3. 7- 15-(3-окси-5-метилгекс- 1-енил) -2-оксо-циклопентил)—
- энантовая кислота.
Получают 6- (7-оксигептил)-7-(5-метил-3-оксогекс-1-енил)-1,4-диоксаспиро 4,4 нонана.
Так же,как описано выше в примере 2, g,для прйготовления б-(7-оксигептил)1,4-диокса-7-(3-оксоокт-1-енил)-спиро (,4,4) нона, но заменив тексаноилметилен-45 трифенилфосфоран соответствующим количеством 3-метилбутирилметилентрифенилфосфорана, получают сырой 6-(7-оксигептил)-7-(5-метил-3-оксогекс-1-енил)-1,4-диоксаспиро14, 4) нонан. Продукт используют для получения 7-4 7-(5-метил-3-оксоокт-1-енил)-1,4-диоксаспиро(4,41 нон-6-ил -энантовой кислоты без дополнительной очистки, g. Получение 7 †(7-(5-метил-3-оксогекс-1-енил)-1,4-диоксаспиро(4,4) нон-б-ил -энантоной кислоты.
Как описано выше в примере 2, Т, ! для приготовления 7- 1, 4-диокса-7-(3-оксоокт-1-енил) спиро t4, 41-нон-бил энантовой кислоты, но йри замене б- (7- оксогептил) -1, 4-диокса-7- (3-оксоокт-1-енил) -спиро 14,4) нонана
Ю соотнетствующим количеством 7- (1 4М
-диокса-7- (3-оксоокт-1-енил) -спиро (, ) (4 4) нон-б-ил ) -энантовой кислоты, получают 7- (7- (5-метил-З-оксогекс-1-нил)-, -1, 4-диоксаспиро (4, 4) нон-6-ил энантовую кислоту.
Ш.Получение 7- (5-(3-окси-5-метилгекс-1-енил)-2-оксоциклопентил -энантовой кислоты
Так же, как описано выше в примере 2, Ш для приготовления 7" (5-(3оксиокт-1-енил)-2-оксоциклопентил)— — энантоной кислоты, но при замене
7- {1,4-диокса-7-(3-оксоокт-1-енил)-спиро(4,4)-нон-б-ил -знантовой кислоты,,соответствующим количеством
7- {7-(5-метил-3-оксогекс-1-енил)—
-1, 4-диоксаспиро (4, 4) нон-6-ил -знантовой кислоты получают 7- {5- (3-окси 5-ме тилгеус-1-е нил) -2-ок со циклопе нтил)- энантовую кислоту.
Найдено,Ъ: С 69,9; Н 9,7.
ФЯ 33 4
Вычислено,В: С 70,3; Н 9,9.
Строение полученного продукта подтверждено ИК и ПИР спектрами.
Пример 4. 7- (5-(3-циклопентил-3-оксипроп-1-енил) -2-оксоциклопентил -энантовая кислота.
1. Получение 7- (3-циклопентил-3— оксопроп-1-енил)-6-(7-оксигептил)— — 1,4-диоксаспиро 4,4 нонана.
Так же, как описано выше в примере 2, 1 для приготовления 6-(7-оксигептил)-1,4-диокса-7-(3-оксоокт-1-енил)-спиро (4,4) нонана, но при замене гексаноилметилентрифенилфосфорана соответствующим количеством циклопентилкарбонилметилентрифенилфосфорана, получают сырой 7-(3-циклопентил-3-оксопроп-1-енил)-6-(7° оксигептил)-1,4-диоксаспиро(4,41нонан. Этот продукт использовали для получения 7-(7-(3-циклопентил -gоксопроп-1-енил) -1,4 диоксаспиро
t4.41 íîí-6-ил1- энантовоя кислоты беэ дополнительной очистки.
g.Получение 7- (7-(3-циклопентил-3-оксопроп-1-енил) — 1,4-диоксаспиро (4,4) нон-6-ил -энантовой кислоты.
Так же, как описано ныше в примере 2,)) для приготовлейия 7- jl 4-диокса-7-(3-оксоокт-1-енилНспиро (4,4) нон-б-ил1-энантовой кислоты, но при замене 6-(7-оксигептил)-1,4-диокса-7-(3-оксоокт-1-енил)спиро 4,41нонана соответствующим количеством 7-(3-циклопентил-3-оксопроп-1-енил)-6-(7-оксагептил-1,4-диоксаспиро (4,41 нонана, получают 7- (7-(3-циклопен.тил-3-оксопроп-1-енил)-1,4-диоксаспиро4,4-нон-б-ил -энантоную кислоту. Этот продукт испольэовали для получения 75-(3-циклопентил-3-оксипроп-1-енил)-2 оксациклопентил -энантоной кислоты беэ дополнительной очистки.
Д Получение 7-(5- (З-циклопентил,->-оксипроп-1-енил) -2-оксациклопентил) -эиантовой кислоты.
582754
19
Так же, как описано выше в примере
2, Щ для приготовления 7-j5-23-оксиокт-1-енил) -2-оксоциклопейтил -энантовой кислоты, но при замене 7-(1,4-диокса-7-(3-оксоокт-1-енил)-спиро (4,4) нон-65
-ил -знантовой кислоты соответствующим количеством, 7- (7- (3-циклопентил-3-оксопроп-1-енил) -1,4-диоксаспиро (4,4) нон6-ил) -энантовой кислоты получают 7-{5-(3-циклопентил-3-оксипроп-1-енил)-2-оксоциклопентил — энантовую кислоту.
Найдено,Ъ: С 71,1 H 9,4.
С20 НЗ 04.
Вычислено, %: С 71, 4 у Н 9, 5.
Пример 5. 7- j 5- (3-окси-4-метилок т-1-е нил) -2-оксоциклопентил .— энантовую кислоту (0,30 г), приготовленную, как описано в примере 1, дополнительно очищают и разделяют на два диастероизомера хроматографией в тонком слое на силикагеле, применяя для элюирования смесь этилацетата, цикло-. гексана и муравьиной кислоты (40:40:1 по объему). Хроматограмму элюируют четыре раза смесью растворителей, высушивая при комнатной температуре после каждого элюирования. Положения дву ( полос обнаруживают при опрыскивании небольшой полоски хроматограммы раствором фосфомолибденовой кислоты в этаноле (10 вес.Ъ). Каждую полосу снимают З0 с опорной стеклянной пластинки и экстрагируют диэтиловйм эфиром в аппарате
Сокслета.После испарения эфира получают два диастереоизомера 7- (5-(3-окси-4-метилокт-1-енил)-2-оксоциклопен- 35 тил -цнантовой кислоты, структура которых.подтверждена ПМР-спектрами °
Пример б. Аналогично опи ;нному в примере 5 и при применении такой же смеси растворителей для элюирования )0
7- {5-(3-оксиокт-1-енил)-2-оксоциклопентил1- энантовую кислоту, полученную, как описано в примере 2, разделяют на:два компонента (вероятно, диастереоизомерные пары энантиомеров) хроматографией в 45 тонком слое на силикагеле.
Один иэ изомеров представляет со бой новый диастереоизомер, 2- сС-(6 карбохсигексил) -3p †(3- р оксиокт-1-енил)-циклопентанон,а другой являет- 6( ся известным диастереоизомером — 2-А . †(6-карбоксигексил)-3 ф †(3- Р -окси- .
-окт-l-енил)-циклопентаноном.
Пример 7 ° 7-{5-(3-оксинон-1-енил) -2-оксоциклопентил энантовая кислота. Получение 6-(7-оксигептил)-1,4-диокса-7- (3-оксонон-1-енил) -спиро (4, 41 нонана.
Аналогично описанному в примере lЯ, для приготовления б- (7-оксигептил)-1, 4диокса-7- (3-оксо-4-метилок т-1-енил спиро (4,41нонана, применяя в качестве исходного продукта cooTBeTcTBy èe количества гептаноилметилентрифенилj фосфорана, получают сырой б- (7-оксигептил) -1, 4-диокса-7- (3-оксонон-2енил)-спиро (4,4) нонан, достаточно чистый для применения в качестве исходного продукта для получения 7- {1,4.диокса-7-(3-оксонон-1-енил)спиро (4,4) нон-6-ил -энантовой кислоты, описанной ниже, Е.Получение 7- (1,4-диокса-7-(3-оксонон-l-енил)-спиро(4,4) нон-6-ил —
-энантовой кислоты.
Аналогично описанному в примере 1 Я из соответствующего количества б-(7-оксигептил) -1,4-диокса-7-(3-оксонон-1-енил)спиро (4,41нонана получают
7- {1,4 -диокса-7-(3-оксонон-1-енил)-спиро (4,4) НоН-б-ил -энантовую кислоту. 9 окС 1620, 1660, 1700 см (Я,Получение 7- j5-(3-оксинон-1-енил)-2-оксоциклопентил) -энантовой кислоты.
Аналогично описанному в примере 1,Я иэ соответствующего количества.7- 11,4-диокса-7-(3-оксо-4-метйлокт-1-енил)спиро 14,41 ион -б-ил -энантовой кислоты, получают 7- (5-(3-оксинон-1-енил)—
"2-оксоциклопентил -энантовую кислоту.
Найдено,%: С 71,3; Й 10,3.
С2, Hgg О
Вычислено,В: С 71,61 Н 10,3.
> Строение продукта,потверждено ИК-и
ПМР-спектрами.
Пример 8. Аналогично описанному в примере 2,Щ для получения
7- (5-(3-оксиокт-1-енил) -2-оксоциклопентил -энантовой кислоты из соответствующих количеств: а) 7- {1,4-диокса-7-(3-оксодец-lенил)-спиро (4,4)нон-б-ил . энантовой кислоты, б) 7- {1 4-диокса-7-(3-оксодец-1-енил)
-спиро (4, 4) нон-6-ил — энантовой кислоты. в) 7- 11, 4-диокса-7- (3-оксогепс-1-енил)-спиро (4,4)-нон-б-и+энантовой кислоты, r) 7- {1,4-диокса-7-(3-оксогекс-l-енил)-спиро (4,41нон-б-ил -энантовой кислоты, д) 7 (7- (5-метил-3-оксоокт-1-енил)-1 4С
-диоксаспиро (4,4) нон-б-ил) энантовой кислоты, е) 7- (7-(6-метил-3-оксоокт-1-енил), 4-диоксаспиро (4, 4) нон-б-ил - энантовой кислоты, ж) 7- 7-(7-метил-3-оксоокт-1-енил)-1,4-диоксаспиро f4,4) нон-б-ил) энантовой кислоты, з) 7- (7-(3-циклогексил-3-оксопроп-1-енил)-1,4-диоксаспиро f4,4)нон-б-ил энантовой кислоты, и) 7- )(7-(3-метокси-3-оксосЬт-1-енил)-1,4-диоксаспироf4,4) нон-б-ил)
-энантовой кислоты получают соответственно> а) 7-(5- (3-оксидец-1-енил)-2-оксоциклопентил -энантовую кислоту.
Найдено,Ъ: С 72,41 Н 10,4
582754
22
СФ2 НЪВ 04
Вычислено,Ъ С 72,2) Н EOð4. б) 7-(Ь,(3-оксидодец-l-енил)-2-оксоциклопентил -энантовую кислоту.
Найдено,%г С Ъ3,0) Н 10,6 °
С,Н4104Вычислено, Ъ: С 73, 1, Н 10,7. в ) 7- (5- (3-ок сигепт-1-енил) -2-оксоциклопентит3 -энантовую кислоту.
Найдено,Ъ: С 71,0, Н 9,5.
С(Н 0 .
Вычислено,Ъ: С 70,5» Н 9,9.
r) 7-(5-(3-оксигекс-1-енил)-2 ñîциклопентил -энантовую кислоту.
Найдено,Ъ: С 69,4) Н 9,8.
38 30 4
l5
Вычислено, Ъ | С 69, 8,Н 9,7, д) 7- j5-(3-окси-5-метилокт-1-енил)-2-оксоциклопентил -энантовую кислоту.
Найдено,Ъ« 71,6; Г 10,4. 20
С Н Б 04 .
Вычислено Ъ: С 71,6; Н 10,3> е) 7- j5-(3-окси-б-метилокт-E-енил)-2-оксоциклопенти+энантовую кислоту.
Найдено,Ъ: С 71,2; Н 10,6. ЯБ и)(1БО4
Йычислено,Ъ| С 71,6; Н 10,3. ж) 7- (5-(3-окси-7-метилокт-1-ения)-2-оксоциклопентил -энантовую кислоту.
Найдено,Ъ: " 71,2; Н 10,1. 30
С23 НВ&ОФ
Вычислено, Ъ: С 71, б Н 10, 3. э) 7- (5-(3-циклогексил-3-оксипроп-l«енил)-2-оксоциклопентил)-энантовую кислоту. 35
Найдено,Ъ: С 71,2; Н 10,3.
С2 Н 04 . 1/4 H®0
Вычислено,Ъ| С 71,1; Н 9,7. и) 7- (5-(3-окси-8-метоксиокт-1-енил)—
-2-оксоциклопентил)-энантовую кис40 лоту.
Найдено,Ъ1 С 68,5; Н 10,2.
НЗБ 05
Вычислено,Ъ: С 68 5; Н 9,8.
Пример 9, 7- (5-(3-адамантил-3-оксипроп-1-енил)-2-оксоциклопентил »
45 энантовая кислота.
1.Получение 7-(3-адамантил-3-оксопроп
Смесь 7-формил-6- (7-оксигептил-3-оксопроп-1-енил) -1, 4-диоксаспиро (4,4) нонана (2,7 г), полученного, как описано в примере 1, Я, и адамантилкарбонилметилентрифенилфосфосфорана (4,38 r) в .гексаметилфосфор7триами- Щ де (60 мл) нагревают на паровой бане в течение четырех дней ° К охлажден ной реакционной смеси добавляют Диэтиловый эфир и выделившееся твердое вещество отфильтровывают. Фильтрат е@ промывают дважды водой, сушат безводным сульфатом натрия и выпаривают.
Получают 7-(3-адамантил-3-оксопроп-1-енил)-6-(7-оксигептил)-1,4-диоксаспирс 4,4)нонан. Этот, продукт используют 65 для 7- j7-(3,-адамантил-3-оксопроп-1— енил)-1,4-диоксаспиро 14,4) нон-б-ил энантовой кислоты без дополнительной очистки.
N,Ïîëó÷åHèå 7- (7-(3-адамантил-3-оксопроп-l-енил)-1,4 -диоксаспиро(4,41 нон»
-б-ил - энантовой кислоты.
Аналогично описанному в примере 2,Й для 7- (1,4-диокса-7(3-оксоокт-l-енил)— спиро(4,4) нон-б-ил) -энантовой кислоты, из соответствующего количества
7-(3-адамантил-3-оксопроп-1-енил)-б-(7-оксигептил)-1,4-диоксаспиро (4,4) ионана, получают 7- (7-(3-адамантил-З-оксопроп-l-енил)-1,4-диоксаспиро (4,4) нон-6-ил ) - энантовую кислоту.
Ш.Получение 7-f5-(3-адамантил-3оксипроп-1-енил)-2-оксоциклопентил)энантовой кислоты.
Аналогично описанному в примере 2,Rl получению 7- (5-(3-оксиокт-1-енил)2-оксоциклопентил -энантовой кислоты из соответствующего количества 7-(7-(3-адамантил-3-оксопроп-l-енил)-1,4диоксаспиро14,4)нон-б-ил энантовой,кислоты получают 7- 1 5-(3-адамантил-3оксопрон-1-енил)-2-оксоциклопентил)-знантовую кислоту.
Строение которой подтверждено ИК-и
ПИР-спектрами.
П р и и е р 10. 7- (5- (3-циклопентил-3-оксипроп-1-енил) -2-оксоциклопентил j -энантовая кислота.
Раствор 7- (5-(3-циклопентил-3-оксипроп-1-енил)-2-оксициклопентил)-энантовой кислоты (1,0 г), приготовленной, как описано в примере 4, в этаноле (50 мл) каталитически восстанавливают водородом при давлении 7 кг/chf
В присутствии в качестве катализатора
5Ъ палладия на угле при комнатной температуре в течение 3 час, Затем катализатор отфильтровывают, испаряют этанол; получают 7- 5-(3-циклопентил-3оксипроп-1-енил) -2-оксациклопентилэнантовую кислоту (0,8 r) .
Чистый образец этой кислоты, получают хроматографированием в тонком слое на силикагеле, применяя для элюирования смесь этилацетата, циклогексана и муравьиной кислоты (40:40:1 по объему) .
Найдено,Ъ: С 70,7 Н 10,0.
С Н
Вычислено,Ъг С 71,0;:Н 10,0
ИК-и ПМР-спектры соответствуют полученному соединению, Пример 11. 7- {5-(3-оксиокт1-енил) — 3- метил-2-оксоциклопентил)энантовая кислота.
«Т.Получение 3-оксо-2-(7-(2-тетрагидропиранилокси)-гептил -циклопентанкарбонитрила.
3,4-дигидро-2Н-пиран (7,3 r) по каплям добавляют при перемешивании и температуре 40 С . к смеси 2-(7-оксигептил)-3-оксоциклопентанкарбонитри582754
23
24 ла (10 r) приготовленного, как описано в примере 1, Q и концентрированной соляной кислоты (4 капли). Перемешивают при 65 С в течение 1 час.
Охлаждают, к раствору добавляют бензол (50 мл), промывают водным раствором бикарбс5Мата натрия, а затем водой и сушат сульфатом натрия. Растворитель удаляют в вакууме и получают
3-оксо-2- 17-(2-тетрагидропираыилокси)-, -гептил) -циклопЕнтанкарбонитрил (15 г).
Этот продукт используют для получения
4-этоксалил-3-оксо-2- (7-(2-тетрагидропиранилокси-гептил -циклопентанкарбонитрила, без дополнительной очистки.
15 й.Получение 4-этоксалил-3-оксо-2- 7- (2-тетрагидропиранилокси) -гептил
-циклопентанкарбонитрила.
Охлажденный льдом раствор 3-оксо-2- 7-(2-тетрагидропиранилокси)-гептил ) -циклопентанкарбо