Способ получения производных имидазола
Иллюстрации
Показать всеРеферат
ОП ИСАН И Е, ИЗОБРЕТЕН ИЯ
К ПАТЕИТУ ю
Союэ Советских
Социалистических
Республик (11) 58581,0 (61) Дополнительный к патенту
1 (22) Заявлено 20,06.74(21) 2045953/04 (51) М, Кл.о
С 07 З 233/70
/!А 01 8 9/22 (23) Приоритет - (32) 21.06,73 (31) 29535/73 (33) Великобритания государственный квинтет
Совета Мнннстроо СССР оо делам нзобретеннй и открмтнй (43) Опубликовано 25 12 77 Бюллетень №47 (53) УДК 547.781. .785.07 (088.8) (46) Дата опубликования описания 23.ii.77
Иностранцы
Роберт Фредерик Брукес, Дэвид Генри Годсон, Энтони Фредерик Хэмс, Дэвид Майкл Вэйтон и Вилфред Хэйс Валс (Великобритания)
Иностранная фирма
"llae Бутс Компани Лимитед" (Великобритания) (72) Авторы изобретения (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИМИДАЗОЛА
N
CXR R где одно из значений С и у — водород, а
15 другое СХ2,, где 3 — галоген или(- водород, а у — группа формулы: сх — и—
Изобретение относится к способу получения производных имидазола, обладающих фунГнцндной активностью.
Применение широко известной реакции
Взаимодействия имидазола с хлорсодержашими соединениями позволяет синтезировать новые активные соединения (1 .
Предложен способ получения производных имидазола формулы
Ъ где Х вЂ” кислород или сера, Я вЂ” заме>щенная апкильная, алкенильная, алкинипьная, цнклоалкильная, фенильная, фенилалкильная, фенилалкенильная, феноксиалкильная, или
2.i фенилтиоалкильная группа, Й -замешен1 ная фенильная, фенилалкильная, фенилалкенильная, феноксиалкильная или фенилтиоалкильная группа, причем, когда V, -метильная или фенильная группа, % — замешенная- фенильная группа или замешенная фенил- 2а
2 алкильная, фенилалкенильная, феноксиалкиль-. ная или фенилтиоалкильная группа, Сущность способа заключается в том, что с ое динен не формулы: Д Н g q (Ц ), 2 где Д и Я имеют указанные значения
3 подвергают взаимодействию с соединением формулы
Рекомендуется осуществлять реакцию в присутствии подходящего агента, служащего для связывания кислоты. Таким агентом может явиться третичный амин, такой, как триэтиламин или пиридин, или же избыток
5858 10 ямидазольного реагента, и этот агент служит для поглощения галоидоводорода, образующегося при протекании реакции, В другом варианте реакцию можно вести с получением сначаща производного щелочного металла и имидазола., например, g -натриевого производного, с последующим введением его во взаимодействие с галоидангидридом карба- миновой или тиокарбаминовой кислоты. Эта реакция может быть осуществлена при тем- пеоатуре находящейся в интервале между о
0 С и 200 C предпочтительно в пределах о о между 50 С и 150 С, Галоидангидрид карбаминовой кислоты или галоидангидрид тиокарбаминовой кислоты, 5 описываемый общей формулой Е, может быть получен путем проведения реакции между вторичным амином, описываемым
2 обшей формулой Н и Я R с фосгеном или тиофосгеном, описываемым общек формулой
СХЕ . Вторичный амин Н И R Я может быть получен любым из известных, применяемых для этой цепи методов. Так, например, он может быть получен путем проведения реакции между первичным амином
2 описываемым общей формулой Я ЙН Н Н и ЯЯ
2 с соответствующим алкилгалогенидом, опитъ2Л сываемым формулой Я или R g где g— атом гал ои да, пре дп очтительно бр ома.
Пример 1. 44 r хлорангидрида gp
Я -2-хлорфейип-И -пропилкарбаминовой кислоты, 14 г имидазола и 30 мл триэтиламина нагревают при температуре кипения с обратным холодильником, в 200 мл безводного тетрагипрофурана в течение 5 ч.
Реакционную смесь выливают в 2 литра воды. Липкий твердый кристаллический продукт собирают, промывают водой и сушат в вакууме. Этот продукт перекристаллизовывают из смеси толуола и легкого петролей- 40 ного эфира Ц ракция, кипящая при температуре 62-68 С) с использованием древесного угля. После охлаждения выделяется масло, которое вскоре затвердевает с образованием
1- (Я -2-хлорфенил-К -пропилкарбамил)- 4s
-имидазола. Т. пл. 75,5-76,5 С, Хлорангидрид hl -2-хлорфенил-Й -пропилкарбаминЬвой кислоты готовят .следующим способом:
Раствор 255 г 2- хлорацетанилида в
900 мл безводного тетрагидрофурана црибавляют к охлаждаемой водой, перемешиваемой суспднзии 75 г гидрида натрия (504-ная суспензия, вес) в том же Оастворитепе.
После ослабления выделения водорода, смесь перемешивают в течение 10 мин и по каплям прибавляют 140 мл бромистого пропила. Смесь нагревают в течение 2 ч при температуре кипения с обратным холодильником, после чего добавляют 50 мл бромистого пропила и нагревание продолжаютвести в течение 16 ч, Осадок бромистого натрия собирают и промывают безводным тетрагидрофураном, После выпаривания органического фильтрата получают маслообразное вещество, которое нагревают при температуре кипения с обратным холодильником с
750 мл концентрированной соляной кислоты и 750 мл динатурированного спирта в течение 46 ч, По прошествии 19 и 27 часов нагревания, добавляют дополнительно 250 мл и 125 мл концентрированной соляной кисло:ты. Органические растворители удаляют при
;пониженном давлении и охлажденный кислый
I раствор подщелачивают концентрированным раствором гидрата окиси натрия. Органический слой экстрагируют диэтиловым эфиром, сушат, упаривают и получают маслообразное вещество, После перегонки получают 2-хлор- Я -пропиланилин, в виде масла, кипящего при температуре 89-92 С при 3,0 мм рт. ст.
22 r этого продукта растворяют в 100 мл этилацетата и прибавляют к 150 мл этилацетата, через который барботируют фосген, при температуре кипения с обратным холодильником. Фосген пропускают в течение 1,5 ч после чего барботирование прекращают, После выпаривания этилацетата получают маслообразное вещество, которое подвергают перегонке. Получают хлорангидрид g -2-хлорфенил- К -пропилкарбамино-i вой кислоты, т.кип. 132-133 С при 3,0мм рт.ст.
Аналогичным способом получают карбамилимидазольные сое динения, описываемые обшей формулой I, где Х вЂ” кислород, Полученные продукты перегоняют в вакууме., и
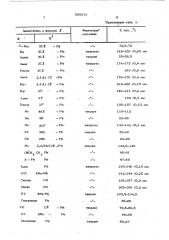
В табл,- 1 приведены свойства полученных соединений.
5858 10
Заместитель в формуле1 о
Т, кип., С
Физическое состояние
2C0
4СР
-Ph
- РИ жидкость твердое
- РИ
- РИ
ЗСР
4СЕ жидкость
Ф твердое
- РИ
- P4
Et
Рр
ЗСК
4BV
3,4j j Cg
ЗСЯ
- РИ
-РИ
Ме
Pv, r
r
° »»
Ф
»Ю ю
ЕФ
Ме
4Р
2Р
- РИ
-Pb
» 4»
» Ю
52 5 53,5
66в5 6895
Ме,, Et
РИ вЂ” РИ
ЮЮ
° Ю»
65,5-67,5
53,5-55, 2Р
ЗР
67-68, S
36-38
- РИ
» »РИ
Pv
Ме жидкость твердое
E-"
fB
2,5di CE.
4С0
- Pff
- Ph жидкость твердое
- РИ - Р
Ме
Ме
177,5-179
73-74
- РИ
- РИ
4C0
3F
Амип
-РИ
-РИ г,54< cg
4F
4 Cg
4 СР
Гексил
И -Bu
-РИ
- РИ жидкость твердое
-PB
- PH-Ви
Е 89,5-91
70,5-72
2 Cg
2,4.d(CP
Ме
i -Р
2,4 Дл СК
4СР
87,5-89,5
78-79 — РИ вЂ” РИ жидкость твердое
- РИ
- РИ.
78-79,5
70,5-72
î ô. р.- ВЦ Э
4 Pr, 5- Ви
3,4,Д Я .- РИ
3,4 ЗАСЫ- Ри
4Р -РН
2,5gj СР - РИ
2 4Д4 CE ,.4С g гс гс
Табпина 1
148-149/0,5 мм
44-47
80-82
1 52«154/0,25 мм
67-69
57-59
87-89
64-66
70-71
82W3
134/0,1 мм
102-104,5
108-110
154-156/0,15 мм
49-50
72-74
106-108
59-6 1
170-171 /О,г мм
76,5-78,5
82-83
147-149 /0,08 мм
585810. <- Ви
2С2
70,5-72
ЗСХ
4СЯ
РИ..
Вц жидкость твердое
55-56, 5
- РИ
Аллил
Амип
Гекс ил
Амип
2СЯ жидкость
2С2 — РИ
2,4.Д j C0 -РИ
24dj Cg - РИ
2F. — РИ-РИ
Амип
Гекс ил
4+8
Ме твердое
Ме
53-55
Ме
2С8 жи дкос г ь
EE твердое
2ВФ
Ме 2,4,Sent (Cg -РИ твердое жидкость твердое
58 -60
Е6
79, 5-80, 5
66-68
66-67 твердое
РИ
Окта децил твердое сцсн сн Рй
3-РЬ РИ
Амид РИ
Рр 4Ме-РЙ!
Гексил . P И
Октил РИ"
Е Ф- 4Ме-РИ
Гексадецил РК
- РИ
- РИ
- РИ
- РИ-. — РИ вЂ” РИ
;Продолжение табл. 1„
149-150 /0,05 мм
174-175 /0,4 мм
185 /0,6 мм
176-178 /0,4 мм
165-166 /0,15 мм
140-141 /0,2 мм
153 /0,3 им
1 56-157 /О, 1 5 мм
110-112
140-142 /0,4 мм
58-60
93-95
144,5-146
90-91
47-49
139-140 /0,15 мм
142-144 /0,25 мм
153-157 /0,3 мм
165-168 /0,2 мм
103,5-104,5
585810 9
- РИ
4Вц
Ме жидкость
2Ме -РИ
Аплил
Нонил
Уидецил
Ме твердое
Мо
Ви. жидкость
Ме твердое
Трет, BO
T5-77
Ме
89-90,5
127- 1 28,5 твердое
Ме
Ме
57-59
87-89
180 /1 мм жидкость
4ЕФ О - Ри.
4 И О - РИ. 2Ме-4С вЂ” РИ
2,4Д Ме - РИ
2Ме-4С Х - РИ
2,4,513 С0, РИ 4Ме — РИ
2,5/i Ме - РИ
2МеО - РИ
2,5/3 Ме- РИ
2,5gjMe - РЬ
Е Ь СО СН 4СР - РИ
25d4Me -РИ
3,4ч3е Ме - РИ.
ЗМе0-РИ
3,53 Ме - РИ2,5di Me - РИ
ЗСЯ-4Ме - Ри
ЗСР -4Ме - РИ
;.-Продолжение табл. 1
53-55
87-89
1ф4-156 /0,2 мм
182 /0,15 мм
150-152 /0.1 мм
138-139 /0,2 мм
176-177 /0,1 ам
192-194 /0,2 мм
160/О, 15 мм
122-124
8 1-82,5
61-63
11 1-.113
143-144 /0,1 мм
70,5-72
8 5-86,5
75-77
68-70
70,5-72
129,5-13) 5858 10 о
T. кип., С
Физическое состояние
М
ВИМе
Вц твердое
СЯ» Н
СИСН
Вц.. жидкость
Вц
Ви
СКН CH твер дое
Pr жидкость
Ви твердое жидкость твердое
44-46
ВИ
4Ме - Pg гвераое
ЗСР -РИ3
Ме жидкость
124 твердое
3аместитель в формуле
ЗСО -4Ме - РИ
44 -Р». - Pff.
41 -Pp — РИ4» -Pv - РИ.
4) -Р -РИ
3,44 jау -Ph 2Ме -4CO- РИ
2Ме-4С 0 — РИ
2Ме-Р И
3 Ме-РИ
4C g — РИ
2Ме-РИ
САН СН 2С 3--РИ
2 2
3,4,5 Ь"(С Р -РИ
3,4, 5 Ь » С К -Р И
4 Трет. Ви- - РИ
2В».» -4МЕ-РИ
4СМ -РИ..
4Ме Д 02 -РИ
PH ЗС Г -PQ
2,4Д j Ме-РИ4С Х -PH
12
Ж ааыжеиие таб. 1.
184-186 /1 мм
160-161 /0,5 мм . 155 /ОЛ им
166 /0,4 мм
161-162 0,5 мм
152-1 54
132-134
4 1-43
149-151 /0,3 мм
153-154 /О, 3 мм
108-110
139-141 /0,2 мм
200-202 /0,25 мм
190-1 92- /О, 2 мм
143-145
159-160 /0,3 мм
163-166 /0,25 мм
145-147
138-140
ll8-12О
72-73
44-46
128-129 /0,2 мм
13 2-134 /О, 2 мм
5858 10
Биклогекс ил
77-79
104-106
ll0-ll2
138-140
4Р- РИ
4Ме-РИ
ЗС0-Р ff
4МеО-P И
Р.И
А5 97
82-84
4Ме0- РИ
Ме
Гептил йеиил жидкость твердое
Аллил жидкость
2-Метипапдип 4cg- РИ
2, 3-дихлораллил вц твердое
Ви жидкость твердое жидкость твердое
ОО-9,2
72 74
P CH
4 Bt -РИ жидкость твердое ФХТР 2СН2
4СР- РИ СН
2,4с 1 CP
4 Ме -РИ
3Ci -РИ
ЗСЯ-4Ме»РИ
2Ск -РИ
2КО -4C0 — РЙ
2 C0 - РИ
2СР -4 Й О -РИ4Ме0-РИ
4С0- РЦ
4 Вд-РИ
4Вн-РИ
2С0 -5CF — РИ з
2С8 -5CP - РИ.
2H0 - 4МеО-РИ2
qCE -РИ
2,4ЙС Р вЂ” РИ
2,43) C0 - РИ
4ВК - Рп
14
:.Продовкеыие табл. 1
115-13. 7
49-51
198-200 /0,4 мм
227-230 /0,3 мм
116-118
70, 5-7 2
91-93
170-172 /0,5 мм
144-1 46
18О 182 /0,1 ым
175-177 /0,5 мм
162-164 /0,2 мм
Ы5-107
156/0,6 мм
151-153 /0,05 мм
210-213 /0,5 мм
149-..150
5858 10
" 15
",Продолжение табл. 1
59,5-6 l
107-10 9
144-146
137-138,5
РН CH
90-92
78-8 1
97-99
РВСН СН
PhCH СН
4Cg -РИ
84-85
30
4Ме -РИ СН2 4 Ме-РИ
Р.Q CH 2
4 С0 -РИ
4Ме-РИ 4Ме- РИ
P И СН2 4Ме0-РИ
4 Яе-Р} СН 2,4Д j С0 Р
Пример 2. Смесь состоящую из
12,3 г хлоангидрида Я -4-хлорбензил-Я-пропилкарбаминовой кислоты и 6,8 г имисазолв нагревают при температуре кипения с обратным холодильником в 75 мл безводного тетрагидрофурана в течение 5 ч.
Отфилвгрованную реакционную смесь выпаривают и продукт растворяют в диэтиловом эфире, промывают водой, эфирный раствор высушивают и выпаривают, прибавляют петролейный эфир, .охлаждают, получают твердый зб продукт, который выделяют перекристаллизацией из смеси толуола и легкого петролейного эфира, Получают 1-(М-4-хлорбензил- К -пропилкарбамил)-имидазол, т. пл. Во91 С, 40
Хлорангидрид Й -4-хлорбензил- Я вЂ” нро-. пилкарбаминоврй кислоты готовят следующим способом;
Раствор 48,3 r хлористого 4-хлорбензила в 40 мл ацетонитрила прибавляют к сме- 45 си, состояшей из 18 г пропиламина, 12,6 г гидрата окиси натрия, 50 мл ацетонитрила и 30 мл воды. Смесь подвергают периодическому встряхиванию в течение 45 минут.
Происходит экзотермическая,реакция и в 50 нижней фазе выделяется твердое белое вещество, По прошествии четырех суток реакционную смесь выливают в 1 литр воды и органическую фазу экстрагируют диэтиловым эфиром, После перегонки эфирного экстракта получают маслянистый продукт, g -4 хлооо бензил-К -пропиламин, т. кип. 101-105 С при 1,7-2,5 мм рт.ст.
Раствор 25,2 r Й -4-хлорбензил- N-пропиламина в 150 мл этилацетат прибавляют к 150 мл этилацетата при те апературе кипения с обратным холодильником и барботировании через раствор фосгена. Фосген пропускают в течение 2,5 ч, после чего этилацетат выпаривают для получения маслянистого продукта.
После перегонки получают маслообразный хлорангидрид N -4-хлорбензил- Й -пропило карбаминовой кислоты, т,кип, 162-164 С; при 4 мм рт.ст.
Аналогичным способом получают карбамилимидазольные соединения, описываемые общей формулой j, где Х вЂ” кислород.
Полученные продукты перегоняют в вакууме.
В табл. 2 приведены свойства полученных соединений.
5858 10
68-69
105-10" твердое
Ме
60-62
Ме
Ме
57-59
РИ CH
48-50
58-60
39-91
Аллил
В И I j Р i. - Ви. жидкость
8 1-83
73-75 твердое
Аллил
Аллил жидкость твердое
79-80 жидкость твердое
3 4d;CP - РИ CH
2,4diCt — РИ СН
- PI1 СН
2Ме0-Р И СН
4С0-РВСН
4СР— Ph СН2
4СР -РИ СН
4КО - РИСН
4К΄— Рй СН
«0 -Ph СН
4 -ЯО -Pff СН
2,4di Cg — РCH
2,4di Cl РИ СН
2,4 j СР— Ph СН
Нг
2,4dj СР— РИ CH
2 Cg- РИСН
2 CP -PQ СН
4 С0 -РИ СН
4Ме0-Р Q CH
2Cg -РИ CH
2С PQ СН
3,43 j СР— РИ СН
3р4d)Cf -P И СН
Таблица .
111-1 12,5
107-109
83,5-85
1 20-121,5
18 9,5-1 91
11 9-121
123-125
80-8 2
102-104
119-121
194/0,5 мм
180-18 /0,35 мм
66-68
170-172 /0,25 мм
106-108
97-99
5858 10
19 а.ыдкцсть твердое
Ц СН
Вм жидкость
Биклопентил тверpoe жидкость
2, 3-дихлораллил
РИ СН жидкость тре бутип
87-88,5 жидкость жидкость
p+-B0
4С0 -РИ СН
4С - P@СН
Гексил жидкость твердое трет-бутип
4Ву; -РИ СН
РИ СН, 4 С.3 -РИ СН твердое
Циклигексил
Биклогексил жидкость твердо.е
4 ВИ .-РИ СН твердое
4 CE -РИ СН
Децил
2Метилаллил () p жидкость твердое жидкость
8 1-83
73-75
13 2-134 твердое
Е ОСН СН жидкость
4 CN-Р,Q CH
BI"
102-104 твердое
Cg — РИ СН
РИ СН,, 2
2,44j Cg -РЬ СН
l, 1-Диметил прон-.2-инил 4 CR -РИ СН
2-клораллил P И СН
2,4 d1 СР РИ СН2 твердое, 2-метилаллил 2,4diC g РИ СН
2,4di СВ РВСН
4 С8-РИ СН
4М -Рп СН2
4Bl -РИ СН2
2С0 -РИ- СН, 2CP -Р,И CH
Ф
2,6Д1СР РИ СН2
2,4Дj CP РИСК
20 ./ Продолжение табл. 2»
163-165 /0,1 мм
62-63,5
171-172 /0,4 мм
204-205 /0,3 мм.
101-103
179-181 /0,8 мм
195-197 /0,6 мм
188-190 /0,3 мм
180-183 ) 0,1 мм
185-187 /0,08 мм
109«11 l
107,5-108,5
130-131 /0,15 мм
120-121,5
66,5-68
212-215 /0,1 мм
55-57
72,5-74
194-198 /0,2 мм
198-200 /0,3 мм
5858 10
21 о
Т. кин„С
Фнзичес кое состояние
178«179 /О, Змм
Цикл опентил
Р4 СН
165-166 /0,4 мм
РИ СН
3,4gjCg -РИ СН
202-204 /0,2 мм
103-105
95-96,5
Е ОСН СН
Сй СН СН
Биклооктил твердое твердое
СК СН CH
РИ СH2
4 С3 -РИ СН2 жидкость жидкость твердое твердое
РИ CH
Ph CH2 жидкость
2,4J) Cg РЙ СН .
4 С0 -Р) СН
l, l -Диметилпроь-2-иннл
107-109 твердое
1, 1-диметилпроп-2-ипил
lO 1-103
1, 1-диметилпроп-2-ипил
3,4Д j С0 РМ СК
РВСН СН
109-111 твердое
161-163 /0,2 мм жидкость
Ph СН CH
2 2
Ph СН СН
Аллил
51-53 твердое
Ме
78,5-79,5
РИ СН СН
166 /0,5 мм жидкостЬ
Р СН СН
2 2
Р РН НССНН2
208-210 /0,3-0,4 мм
3 МеО-Рйсн СН2
P r ..
170-172 /0,4 мм
Заместатель в формуле ?
4« -Р,И СН
4CR -РИ СН
РИ СН
4СР -Р И СН
4Cg Р )ф СН
2 Я1СК Р1 Сн
2 Cg- РИ СН
Пример 3. 12,4 г хлорангидрида
Й -2-ллорфенил- К -пропил-тиокарбаминовой кислоты и 6,8 г имидазола нагревают ;при температуре кипения с обратным холодильником в 75 мл безводного тетрагидрофурана в течение 16 часов. Затем добавляют еше 2 г имидазола и нагрев продолжают еше В часов. После отделения обра- щ
202 206 /0,05-0,1 мм
206-210 /0,2 мм
122-124
109-110
225-229 /1-1,5 мм зовавшегося твер дого вешества, отгоняют тетрагидрофуран и получают маслообразное вещество, которое растворяют в хлористом метилене. Образовавшуюся органическую фазу промывают водой, сушат над сульфатом натрия и растворитель выпаривают для получения маслообразного вешества, которое кристаллизуется при обработке легким пет585810
Таблица 3, жидкость
139-141 /0,1 мм
4Ме-РИ
88-8 9
Ме твердое
4МеО-РЯ
4С0 -РИ
2СР -РИ
4СР-РИ
: Ме жидкость твердое
104,5-106
2СЕ -Р И СН
4СЕ -Рй СН
75, 5-77
62,5-63,5
Аллил
89,5;91 5
2,4 -дихлор
Et.
4СР -Р,h СН. i-Pu
119-120,5
23 ролейным эфиром и охлаждении, Получают
N - jg -2 хлорфенил- Я -пропил{тиркарбамил) ) -имидазола, т.пл, 59-61 С.
Хлорангидрид Я -2-хлорфенил- Я вЂ” пропил-(тиокарбаминовой кислоты) готовят следующим образом, Раствор 251 4 г 2хлор-Я-пропиланилина и 15,15 r безводнбго триэтиламина в
200 мл безводного диэтилового эфира прибавляют к раствору 13 г тиофосгена в 200 мл того же растворителя, при темперао туре -20 С, Реакдионную смесь нагревают до комнатной температуры, филнгруют, а отфильтрованный продукт промывают диэтиловым эфиром. Эфирный экстракт прибавляют
3 -PP 2,431 СР РИ СН2
Гексил 4C f -Р И
СЯСН СН 4СК-Р
IT р и м е р 4. Получение 1-(Я-2-фейоксиз гил- Я -ир опилкарбамил) -имидазола и сходных имидазолрв.
К 75 мл безводного тетрагидрофурана прибавляют 6,8 г имидазола и 12,0,75 г хлорангидрида ф -2-феноксиэтил- Я -пропилкарбаминовой кислоты. Реагенты кипятят с обратным холодильником в течение
24 ч. охлаждают до комнатной температурь
24 к эфирному маточному раствору и после сушки над сульфатом натрия выпаривают до получения. темно-окрашенного маслообраз,ного вещества. При выдержке его происходит кристаллизапия твердого вещества, которое отделяют от маслообразного соединения, Маслянистый фильтрат перегоняют и
Ф получают хлорангидрид Я -2-клорфенил- Я -пропил-(тиокарбаминовую кислоту), т. кип, 119-120 С при 0,4 мм рт.ст, Приведенные в табл. 3 тиокарбамилимидазольные соединения, описываемые общей формулой, где Х - сера, получены аналогичным способом. Полученные продукты перегоняют в вакууме для получения чистых . продуктов.
166-167 /0,15 мм
69,5-71
72,5-74
87-8 9
130-131,5
54,5-56,5 и филыгруют для удаления гидрохлорида имидазола, растворитель удаляют выпариванием его на паровой бане, а следы раст55 ворителя удаляют в вакууме, При этом остается маслянистый остаток, который эксч рагируют диэтиловым эфиром, промывают водой, сушат над безводным сульфатом натрия, удаляют растворитель и остаточное
60 маслообразное вещество перегоняют в вакуу
5858 10
Табпица4
Р11ОСН СН
R1OCH СН
РИОСН СН
POOCH CH
4С -Р 1 СН СН жидкость
185-186 /0,35 мм
63,5-65 твердое
177-179 /0,2 мм жидкость
106-108 твер дое
РВСН. 93-95 твердое
76-78
186-188 /0,15 мм жидкость.i-Ви
80,5-82 твердое
70,5-72
46-48
PhCH2
Амил
110-112
51-52,5
25 ме, Получают 1-(g -2-феноксиатил-К вЂ” про о пилкарбамил) -имидаэол, т.кип. 209 при
1,0 мм рт,ст, Хлорангидрид . Щ -2-феноксиэтил- К -проЬилкарбаминовой кислоты получают следующим образом.
47,2 г цропипамииа растворяют в 100мп абсолютного. спирта при охлаждении, и по порциям прибавляют к образовавшемуся раствору 40,2 г Р -бромфенетола. После
10 прибавления .этого вешества, реакционную смесь выдерживают при комнатной темпера-. туре в течение 7 суток при периодическом. перемешивании. После этого удаляют в ва-, кууме, на паровой бане избыток амина и
15 растворителя,а,бесцветный твердый продукт,. образующийся при охлаждении, обрабатыают избытком 5 н.водного раствора гидрата окиси натрия. При этом выделяется маслообразное соединение, которое акстрагируют диатиловым эфиром, акстракт промывают во дой и сушат над безводным сульфатом натрия. После удаления растворителя остаточ.ное маслообразное вещество перегоняют в
2CF - PflCH 4С .-РИ "Нг
Р tf ОСН СН.
Р} OCH СН
4С0-Р И ОСН СН
РИОСН СН гс1.--РИ.ОСН СН
РИ ОСН СН
26 вакууме, Получают Ц -2-фенуксиатил- К -пропиламин, т. кип. 90-92 С при 0,2 мм рт.ст.
Через 100 мл кипящего с обратным холодильником атилацетата непрерывно барботируют газообразный фосген, после чего по каплям при перемешивании прибавляют
22,4 r Ц -2-фейоксиэтил-,g -прониламина в 100 мл безводного этилацетата за 45мин.
Реакционную смесь кипятят с обратным холодильником при перемешивании и продолжении барботирования фосгена в течение 3 ч, Растворитель удаляют на паровой бане, а затем в вакууме. Получают хлорангидрид
И -2- реноксиэтил- Д - пропилкарбамино- вую кислому.
В табл. 4 приведены карбамилимидазоль ные соединения, описываемые обшей формулой f, где Х - кислород, полученные аналогичным способом. Твердые продукты перекристаллизовывали из растворителя, как петролейный эфир, для получения чистого продукта.
5858 10
40-41,5
Гексил жидкость
57-58,5 твердое
65,5-67
37-39
128»130
128,6
3,4-дихлор
РИ СН2 ю
° ° ° (Октил жидкость
Вц
1 14-1 16
2Ме-4 С -ЫфЖН твердое
РИ СИ2 жидкость
101-103
4Ие-Р) ОСН СН твердое
79,5.-8 1
64-65,5
189 /0,2 мм жидкость
РИ СН CH
Pg)CH СН
2 " 2
PN СН
73-75 твердое
121-123
2,4-диметил
84,5-86
3,4 дихлор
2 CE -РИ"
80,5-82,5
76-78
PH ОСН СН
Р ОСН СН
Нр он-2-инил
POOCH CH
2Ме-Р} ОСН 2СН 2
2CÐ-РИОСН 2СН 2
4Ме-РИОСН СН
3Сg PhOCH СН
4 СК-РААСН 2,4-дихлор
Р ОСН СН
РР 0 (СН )3
<Р И О (СН2) Р С (СН) Н 4Ct-ЯЮСН СН
2Ме-4С9PhOCH2 СН2
2Cg-Р) ОСН СН
Проложение табл, 4
186-188 /0,2 мм
198-199 /0,4 мм
193-194 /0,2 мм
215-220/0,1-0,2 мм
5858 10
Продолжение табл. 4
Физическое состояние
Заместнтепь в формуле I
Т," кип. С р2
4 СР-РпОСН СН
86-88
186-190 /0,4 мм
Р ОСН СН
4 Cg Р1юсн сн
2,4-дихлор жидкость
53-55 твер дое
Аллил
Я
Р СН 2
РИСН2
Р Q.ÑH
87-89
135-137
Ф
2,4, 5 грихлор
4 СР-РИ СН СН2
84-86
107
4 МеО-Р OCH СН
l> Пример 5, Смесь 6 8 г имидазола, 34 5 r И -2-(2,4,6-грихлорфенокси)-этил -пропилкарбаилхлорида и 10,1 г третичного амина нагревают на паровой бане при температуре 60 С. Смесь превращают в густую пасту и нагревают в течение 18ч, После охлаждения до комнатной температуры полученную смесь разбавляют 150 мл толуола и промывают порциями воды. Слой толуола отделяют и экстрагируют 2 н.соляной кислотой, экстракты объединяют и промывают толуолом. При нейтрализации llpo» дукта до рН 7,5 твердым бикарбонатом натрия образуется маслообразное вещество, которое экстрагируют толуолом. Раствор 4р толуола промывают водой и высушивают сульфатом магния. Толуол упаривают на роторном испарителе при температуре бани
60 С. Получают 1-(Ц -пропил- Я -2-(2,4, 6 грихлорфенокси) -этилкарбамил1 - имидазол,45 структура которого подтверждена ЯМР и
ИК-спектроскопически.
Формула изобретения sp
2 ссх хЪ.
ЦНИИПИ Заказ 4180/26
Тираж 553 Подписное
Филиал ППП Патент, г.-Ужгород, ул. Проектная, 4
Способ получения производных имидазола формулы g где Х - кислород или сера, н — замещенный алкил, алкенил, алкинил, циклоалкил, фенил, фенилалкил, фенилалкунил, феноксиалкил или фенилтиоалкил, Д - замешенный фенил, фенилалкил, фенипапкенип, феноксиалкил или фенилтиоалкил, при условии, что, когда A - метил или фенил, Я -заме4 шенный фенил или замещенный фенилалкил, фенилалкенил, феноксиалкил или фенилтиоалкил,отличающийся тем,что, соединение формулы R R N где В и ф2
% имеют указанные значения, подвергают взаимодействию с соединением формулы где одно из значений g и у — водород, а другое СХ, где галоген или Q -водо«роц а g «групп& формулы
Источники информации, принятые во внимание при экспертизе:
1, Патент США Мо 3679698, опублик.
25.07.72 кл. 260-309,