Способ количественного определения веществ, проявляющих кислотные свойства
Иллюстрации
Показать всеРеферат
ОП ИСАН И Е
ИЗОБРЕТЕНИЯ
V WOVCVOQV Ceega eabC sV
Союз Советских
Соцналнстнческнх
Республик
1»! 586384 (61) Дополнительное к авт. свид-ву (22) Заявлено 03.01.75 (21) 2091788/23-04 с присоединением заявки № (23) Приоритет (43) Опубликовано 30.12.77. Бюллетень № 48 (45) Дата опубликования описания 03.01.78 (51) M. Кл.-" 6 OIN 31, IG
Государственный комитет
Совета Мнннстров СССР (53) УДК 543.241.5 (088.8) по, делам изобретений н открытий (72) Авторы изобретения
У. Я. Микстайс и А. Я. Веверис (71) Заявитель Латвийский филиал Всесоюзного ордена Трудового Красного
Знамени научно-исследовательскот о института химических реактивов и особо чистых химических веществ «ИРЕА» (54) СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ВЕЩЕСТВ, ПРОЯВЛЯЮЩИХ КИСЛОТНЫЕ СВОЙСТВА
Изобретение относится к способу количественного определения веществ, проявляющих кислотные свойства.
К веществам, которые проявляют кислотные свойства, относятся как соединения, содержащие в молекуле кислотные группы, например карбоновые кислоты, сульфокислоты, так и соединения, не содержащие в молекуле кислотных групп, но взаимодействующие со щелочью, например соли сильных кислот с аминами, сложные эфиры.
Известны способы количественного определения веществ, проявляющих кислотные свойства, путем их прямого титрования стандартными растворами сильных оснований (1). Недостатком способов прямого титрования является ограниченность применения в отношении солей, аминокислот и сложных эфиров.
Известен способ количественного определения бензоильных групп в органических соединениях путем их отщепления со щелочью с последующим подкислением анализируемого раствора и титрованием метилатом натрия (2), Недостатком способа являет;я большая трудоемкость исполнения и продолжительность.
Известен способ количественного определения солей сильных кислот с аминами обратным титрованием (3). Согласно способу анализируемое вещество предварительно разлагают щелочью, избыток которого титруют кислотой. Однако способ не обеспечивает достаточной воспроизводимости результатов определения.
Известен также способ количественного определения сложных эфиров обратным титрованием (4). Согласно этому способу пробу анализируемого вещества обрабатывают щелочью. Избыток щелочи титруют стандартным раствором соляной кислоты. Также титруют раствор щелочи без навески образца («холостой» опыт) . Содержание анализируемого соединения находят по известной формуле, используя разность объемов титранта, 15 израсходованного в «холостом» опыте и при титровании анализируемого раствора, Недостатком известного способа является недостаточно высокая точность.
Цель изобретения — повышение точности в
20 обратном титровании веществ, проявляющих кислотные свойства.
Это достигается способом, который заключается в предварительном добавлении основания к раствору щелочи при молярном со25 отношении основания и щелочи 1: 2 — 4 и при разности показателей их констант диссоциации, равной 3 — 15.
При указанной разности показателей констант диссоциацин щелочь и основание диф30 ференцированно титруются кислотными тит586384
3 рантамп. При взаимодействии щелочи и образца анализируемого вещества часть щелочи расходуется, и изменяется молярное соотношение щелочи и основания в растворе.
Пропорционально изменяется соотношение объемов титранта, израсходованных па раздельное титрование основания и щелочи.
Предлагаемый способ исключает влияние ошибки измерения объемов раствора щелочи и возможные потери анализируемого раствора на точность результатов обратного титрования.
Предлагаемый способ заключается в следующем: приготавливают раствор щелочи и к нему добавляют основание при молярном соотношении щелочи и основания 1: 2 — 4 и при разности показателей их констант диссоциации в пределах 3 — 15. Отбирают 1 — 10 мл полученной смеси, прибавляют воду или органический растворитель до объема 25 мл и потенциометрически титруют стандартным раствором хлорной или хлористоводородной кислоты. По первому скачку на кривой титрования находят объем титранта, израсходованного на титрование щелочи (Voj), а по второму скачку определяют объем кислоты, израсходованной на титрование основания (,). По найденным объемам уточняют величину мол яр ного соотношения щелочи и основания
Vù . Затем навеску анализируемого вещест"о ва (0,02 — 0,5 r) обрабатывают 1 — 10 мл раствора щелочи и основания. Полученную смесь разбавляют водой или органическим растворителем и потенциометрически титруют стандартным раствором хлорной или хлористоводородной кислоты. На кривой титрования появляются два или три скачка потенциала. По кривой находят объемы титранта, которые израсходованы на титрование щелочи (V"" ) и основания (V; ). Для расчетов количественного содержания анализируемого соединения используют величину V»„ которую
У щ находят, используя формулу V»= (— . já ) 1 изб.
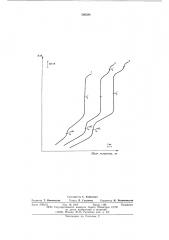
На чертеже представлены кривые потенциометрического титрования соединений, проявляющих кислотные свойства после их обработки щелочью, где 1 — сульфаминовая кислота (к щелочи предварительно добавлен дифенилгуанидин); 2 — бутиловый эфир оротовой кислоты (к щелочи предварительно добавлен анилин); 3-гидрохлорид 2 -дезоксицитидина (к щелочи предварительно добавлен бутиламин).
Пример 1. К 1 л 0,2 н. раствора КОН в изопропаноле прибавляют приблизительно
11,5 r дифенилгуанидина (ДФГ) и полностью растворяют (молярное соотношение
КОН и ДФГ составляет приблизительно
4: 1). Берут 2 мл полученного раствора, разбавляют изопропиловым спиртом до объема
25 мл и потенциометрически титруют 0,1005 н.
З0
G0
65 раствором хлористоводородной кислоты в изопропаноле. На кривой титрования появляются два скачка потенциала. По первому находят, что К,=10,2 мл, à Vp=2,48 мл. После уточнения молярное соотношение КОН и
ДФГ составляет — " =4,11. Навеску суль1 о фаминовой кислоты (0,0988 г) обрабатывают 6 мл раствора КОН и ДФГ. После полного растворения навески к раствору прибавляют 10 мл изопропанола и 15 мл воды, Разность показателей констант диссоциации
КОН и ДФГ в водно-изопропаноловой среде составляет 3,5. Полученную смесь потенциометрически титруют 0,1005 н. раствором HCI.
На кривой титрования (кривая 1) два скачка потенциала. Находят, что V< — — 2,37 мл, а
V; =3,02 мл. Рассчитывают величину V»=
= (4,11 3,02) — 2,37=9,95 мл.
По известной формуле вычисляют, что содержание сульфаминовой кислоты в образце — 98,3. Стандартное отклонение +0,4 /o.
Пример 2. Определение бутилового эфира оротовой кислоты.
К 1 л 0,3 н. раствора гидроокиси натрия в метилцеллозольве прибавляют приблизительно 9 г анилина и перемешивают. Молярное соотношение гидроокиси натрия и анилина составляют 3: 1, а разность показателей констант диссоциации приблизительно равно
12. Берут 3 мл раствора, разбавляют целлозольвом до объема 25 мл и потенциометрически титруют 0,1011 н. раствором хлорной кислоты в метилцеллозольве. По кривой титрования находят, что 7щ — — 9 94 мл, а
=2,95 мл. После уточнения соотношение гидVù роокиси натрия и анилина составляет
"о
=3,37. Навеску бутилового эфира оротовой кислоты (0,0865 r) обрабатывают 3 мл раствора щелочи и анилина. Нагревают раствор и перемешивают, затем прибавляют 22 мл целлозольва и полученную смесь потенциометрически титруют 0,1011 н. раствором хлорной кислоты, На кривой титрования (кривая 2) появляются три скачка потенциала. По первому скачку находят, что V =
=5 50 мл, а по третьему скачку определяют, что V, =2,83 мл. Расчитывают величину
Vx (3,37 2,83) — 5,50=4,03 мл.
По известной формуле вычисляют, что содержание бутилового эфира оротовой кислоты в образце составляет 101%. Стандартное отклонение +0,9%.
Пример 3. Определение гидрохлорида
2 -дезоксицитидина.
К 1 л 0,2 н. раствора гидроокиси тетраэтиламмония (ГТЭА) в изопропаноле прибавляют 7 r бутиламина. Молярное соотношение
ГТЭА и бутиламина приблизительно 2:1, а разность показателей констант диссоциации равна 7. Берут 4 мл раствора, разбавляют метилцеллозольвом до объема 25 мл и потенциометрически титруют 0,1005 н. хлористово586384 дородной кислотой в изопропаноле. По кривой титрования находят, что V — — 7,95 мл, а
1,=4,12 мл, После уточнения соотношение
ГТЭА и бутиламина составляет — = 1,93.
Vo
Навеску анализируемого вещества (0,1322 г) обрабатывают 5 мл раствора ГТЭА и бутиламина. После растворения навески добавляют 20 мл метилцеллозольва и полученную смесь потенциометрически титруют 0,1005 н. раствором НС1. На кривой титрования (кривая 3) появляются три скачка потенциала.
По первому находят, что V" =5,53 мл, а по второму определяют что V; =5,20 мл. Рассчитывают величину V,= (1,93.5,2) — 5,53=
=4,50 мл. Содержание НС1 в гидрохлориде
2 -дезоксицитидина составляет 12,5 /о. Стандартное отклонение 0,5 /o.
Формула изобретения
Способ количественного определения веществ, проявляющих кислотные свойства, путем добавления к раствору пробы анализируемого вещества избытка раствора щелочи с последующим потенциометрическим титрованием полученной смеси кислотой, о т л ич а ю шийся тем, что, с целью повышения точности анализа, к раствору щелочи предварительно добавляют основание при молярном соотношении его и щелочи 1: 2 — 4 и при разности показателей их констант диссоциации, равной 3 — 15.
Источники информации, принятые во внимание при экспертизе
1. Денеш И. Титрование в неводных средах. М., «Химия> 1971, с. 273 — 286.
2. М. P.-T. Эшворт. Титрометрические методы анализа органических соединений. М., «Химия», 1968, с. 92.
3. Крешков А. П., Яровенко А. Н., Невская В. Н. Титрование некоторых солей аминов по методу вытеснения с применением
20 гидроокиси тетраэтиламмония. Заводская лаборатория, 1966, т. 31, с. 274 †2.
4. Черонис Н. Д., Ма T. С. Микро- и полумикрометоды органического функционального анализа. M., «Химия», 1973, с. 475 — 477.
586384
F,ïÂ
Ойьеп титранта, кл
Составитель С. Хованская
Техред Л. Гладкова Корректор И. Позняковская
Редактор Т. Никольская
Подписное
Типография, пр. Сапунова, 2
Заказ 2785/12 Изд. № 1018 Тираж 1109
НПО Государственного комитета Совета Министров СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5