Способ получения производных бутирофенона или их солей
Иллюстрации
Показать всеРеферат
;:„. „„;„"„"„"„О Л И С А H И Е
ИЗОБРЕТЕН ИЯ (> >) 59 2З-50 (61) Дополнительный к патенту (22) Заявлено 13. 12.74 (21)1896462/
/2083 83 8/" 3-04 (23) Приоритет 16.03.7З(32) 07.06.72 (51) М. Кл.и
С 07 С 49/76
С 07 D 211/00
Гасударственный квмитет
6вввтв Ии»»стрвв Юр к двии извбрвтвиий и вткрытий (3l) 57249/72 (33) Япония (43) Опубликовано05.02.78,Бюллетень %5 (53) У,П,К 547.823 (088,8) (45) Дата опубликования описания 25.01.78
Иностранцы
Кикуэ Сасадзима, Масару Накао, Исаму Маруяма, Кейити Эно, Ситенари Катаяма, Масахару Такаяма, Юнки Кацубе, Сигехо Инаба и Хисао Ямамото (Япония)
И н ос транная фирма Сумитомо Кемикал Компани, Лимитед" (Я ония) (72) Авторы изобретении (Тт) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
БУТИРОФЕНОНА ИЛИ ИХ СОЛЕЙ
Изобретение относится к способу получения новых произвэднь;х бутирофенона, котэ-рые м,эгут найти применение в качестве леха рс тве и ных ве шес тв
Известен способ получения 4-фтэр-4-(4-бензилпнпериднно)-бутирсфенона взаим с» деиствие.л (-хлор-4-фторбутирсфенона с бензин..ип;:рицинэм в прису гствии триэтилч. лщ и ноцистого калия в ксилопе при кипяча пни. 10
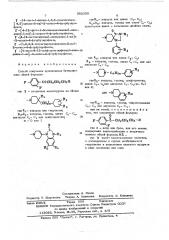
Основанный на известной реакции, предлагаемый способ получения производных бутиэфенона обшей формулы где Ь- вторичная аминэгруппа из числа: где К - водород или гидроксил;
Й иЗ.,- водэрод. галэид, алкил С вЂ”. Си, Ф
2 алкокснл С - . или трифторметил, тъ — 0 или 1, где Й»- водород, или алкил С, — C<,. у в- водород, галоид или алкил С - С
1 пунктирная линия — Ьэзможная двойная связь, . гдеК„- водород или алкил Ст- С 3
К вЂ” водород, гапэид, алкил С,— С или алкоксил С»- С, 592350
4
/" \ g
В Примерами производных дпфторбутирофе-_#_ — „Н2п
/ нона являются -(4-фенилпиперилин-1ил)--2,4-пифторгпе К - водород, галанд, трифтэрметнл, бутирофенон, алкил С, — С яли алкэксил С1- С 5 g-(4-окси-4-фениппиперидин-1-ил)-2,4
-дифторбутирофенон, gРУ—
g - f4- (4-хл орфе нил )-4-окс ип иперидин -1-ил)-2, 4-лифт орбутирофе нон, 2s - (4-окси-4- (3-т рпфт орм е тилфенил )-пиl не ридин-1-ил)-2, 4-лиф торбу т ирофе ион, где Й - водород, галэид, гидэоксилалкил g- f4-окс и-4- (4-ме т илфе пил ) -пипериС„- Сч и а ксил Ñ1- С1 д ин-1-ил1-2,4-диф торбути рсфе ион, или их солей заключается в том, что
g- (4-окси-4- (4-ме то кс ифе пил )-и ипе Рисоединение обшей формулы дин-1-ил)-2,4-дифтортирофенон, О
$ - )4-(4-хлор-3-трифторметилфенил)-4у (, Н бн = .
-оксипиперидин-1-m)-2, 4-дифторбутирофенон, Н 2 $- (4-бензил-4-оксип нпериди н-1-ил )Р -2,4-дифторбутирофенон, где Х - хлор или бром, или его кеталь Д -14-(4-хлорбензил)-4-оксипиперидинпэдвергают взаимодействию с вторичным 20 -1-ил -2,4-дифторбутирофенон, амином общей формулы Н.Ь, - (4-(2-оксо- 1-бензимидаз опинил ) -пине где g имеет вышеуказанные значений, ридин-1-ил ф,4-дифторбутирофенон, споследующимвслучаенеобходимостигидро У В-(2 оксо 1- бензимидазолинил) лизом и выделением целевого продукта в ви- -1 2.3,6-тетрат идропиридин-1-ил3-2 4ди де основания или соли, gg "фторбутирофенон, .
/-4-оксо-1-фенил-1,3,8-триазаспироИсхэдные дифторбутирофеноны можно пэ -(4,53-декан-B-ил-2т4-дифторбутирофенон, лучать взаимэдейсгвием м-дифторбензэла с О (4-Фенилпиперази| -1-ил)-2 4-д"Фтор галоидангидридом -галоидмаслянрй кис- бУтирофенон» лоты.
30, +-(2-метоксифенил)-пиперазин-1I влетали этих соединений можно получать, -ил -2,4-дифторбутирофенон, например, обработкой последних этиленгли- f -(1, 2, 3, 4-тетрагидроизохи поли н-1колем или этилендитиогликолем в присутст- -Ha)-2>4-дифторбутирофенон, вии катализатора дегидратации, так ого, как
g- 4-(2-метилфенил)-пиперазин -1-АР п-толуолсульфокислота или концентрирован- -2 + д Ф РбУ Р ф 4 ная серная кислота, в среде инертного pacr- 6 4 (4 "фтоРфенил) пиперазив 1-иЯ ворителя, например бензапа, ксилола, толуо 2 4-д"фтор Утирофенэн, ла, при нагревании.
Получение исходных соединений. !
Для перевода кеталя в целевые продукты g смеси хлористого алюминия (340 г) проводят гидрэлнз в присутствии минераль- и сероуглерода (1 л) добавляют 114 г ной кислоты, такой, как соляная, серная или м-дифтэрбензэл
rop ензэла прн эхлахтдении. Затем по фосфорная, или органической кислоты, такой, каплям добавл ю а ляют раствор хлорангидрнде, как щавелевая, винная, при комнатной темпе- у -хлормасляной к кислоты (142,5 r) в ратуре. Этот перевод можно осуществлять
45 мл при температуре также с помощью ионообменных смол. нике 15 С.. Получе н олученную смесь постепеннэ
Взаимодействие дифторбутирэфенонэв нагревают до кипячени кипячения, а затем нагревают со вторичным амином проводят в среде п ри не прерыв н эм к нпяче ни и с обра тным инертного растворителя, например диметил- холодильником в 2 . П в течение ч. После эхлаж. фэрмамида, бензэла, тэлуэла, кснлола эта- дения реакционную сме
50 смесь выливают в воду нала, пропанэла, бутанэла,ацетона, бутана- (3 л) и экстрагируют трагируют хлористым метиленом, на-2, 4-метилпентанона-2, в присутствии Экстракт промывают послед ледэвательнэ водой, ак це и т ар а к исл or ы — не орган ическ or о или разбавленным водным ра тво рас тв ор ом гид р о экиорганического основания . си натрия и насыщенным э
ым водным раствором
Для ускорения реакции вводят небольшое; > хлористого натрия, сушат над безводным количество.катализатора, например йодисто- сульфатом натрия и конц ., П к нцентрируют., 1ерего калия ° гонкои в вакууме ocrama получают f -хлэрПолученное производнэе дифт орбутирэфенэ- »2,4-дифторбутирэфенона, r.кип. 97 111 С/ на можно легко превращать в аддитивные /1 0-1 5 мм тт 1 507, Э t ф I" соли с органическими или неорганическими <э При кипячении сме и кислотами известными способами. Бутирэфенона (1О2,3 r), этчленгликэля
592350
II - Г 4-(4.-хлорфенил) -4-оксииииеридин-1-ил )
-2-амино-4-фтэрбутирэфен Dí, T. пл, 145-147 С, хлэргидрат имеет r, ил. 236 "С (разл.) . (58, 1 и), гидрата и-топуолсульфокислоты (3,2 г) и бензола (500 r) с обратным холодильником в течейие 30 ч удаляют вэl1) в виде азеотроиа, охлаждают r÷eñb, промывают ее водой и сушат над безводным сульфатом натрия. Бензэльный слэй концентрируют.
Г!ерегонкой получают 4-хлор-l-(2,4-дифторфенил)-1,1- этилендиоксибутан, т.кип.
109-120оС/1,3-1,5 мм. и 21 1
Г!римерl.
Смесь -хлор-2,4-дифторбутирофе н она (14,2 г), 4-(4-хлорфенил)-4-оксипиперидина (13,8 г), безводного карбоната калия (9,0 г), йодистого калия (0,5 г) и диметил-1 формамида (170 мл) нагревают в течение о
20 ч при 90-110 С. После охлаждения реакционную смесь разбавляют водой и экстрагируют эфиром. Эфирный экстракт промывают водой, сушат над безводным сульфатом натрия, обрабатывают хлористым водородэм, а затем концентрируют, После растирания и перекристаллизации остатка из метанола получают хлоргидрат 3- Г4-(4-хлоэфенил)-4-оксипиперидин-l-ил1-2,4-дифторбутирофе-2 нона, т.пл. 245оС (разл).
Приме р2, Смесь 4-хлор-l-(2,4-дифторфенил)-1,1этилендиоксибутана (5,3 г), 4-оксо-1-фенил-l,3,8-триазаспиро-(4,5 -декана (4,6 r), ЗО безводного карбоната калия (0,1 г) и диметилфэрмамида (58 мл) нагревают при кипячении с обратным холодильником в течеwe 2,5 ч. После охлаждения реакционную смесь выливают в хэлодную воду (400 мл) при тщательном перемешивании, собирают осадок и промывают его водой. Получают
4-(4-оксо-1-фе нил-1,3,8-триазаспиро-, -j4,5)-декан-8-ил) 1-(2,4-дифторфенил)1,1-атилендиоксибутан. т. пл. 58-62 С. о
Пример 3.
Смесь 4-(4-эксэ-l-фенил-1,3,8- три азаспиро- (4,5)-декан-Я-ил)-1 (2,4-дифторфенил)-1, l-атилендиоксибутана (2,0 r), 4 метанола (29 мл), 35 -ной соляной кислоты (4,7 мл) и воды (10 мл) нагревают при кипячении с обратным холодильником в течение 30 мин. После охлаждения реакционную смесь разбавляют водой, подщелачивают 5о насьиценным водным раствором карбоната натрия и акстрагируют хлэрэфэрмэм. Экстракт прэмывают водой, сушат над безводным сульфатом натрия и концентрируют под вакуумом. Остаток перекристаллизэвывают из 55 этанэла и получают -(4-оксо-l-фенил-l, 3,8-триазаспиро- f4,F)-декан-8-ил)-2,4-дифторбутирэфенэн, r. пл. ) 90-204 С.
Приме р4.
По методике примеров 1-3 получают следующие соединения-.
4 . (4 окси .4-(3-триф т эрме тилфепил) -иипериди н-1-нл)-1-(2,4-лиф тэрфенил) — 1 ° 1° этилендиэксибутан, jf -I4-экси-4-(3-трнфторметилфенип)-ииперидин-1-ил -2,4-лифторбутирсфеион, т. пл. 90-93 С, хлэргидрат имеет т. пл.
235 238 Г„
4- (4-(и- хлэрфеиил)-4-ок<:иииперндии1-ил) -1-(2,4-диф гэрфе пил) -1, 1-атиле иди эксибутан, 4- 4 (2-оксо-1-бензимидазолинил)-пинеридин-1-an) -1-(2,4-дифторфенил)-1, 1-crane«диэксибутан, - (4-(2-оксс -1-бензимидазолинил)-пиперндин-l-ил)-2,4-дифтэрбутирэфенэн, хлор гидрат имеет т. пл. 160-165оС, 4-(4-фенилпиперазилнн-l-ил)-1-(2,4дифтэрфенил) -1, 1-атиленди эксибутан, -(4-фе нилпипе разин-1-ил) -2,4-диф торбутирофенон, дихлоргидрат имеет т. пл.
219-225 С (разл.).
4-(1,2,3,4-:тетрагидроизохинолин-2-ип)1-(2,4-дифторфенил) -1, 1-атиленди эксибу тан, — (1,2,3,4-re трагидрэизэхин олин-2-ил)2,4-дифторбутирэфенон, хлэргидрат имеет т. пл. 205-208 С, 4- (4-(4-хлэр-3-триф тэрме тилфе нил) -4оксипиперидин-1-илj-1-(2,4-дифторфенил)1, 1-атиле иди эксибу тан, -4-(4-хлор-3-трифтэрметилфенил)-4оксипнперидин-l-ил-2,4-дифторбутирсфен он, хлэргидрат имеет т. пл. 226эС (разл).
Приме р 5.
Смесь I% (-4-окси-4-(3-трифторметилфенил)-пиперидиц-1-ил) -2-бензиламино-4фторбутирэфенона (3,8 г), 10%-ного палпадия на угле (1,0 r) и 35%ной соляной кислоты (2,0 г) в этаноле (45 мл) тщательно перемешивают в среде водорода при о
25 С до израсходования аквимолярного количества водорода. Катализатор отфильтровывают и фильтрат концентрируют в вакууме с получением хлоргидрата g -(4-окси-4-(3-т риф т эрме типфенил )-п ипе ридин- 1-ил -2-а ми» но-4-фторбутирофенэна, т. пл. 230-235 С (разп). Хлэргидрат взбалтывают со смесью водного аммиака и эфира. Эфирный слой промывают водой, сушат над безводным сульфатом натрия и концентрируют в вакууме с получением свободного основания, которое перекристаллизэвывают из вэднэго атанола, т. пл.
1 05-107 о(Пример 6.
Пэ методике примера 5 получают следующие соединения:
5923
-(4-окс о-1-фе нил- J,3,8-трна заспи р о 1 4,51-декан-8-ил) -2-амино-4-фторбутиро- фенон, — (4-(2- (pc o -1-бензимндазолинил) -пиперидин-1-ил) -2-амин о-4-ф торбу тир офен он, Г "(4-(2-метоксифенил)-пиперазин-1-ил),.
- 2-амин ь4-ф т орбу тир офе н он, -(1,2,3,4-тетрагидроизохинолин«2-ил)2-.аминь-4-фторбутирофенон, -14»окси-4-(3-трнфторме тилфенил)-пипе-10 ридин-1-ил) -4-ам ин о-2-ф т орбу тир сфе н он.
8 где%ай,- водород или алкил С<- ??, r>a%<- ??????????????, ???????????? ?????? ?????????? ??„- ?? ?? lp ?? ???????????????????? ?????????? - ?????????????????? ?????????????? ??????????, ?????? r>- водород или алкил C - С
ЦЭ
Формула изобрете
R - водород; галоид алк н и я алкоксил С вЂ” С ид, алкил С„-С,, или ал
1 и
Способ получения производных бутирофе- Яа нона обшей формулы m+2щ
Х / у О я ф ц я2я гдейц- водород, галоид, трифторметил, / алкил С -, С, нли алкоксил С„С; п 0,1 .у или 2> э п где Š— вторичная аминогруппа из чйсла; где щ — водород, галоид, гидр оксилалкил
С - С или алкокснл С С е, или их солей, о т л и ч. а ю ш и и с я тем, что соединение обшей формулы
О где Я - всВород или гидроксил;
Q, ик - водород, галоид, алкил С - С, алкоксил С1- С или трифторметил, N и - О или 1
О
Ц
С, — _#_-R
F где Х -.хлор или бром, или его кеталь
35 ер™м взаимодействию с вторичным амином обшей формулы Qg, тле Ь имеет вышеуказанные значении, . с последуюшим в случае необходимости гидролизом и выделением целевого продукта и виде основания или соли.
Составитель А. Орлов
Редактор Т. Шарганова Техред A. Алатыпев. Корректор й. Ковалева
Заказ 230/2 Тираж 559 Подписн ое
БНИИПИ Государственного комитета Сове та Министров СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент > г. Ужгород, ул. Проектная, 4