Производные 8-аза-16-оксагонана, обладающие противоспалительным действием и способ их получения
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистических
Республик
636236 (61) Дополнительное к авт. свил-ву (22) Заявлено 25.05.76 (2) ) 2364022/23-04 с присоединением заявки М (23) Приоритет (43) Опубликовано 05.12.78 юллетень ¹ 45 (45) Дата опубликования описания 15," 2, 78
2 (51) М. Кл.
С 07 3 73/00
Гасударственном намнтет
Совета Мнннстров СССР по делан нзааретеннй н аткрытнй (53) УДК 547.689.,6 (ОЬ8.8) А. А. Ахрем, Ф. А. Лахвич, B. H. Пшеничный. Л. Г. Лис, Б. Б. Кузьмицкий и Н, A. Мпзуло (72) Авторы изобретения
Институт биоорганической химии АН Белорусской CCP и Минский ордена Трудового Красного Знамени государственный медицинский институт (71) Заявители (54) ПРОИЗВОДНЫЕ 8-АЗА-16-ОКСАГОНАНА, ОБЛАДАЮ
ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕ,CÒ6ÈEÌI > -
И СПОСОБ ИХ ПОЛУцЕНИА
Ri г КС
Я Н
Ит
О сн
Снз
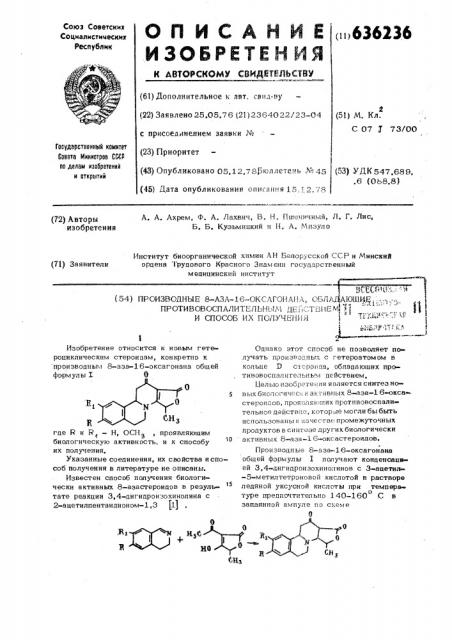
Изобретение относится к новым гетероциклическим cTBpoHQBM, конкретно к производным 8-аза-16-оксагонана общей формулы T О где R и R< — Н, ОСН, проявляющим биологическую активность, и к способу их получения.
Указанные соединения, их свойства испособ получения в литературе не описаны.
Известен способ получения биологически активных 8-азастероидов в результате реакции 3,4-дигидроизохинолина с
2-ацетилпентандионом-1,3 (1) Однако этот способ не позволяет по» лучать производных с гетероатомом в кольце D сч ероида, обладающих противовоспалительным действием, Белью изобр текил является синтез ноBEAK био. i .i Hkpc! и ак "HB! Ibtx 8- за-1 б êñ стBpoi! EQB, lipoR::. як щих протнBoBocBBJlH» тельное действие, которые могли бы быть использованы в начес тве промежуточных продуктов в синтезе других биологически активных 8 — аза-l 6-оксастероидов, Производные 8-аза-16-оксагонана общей формулы I получают конденсаци» ей 3,4-дигидроизохинолинов с 3-ацетил-5-метилтетроновой кислотой в растворе ледяной уксусной кислоты при темпера туре предпочтительно 140-160 С в о запаянной ампуле по схеме
636236 гдей-К -Н, илн К-ОСНОВ
Р. - Н, или Р - Р— OCH> . При темо пературе 120 С конденсация протекает медленнее, что приводит к осмолению реакционной смеси и снижению выходов.
Реакция проходит также в растворе ледяйой уксусной кислоты при температурах
80-118 С . Однако при этих условиях конденсация протекает в течение нескольких суток с сильным осмолением реак- <й ционной смеси и с более низкими выходами продуктов реакции, Такая реакция не протекает при использовании воды, спирта и других органических растворителей (бензол, тетрагидрофуран, диметилсульфоксид, диметилформамид), а также при сплавлении исходных веществ.
Строение 8-аеа-16-оксастероидов 26 доказано на основании данных ИК-, УФ-, ПМР-, масс-спектров и элементного анализа, Так, электронные спектры указанных соединений обнаруживают gaa максимума поглощения при 235-239 и 33
292-295 нм, характерных для соединений, содержащих енаминодикарбонильный фрагмент.
В соответствии с предложенной струк
:турой, в спектрах ПМР обсуждаемых со- 30, единений наблюдаются резонансные сигналыи всех фрагм ентов м опекул ы в о жида емых областях. В частности, сигнал С > метинового протона наблюдается црио.
5,60-5,63 м,g, в вице квартета с кон- 33 стантой спин-спинового взаимодействия
У = 7 Гц, В свою очередь сигнал С.
1 фа) метнльной труппы наблюдается в виде дублета в области д 1,78-1,80 м,д. с той же константой. Сигнал бензильного 46 протона при С< > находится в области
d 5,34-5,36 м.д..и наблюдается в виде квартета равной интенсивности с константами спин-спинового взаим одействия
Х =4 Гц и 7 10-14 Гц, что, в 43 соответствии с литературными данными для бензохинолизиновых структур, указывает на аксиальную ориентацию этого протона.
56
В ИК-спектрах всех соединений наблюдаются полосы в области 1750-1765 см, соответствующие поглощению карб онильной группы Д,, Р -непредельного у -лактона, и полосы в области 1610-1620 и
1650-1660 см, соответствующие. поглощению двойной связи и карбонильной группы енаминокетонной группировки.
Молекулярные ионы в масс=спектрах и данные элементного анализа соответствуют предложенным структурам.
Г! р и м е р 1. 15-Метил-8-аза-16-оксагонан-1,3,5(10),13-тетраен-12,17-дион (3. ).
Смесь 1,31 r (10 моль) 3,4-дигидро. изохинолина, 1,56 г (10 моль) 3-ацетил-5-метилтетроновой кислоты и 10 мл ледяной уксусной кислоты нагревают в запаянной ампуле при 140-160 С в течение 3 ч. Остаток после удаления растворителя на роторном испарителе обрабатывают смесью 25 мл этилового спирта и
10 мл эфира, Выпавшие кристаллы отфильтровывают и кристаллизуют из смеси ук.сусной кислоты и эфира. Упариванием маточных растворов и хроматографией на колонке с кремниевой кислотой выделяют дополнительное количество вещества.
Всего получают 1,35 (50,1%) 15-метил-8-аза-lб-оксагонан-1,3,5(10), 13тетраен-12,17-диона, т.пл. 282-286 С (c разл.), Найдено, %: С 71,21; Н 5,59) М 5,17;
С 6Н16 И 3
Вычислено %; С 7 1 36 Н 5,6 1
И 5,20.
ИК-спектр, 0, см: 1 3 50, 1 500, -1
1580, 1620, 1650, 1758 (KBI ). .СН ОН
УФ-спектр, А з,нм: 239 (E 148001.
WQKC
295 (Е 14200). Спектр ПМР (в СГ СООН), Д ., м.д.: 1.78 (15-СНз, дублет, -7 Гц, 3 Н), 5,34 (9-Н, квартет, J =4 и 10 Гц, 1 Н); 5,60 (15-Н, квартет, Г:7 Гц, 1 Н), 7,24 (ароматич., 4 Н). Масс-спектр М 269, Пример 2. 3-Метокси-15-метил-8-аза-16-оксагонан-1,3,5(10),13-тетраен-12,17-дион (6 ) °
Смесь 0,58 г(3,6 моля) 6-метокси-3,4-дигидроизохинолина, 0,56 г (3,6 моля) З»ацетил-5-метилтетроновой кислоты и 3 мл ледяной уксусной кислоты нагревают в запаянной ампуле при 140о
160 С в течение 3 ч. Остаток после удаления уксусной кислоты на роторном испарителе хроматографируют на колонке с кремниевой кислотой, Получают 0,15 г (13,9%) 3-метокси-15-метил-8-аза-1 6-оксагонан-l,3, 5 (10), 1 3-тетраен-12,17-диона, т,пл, 266-270 С.
Найдено, %: С 68,74; Н 5,86;Я4,42;
С:„Н„ИО .
Вычислено> %; С 68,21; Н 5,73;
М 4,68, ИК-спектр; Q,ñì; 1360, 1500.
636236
Составитель В. Сладков
Редактор B. Минасбекова Техред Л. Алферова Корректор В. Серцюк
Заказ 6877/19 Тираж 517 Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР
lIo l1BIIBM изобретений H oTKpbITII
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП Патент, r. Ужгород. ут. Про кsная, 4
1580, 1610. 1650, 1745 (КВ1 ).
УФ-спектр, ) 3, нм: 235 (L 14200), 292 (Е 9500). Спектр ПМР (в CF СООИ)
Д", м.д.: 1,80 (15-СН, дублет, 7 Гц, 3 Н); 4,04 (З-ОСНЗ, синглет, 3Н); 5,36 (9-Н, квартет, 7 =4 и
14 Гц, 1 Н); 5,60 (15-Н, квартет, Х 7 Гц, 1 H),,7,,19 (ароматич., 3 H). Массспектр N+ 299.
1О
Пример 3, 2,3-Лиметокси-15-метил»8-аза-1 6-окса гона н-1,3,5 (10 ), 1 3=
-тетра ен-1 2, 1 7-дион (g ) .
Смесь 0,93 г (4,86 моля) 6,7-диметокси-3,4-дигицроизохинолина, 0,76 I
15 (4,87 молл) 3-ацетил-5-м етилтетроновой кислоты и 5 мл ледяной уксусной кислоты нагревают в запаянной ампуле при о
140-160 С в течение 3 ч. Остаток после удаления на роторном испарнтеле
М уксусной кислоты обрабатывают смесью
15 мл атилового спирта и 10 мл зфира.
Выпавшие кристаллы отфильтровывают, хроматографируют на колонке с кремние вой кислотой и получают 0,20 г вещества.
25 париванием маточных растворов и хроматографией на колонке с кремниевой
КИСЛОТОЙ ВЫДЕЛЯЮТ ЦОПОЛНИТЕЛЬНОЕ КОЛИ чество вещества. Всего получают 0,24 г
ЗР (15% ) 2,3-дим етокси-1 5-м етил-8-а за-16-оксагонан-1,3,5(10), 13-тетраен-12,17-диона, т.пл. 266-269 C.
Найдено,%: С 65,85; Н 5,70; f44,06;
С,.е Н„, ИО .
Вычислено, %: С 65,64; Н 5,82; . Й 4,25.
ИК-спектр, Д,см: 1350, 1500, 1525, 1600, 1620, 1660, 1765 (КВ ), УФ-спектр, д з ", нм: 237 (Я23000), :о
292 (.Е 18400). Спектр ПМР (в C>FC
Ю, м.д,: 1,80 {15-СНз, дублет, У.=7 Гц, 3 Н), 3,95 (2,3-(ОСНз ), синглет, 6 Н), 5,34 (9-Н, квартет, У =4 и 14 Гц, 1 Н), 5,63 (15-Н, квартет, У =7 Гц, 1 Н), 6,87 (ароматич., 2 Н), Масо-спектр М+ =329.
Биологические испытания соецинений общей формулы Х показали, что они вызывают в дозе 100 мг/кг статистически достоверное,- еньшение воспалительного отека лапок б-;-лых мышей по сравнению с коитрольньг. и животными, выраженное в процентах ". исходному объему.
Форму Ia и зоб ретения
1, Производные 8-а за-lб-оксагонана, обладающие противовоспалительным действием, общей формулы Х
0 где Й и К вЂ” Н, OCH
2, Спосо" получения соединений по и, 1, отлича ющийся тем, что 3,4-дигндронзохинолнны общей формулы где R - Я вЂ” Н, ОСН, конденсируют с 3-ацетил-5-метилтетроновой кислотой в растворе ледяной уксусной кислоты при температуре 80-118 С или в запа-. ° янной ампуле прн 120-160 С с посльдующим выделением целевого процукта.
Источники информации, принятые во внимание прп =-ê ñïåpòHçå:
1. Ахрем A. A., Монсеенков А, М., Криворучко В. А., Лахвич Ф. А, Сабура ва Л. A., Поселенова А. И. Подход к синтезу гетероцнклнческих аналогов стероидов ряда 8-азазсTpaI-IH, "Изв. AH СССР, сер. хим., 1969, с. 2338.