Фунгицидный состав
Иллюстрации
Показать всеРеферат
Втб;-.!. ко-т;=;. нячаа о и и скчт-ио
ИЗОБРЕТЕ Н ИЯ
Союз Советских
>6394|5
Социалистических
Республик
8 flATEНТУ (61) Дополнительный к патенту— (22) Заявлено 06.06.75 (21) 1993464 214175
/05
М.Кл."- А 01 N 9 22
С 07 D 241/48 (23) Приоритет 07.02.74 (32) 15.10.73 (31) P 2351707.9 (33) ФРГ (43) Опубликовано 25.12.78 Бюллетень ¹ 4 (45) Дата опубликования описания 16.04.79
Государственный комитет по делам изобретений и открытий
УДК 632.952 (088.8) (72) Авторы изобретения Иностранцы
Вальтер Ост, Клаус Томас, Экгард Амадори и Рольф Дарскус (ФРГ) (71) Заявитель
Иностранная фирма
«Целамерк ГмбХ унд Ко., КГ» (ФРГ) (54) ФУНГИЦИДНЪ|Й СОСТАВ
Изобретение относится к химическим средствам защиты растений, а именно к фунгицидным составам на основе N,N -бис((1-формамидо-2,2,2-трихлор) этил)пиперазина. 5
Известен фунгицидный состав на основе N,N -бис-((формамидо-2,2,2 — трихлор) этил) пиперазина (трифорин) (1), Однако он обладает недостаточной фунгицидной активностью при низких концентрациях.
Также получен указанный трифорин в виде смеси мезотрифорина и левовращающего трифорина i(2) Целью изобретения является повышение фунгицидной активности.
Предлагаемый фунгицидный состав в качестве действующего вещества содержит 2О
N,N -бис-,((1 - формамидо - 2,2,2-трихлор) этил) пиперазин в виде левовращающего изомера в количестве 0,001 — 85 вес. %, остальное — добавки, выбранные из группы эмульгатор, носитель, наполнитель.
Молекула трифорина включает два ассиметрических атома углерода с одинаковыми радикалами каждый, так что в результате синтеза действующего вещества получают 50% D,L-трифорина (мезо-форма) и 50,/о рацемического трифорина (25% L,L-трифорина и 25% D,D-трифорипа).
Разделение рацемата трифорина на два оптически активных компонента известными методами невозможно. Например, основность действующего вещества так незначительна, что исключается возможность получения стабильных солей из оптически активных кислот. Незначительная растворимость трифорина уменьшает возможность фракционированной кристаллизации действующего вещества с помощью оптически активных растворителей.
639415 н
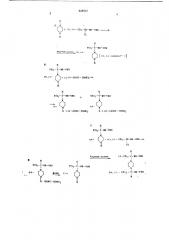
А. х (+ (+1, Н вЂ” СС1 — СН-НН-СНО
I с1
Н н !
СС1,— С-НИ-СНО
5. н
I (qi, — с- нн- сно
I к (Н, Н -+ 2(,(Ч (НООС СНОН)г ю.I
Н н
СС1 — С-кн-Сыо
I н
„() — () Н .1 (+1— - (НОOС вЂ” СНОН1, I г. к
СС1 — С-НН вЂ” СНО ь
I к
+ (+1. (-1 — СС1,— СН-3Н СНО н н
С1
1 (-1- СС1 — С- ВН вЂ” СНО
Р и((елтор нисмты
Н
СС1 — С-ян-Сно
1 н
СС1 — С вЂ” НН -СНО н (-1- () 1 C-1%&Он к
Н (НООС- СНОН ), АОЦЕПтОР киолоть (+>, 1 — 1— и
СС1,— С вЂ” ЯН вЂ” СНО
+ н
Н (Н(-(НООС- СНОН)
14 ! (+1, (-1 — СС1 - С вЂ” нн — сно
И д Р
I . — ) — С 613 — . — лн — Сно
N !!"ранциониробанная знсгпрация/ франциониробанная !!pucmannusa was и ! (+I — 1- Са — С вЂ” NH — С11О !
И Я
Са,— а- IIÏ- СИО С стз
I 1
1Г у (+) (-! !
И1з — С - 1!Н- <Но
Пипераз:и! сначала только у одного атома азота подвергают взаимодействию с (+), (— ) -1,2,2,2-тетрахлорэтилформами,Iо. ., получая (+), (— ) -Х-(1-формамидо2,2,2-трихлорэтил) пиперазин, который в дальнейшем обозначен как «монотрифорин». Зто соединение имеет только один асимметрический центр и из-за незамещенной вторичной ампногруппы пиперазина обладает еще достаточной основностью для получения дпастереомерных солей с оптически активными вспомогательными кислотами. В принципе для получения диастереомерных солей монотрифорина;toil
Если смесь диастереомерных гидрогентартратов растворяют в воде, то (— )-монотрифорин-гидрогентартрат выкристаллизовывается в качестве пентагидрата. Выход при этом составляет 90%, оптическая чистота 98% . Перекристаллизацией из воды ...ожно повышать оптическую чистоту до свыше 99,5%.
Водный фильтрат содержит очень легко растворимый в воде (+)-монотрифорингидрогентартрат. После отгонкп воды обработкой с помощью 96%-ного этанола получают (+ ) -монотрифорин-гидрогентартрат как кристаллический сольват эталона, причем выход составляет свыше 80%, оптическая чистота свыше 99%.
Газб!с,7снпые диастереомерные монотри,. =;..Нн--.!!7".рогснтартраты обпаботкой щело и ю в водном растворе можно превра::!Оть в оптически чистые основания с удельи; -; вращением — 63,0 или +62,6 . Здесь та:;жс не требуется специальная очистка.
Затем o!7т1!чески чистьш (— ) -монотри ",Ор::н еще раз подвергают взаимодействию с, —,:, (—, -1,2.2,2-тетрахлорэтилформамис !- - - - 2 2 210:, i!.: Ним образол получают смесь из
50о 1сзо--рифорина и 50оо (— ) (— )т р1; lUoo t! It а (соответственно из (+ ) -мОнОтрифорш!а образуются 50% мезо-трифорин:- —;, ) (-: 1 —,-,фон!!и)
15 р
Раз.".еление этих смесей на соотвстстр !ОШIIс !!Зоitc )û Ос! щсствл ют фраки!Iониров. . !ной кристаллизацией и 71! фракцпо !ир; ".,анной экстракцией. При этом используется наблюдающаяся во многих раство20 1;. ;! —, . э с р, . лях в .— О раз Оольп1ая растворимость ,-с"; - нл1! правовращающегося трифорин".
-:о сравнению с мезо-трифоричо:!. 1(ак растt!o!7!Iт;,!!! ocooc?IHQ Выдсл !1отся ъ|стяно, !.
;; .е-.он с добавкой воды до 20,о, тетрагн:.рофгрñ-.! t,;,ис -онитрил и д!1Мст!!лформа ми -.
0 бога щсн «c (— ), (— ) - t 17II tI7optt tta вo3itn> iно, на1:р11ме"„экстракцпей смеси лево-враи;ающего трифорина п мезо-трифорина с ttoi!ottt! 90%-ного годного ацетона, кип>пцего метанола, тетрагпдрофграна или диметилформамида (ДМФ), причем экстракц»я с помощью недостаточного для полного растворения смеси изомеров количества Д.ЧФ является предпочтительной фо-мой обогащения (— ), (— ) -трифорина, так как ДМФ обладает хорошей растворяющей способностью для левовращающего трифорина, п, кроме того, эти растворы можно непосредственно применять
40 для получения эффективных средств защиты растений.
Для выделения оптически чистых изомеров вначале селективной экстракцией отделяют главное количество мезо-формы и
639415 перекристаллизовывают обогащенный оптически активный продукт с содержанием приблизительно 65 — 90% левовращающего трифорина. Особенно пригодными растворителями Лля перекристаллизации являются метанол п ацетонитрил.
Для выделения небольших количеств чистых изомеров можно также применять механический отбор, так как при определенных условиях мезо-форма и оптически активный трифорин образуют различные кристаллы хорошей формы. При медленной кристаллизации смеси из мезо-формы и (— ), (— ) -трифорина из ацетонитрила мезоформа выкристаллизовывается, например, в виде прозрачных, бесцветных призм, а левовра щающий трифорин в виде бесцветных пучков иголок.
По экономическим соображениям для получения средств защиты растений выгодно применять левовращающий трпфорин це в оптически активной, но обогащенной ло 45 — 95% форме.
Пример 1. А. (+), (— )-N-(1-Формамидо-2,2,2-трихлорэтил) пиперазин.
Ii раствору 86 г (1 лоль) пиперазина в смеси из 80 лл 12,5 и. соляной кислоты (1 но,гь) и 800 ил воды при 3 — 5 С, размешивая, в течение приблизительно 30 чин по каплям добавляют раствор 220 г (1,04 лоло) (+ ), (— ) -1,2,2,2-тетрахлорэтилформамида в 400 лiл ацетона и î lnoвременно раствор 140 г (1,03 моль) трпгидрата аиетата натрия в 200 ltn волы.
Прозрачный в начале раствор мелленно становится мутным и осаждается бесцветный вязкий осадок.
B течение дальнейших 30 лин смесь размешивают при 3 — 5 С и затем при той же самой температуре каплями добавляют раствор 170 4гл 6 н. гилрата натрия (1,02 ноль). При комнатной температуре отгоняют ацетон в вакууме, Выделившиеся кристаллы Х,N -бис-(1-формамило - 2,2,2.. рихлорэтил) пиперазина (36,5 г) отсасываот. Водный фильтрат насыщают прибли",èòåëüíî 500 г поваренной соли, причем гидрохлорид указанного соединения выделяется кристаллами. Их отсасывают, растворяют гплрохлорид в 1000 лгл волы, отфильтровывают от нерастворимых примесей и, охлаждая, добавляют 170 лл 6 н. гидрата натрия (1,02 л оль).
Выкристаллизовавшийся бесцветный продукт отсасывают, отмывают ледяной уксусной кислотой до свободного от поваренной соли состояния и высушивают при температуре максимально 50 С. Получают
179 г (68,8% от теоретического) чистого (+), (— )-N-(1-формамидо-2,2,2 - трихлорэтил) шгперазина, т. пл. 133 — 134 С. Вецество без дальнейшей очистки можно перекристаллизовывать из уксусного эфира.
Б. (— ) -N- (1-Формамидо-2,2,2 — трихлорэтил) пиперазин-Л вЂ” (+ ) — гидрогентартратпснтагидрат.
156 г (0,6 моль) (+), (— ) -U- (1-формамило-2,2,2-трихлорэтил) пиперазина и 93 г
5 (0,62 л оль) L(+)-винной кислоты при 30 —40" С растворяют в 800 лгл воды. Раствор в течение приблизительно 24 ч оставляют стоять при 5 С. Отстоявшуюся наверху жидкость осторожно сливают с выделившихся больших прозрачных кристаллов и промывают кристаллизат .дважды с помощью по возможности небольшого количества леляной волы. Остаток высушивают при комнатной температуре на воздухе.
Получают 138,9 г (92,5% от теоретического) (— )-N-(l-формамидо-2,2,2 - трихлорэтил) пиперазин-L- (+) -гидрогентартрат-пентагилрата, (аЯ вЂ” 21,7 (во ia), оптическая чистота 98,1%.
Однократной перекристаллизацией из б ч. воды при температуре .до 50 С полу ают соединение, степень оптической чистоты которого составляет 100 !o, (u);> — 24.8 (вола).
5 Найдено,,. С 27,5; Н 5.5; Х 8,3; Сl 21,3.
CIÍ>гС!л1\зО С4НвОг, 5140.
Вь числеио, % . .С 27,4; Н 5,6; U 8,4;
С! 21,3.
В. (— ) -N- (I-Формамило-2,2,2-трихлор30 эти -.) пиперазин.
250 г (0,5 ноль) (— )-N-(1-формамило2,2,2 -трихлорэтил) пиперазин-1- (+) - гидрогснтартрат-пентагидрата суспендируют в
1500 нл волы. Охлаждая и размешивая, прп температуре приблизительно 5 С к суспензии каплями прибавляют 490 л г 2 н. гпдрата натрия (0,98 лоль). Затем добавляют 700 г поваренной соли, размешивают в течение 1 ч при 5 — 10 С, отсасывают мел40 кокристаллпческий бесцветный осадок и дважды промывают 150 лл ледяной воды каждый раз. Продукт высушивают при комнатной температуре, выход 114,5 г (88,2%
1 от теоретического), т. пл. 140 — 142 С, (а)с
-О
---63,0" (этапол), оптическая чистота 99,o to.
Г. Смесь из (+), (— )-Х,N -бис-((1-фор .л а мило — 2,2,2 — трихлор) этил) пипер азина (мезо-трифорин) и (— ) -К,N -áèñ — ((1-фор
50 мамило-2,2,2-трихлорэтил) пиперазина (левоврашающий трифорин).
К суспснзп.< 7788,,2 2 г г ((00,,3 Зло гь) (— )-Х(! -формамило-2,2,2-трихлорэтил) пиперазина в смеси из 30,3 г (0,3 л оль) триэтиламина и 300 лл аналитически чистого уксусного эфира при 4 С, размешивая, в течение приблизительно 20 лин каплями добавляют раствор 63,3 г (0,3 лоль) (+), 00 () — 1,2,2,2 - тетрахлорэтилформамида в
300 лл аналитически чистого уксусного эфира. Затем перемешивают массу еще в течение 1 ч при максимально 5 С, отсасывают оесцветную смесь кристаллов и промывают 100 нл уксусного эфира.
639415
Высушенный, распыленный остаток извлекают с помощью 600 л.г воды, отсасывают и водой промывают до исчезновения остатков хлорида, Смесь из iv.åçî-трифорина и левовращающего трифорина высушивают в вакууме максимально при 60 С. Получают 115 г трифорина (I А), т. пл. 175 — 176 С (разложение), (а)» — 40,4 (ДМФ), изомерное соотношение мезотриф орина и левовращающего трифорина 51,5: 48,5.
Соединенные уксусноэфирные фильтраты при 40 С упаривают в вакууме. Полутвердый остаток встряхивают со смесью из
200 лл воды и 200 л,г хлористого метилена, Мстиленхлоридную фазу отделяют и оставляют стоять в течение приблизительно 20 ч при Π— 10 С. Образовавшийся осадок трифорина отсасывают, промыва.от водой и . лористым метиленом и высушива1от при 60 С.
Получают 6,8 г продукта, т. пл. 173—
175 С (разложение) (I B), (u)ji -- 73,6 (ДМФ), изомерное соотношс пе мезотрпфорина и левовращаюшего трифорина
12: 88. Общий выход трифорина 121,8 г (93,4", от теоретического) .
Д. Разделение (+), (— ) -N,NI -бис-((1формамидо-2,2,2 — трихлор) этил)пиперазина и (— ), (— ) -N,N -бис- (1-формамидо - 2,2,2трихлор)этил)пиперазина.
Получение затравочных кристаллов. б г распыленного мезо-трифорина с изомерным соотношением 12: 88 растворяют в
135 лл теплого ацетонитрпла. Раствор оставляют стоять в течение 90 ч при комнатной температуре. Маточный раствор осторожно сливают с образовавшихся кристаллов и дважды промывают ацетонитрилом.
Полученные продукты плавятся при
173 — 175 С (разложение), (а)» — 82,2 (ДМФ), изомерное соотношение левовращающегося трифорина к мезо-трифорину
98,5 : 1,5.
Дальнейшей перекристаллизацией из ацетонитрила получают левовращающий трифорин, (а)» — 83,2 (ДМФ) оптическая чистота 99 о .
Разделение главного количества изомерной смеси.
114 г полученной согласно примеру 1 г смеси из мезотрифорина и левовращающего трифорина (I А, изомерное соотношение
51,5: 48,5) мелко распыляют и в течение
5 мин, размешивая, с 580 лл аналитически чистого метанола нагревают с обратным холодильником. Суспензию отсасывают в горячем состоянии на предварительно нагретом путче (остаток П А). Фильтрат аналитически чистым метанолом доводят до объема 580 лл, вновь нагревают до кипения, в случае необходимости в горячем со5
65 стоянии отфильтровывают от незначительной части нерастворенного вещества и сгу щBioT в вакууме.
Получают кристаллический остаток 59 г (II В), (а);; — 63,8 (ДМФ) изомернос со. отношение левовращающего трифорина и мезо-трифорина 76,5: 23,5.
58 г продукта Il В растворяют в 700 л.;. аналитически чистого кипящего метанола.
В теплый раствор вносят затравку мезотрифорина (получение смотри дальше) и в течение 24 ч оставляют стоять при комнатной температуре. Сливают метапольньш раствор с выделившихся кристаллов, состоящих предпочтительно из мезо-формы, и отгоняют растворитель в вакууме.
Остается 35,9 г уже сильно обогащенного (— ), (— ) -трифорина (II С), (а) 5 — 74,0 (ДМФ), пзомерное соотношение левоврашаюшсго трифорииа и изотрифорина 89:
: 11.
30 г распыленного продукта II С растворяют в 600 лл кипящего ацетона, вводя в раствор затравочные кристаллы чистого (— ), (— )-изомера и оставляют стоять в течение 72 ч при комнатной температуре.
Кристаллизат отсасывают, промывают ацетонитрилом и очищают его, перскристаллизовывая два раза из ацетонитрила. Получают 8,6 г чистого (— ), (— ) -трифорина, 7 а т. пл. 176 — 177 С (разложение), (а) i> — 83,0 С (ДМФ) оптическая чистота 990, коэффициент R; 0,50 (хлороформ)метилгликоль = 9: 1, иа силпкагеле).
Найдено, о . С 27,72; Н 3,50; 1 12,75;
Cl 49,15.
С IQH)4C I(jN40
Вычислено, о . .С 27,60: Н 3.2-1; N 12,88;
Cl 48,91.
Остаток II А метанольной экстракции вновь экстрагируют 300 л.4 кипящего метанола и затем 300 лл кипящего ацетонитрила.
Остающийся продукт оптически неактивный и является фактически чистым мезо-трифорином. Продукт можно перекрпсталлпзовать из 150 ч кипящего ацетонитрила, т. пл.
180 С (разложение); (а), О (ДМФ), коэффициент R; 0,57 (хлороформ/метилгликоль = 9: 1, на силикагеле).
Найдено, " . С 27,77; Н 3,38; 12,61;
Cl 48,75.
CIoHI
Вычислено, ",о. С 27,60; Н 3 1; N 12,88;
Cl 48,91.
Аналогично также из (+) - - (1-формамидо-2,2,2-трихлорэтил) пиперазина и D, L1,2,2,2-тетрахлорэтилформамида получают правовращаюший трифорин. Сначала получают изомерную смесь с удельным врагцением —,38,4 (в ДМФ), пз которой фракционированной кристаллизацией можно выделить чистый (+), (+)-N,Х -бис-1(1-формамидо-2,2,2-TpHx;Iop) этил)пиперазин, т. пл.
174 — 175 С (разложение), (а)» ",- 83,7
639415
12 дой и высушивают при температуре ниже
60 С. Получа!от 37,2 г трнфорина, т. пл.
174 — 176 С (разложение), (а) г> — 65,2 (ДМФ, изомерное соотношение левовра5 щающего трифорина и мезо-трифорина
78: 22).
Формы применения средств обычные— гранулы, порошки, эмульсии, концентраты.
Их приготавливают методами, общими при изготовлении препаративных форм пести цидов.
Пример 3. Системное действие против мучнистой росы огурцов (профилактическая обработка).
15 Обработку почвы производят за два дня до заражения. Поражение указано в процентах по сравнению с необработанными контрольными растениями. Результаты приведены в табл. 1.
20 Таблица
Поражении:е,, !озиоовка, ч/млн. действующее вещество
50 i 12,5
77 в
30 форин) 98 94
Пример 4. Системное действие против мучнистой росы огурцов (лечебная обработка).
35 Обработку почвы производят по истечении трех дней после заражения. Поражение указано в процентах по сравнению с необработанными контрольными растениями.
Результаты приведены в табл. 2.
Табл .U,а 2
Дозировка еиств 1ощес начало
12,5
100
100
Пример 5. Действие на листья бобо- 40 вых растений против ржавчины фасоли при лечебной обработке, Опрыскивание листьев производят по истечении четырех дней после зара;кения.
Таблица 3
Поражение, Дозировка действующего начала, и/млн.
-"000 1000 333 111
Действующее начало
57 39
82 78
98 (ДМФ), оптическая чистота 99,5%, коэффициент Ry 0,50 (хлороформ/метилгликоль = 9: 1, на силикагеле).
Пример 2. Обогащение (— ), (— )N,N-бис-((1-формамидо - 2,2,2 - трихлор)этил)пиперазина.
130 г (0,3 л1оль) полученной согласно примеру 1 Г мелкораспыленной смеси из (— ), (— ) -трифорина и мезо-трифорина ((а), — 40,2, изомерное соотношение левовращающего трифорина и мезо-трифорина 48: 52 размешивают с 150 ял диметилформамида в течение 2: при 40 С и затем в течение 2 ч при 20 С. Суспензию отсасывают и остаток дважды промывают 10 лл
ДМФ. Остаток суспендируют в 200 1!л воды, отсасывают, промывают водой и высушивают при температуре ниже 60 С.
Получают 53,1 г вещества, т. пл. 176—
178 С (разложение), (а) ; — 4,7 (ДМФ, изомерное соотношение левовращающего трнфорина и мезо-трифорина 5,5: 94,5).
Соединенные фильтраты диметилформамида в количестве 188 .чл содержат 76 г (40,5 вес. % ) трифорина, содержащего
78,5% левовращающего трифорина и
21,5% мезо-формы. Выход после экстракции (— ), (— ) -формы 96% от теоретичсского.
Диметилформамидный раствор с обогащенным (— ), (— ) -трифорином непосредственно можно превратить в жидкие средства для защиты растений.
Для изолирования обогащенной левовраща1ощей формы в виде твердого вещества 94 лл диметилформамидного раствора ьме!ш1вают в 1500 ил холодной воды. После размешнвания в течение 15 иин выделившееся вещество отсасывают, промывают воА (технически:" трифорин), 97
Поражен:e, действующего > акала, и а лн.
Поражение указано в процентах по сравнению с необработанными контрольными растениями. Результаты приведены в табл. 3.
639415
Формула изобретения
Составитель Т. Тимофеева
Техред С. Антипенко Корректор И. Снмкина
Редактор О. Кузнецова
Заказ 902/1520 Изд. № 338 Тираж 706 Подписное
НПО Государственного комитета СССР по делам изобретений н открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Тип. XaDbK. фил. пред. сПатент>
Таким образом, активность левовращающего трифорина против фитопатогенных грибков, значительно выше, чем активность изомерной смеси трифорина.
Фунгицидный состав, содержащий действующее вещество на основе N,N -бис-((1формамигдо-2,2,2 - трихлор) этил) пиперазина, а также добавку, выбранную из группы: эмульгатор, носитель, наполнитель, о т л ич а ю шийся тем, что, с целью повышения фунгпцидной активности, он содержит
U, ч — бис- ((1 - формамидо - 2,2,2-трихлор)этил1пиперазин в виде левовращающего изомера в количестве 0,001 — 85 вес. ",о, ос5 тальное — добавки.
Источники информации, принятые во внимание при экспертизе:
10 1. Патент Великобритании ¹ 1127457, кл. С 2 С, опублик. 1968.
2. Патент ФРГ № 1901421, кл, 12 р 6/00, опублик. 1969.