Способ получения п-нитрозоанилинов
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВйДЕТЕЛЬСТВУ п,11644780
Со оз Советских
Социалистических
Республик (61) Дополнительное к авт. свид-ву (22) Заявлено 09.11.76 (21) 2417830/23-04 с присоединением заявки № (23) Приоритет (43) Опубликовано 30.01.79. Бюллетень № 4 (51) М. Кл.
С 07С 87/60
Государственный комитет (53) УДК 547.553.07 (088.8) по делам изобретений н открытий (45) Дата опубликования описания 30.01.79 (54) СПОСОБ ПОЛУЧЕНИЯ и-НИТРОЗОАНИЛИНОВ
N б
R к
25
1 011
II р.— "— с — с — R и
0 0
1
Настоящее изобретение относится к новому способу получения новых, не описанных в литературе п-нитрозоанилинов, которые могут быть использованы в качестве промежуточных продуктов в синтезе диазосоединений (в том числе светочувствительных, антиоксидантов, инсектицидов) .
В литературе описаны различные способы получения п-нитрозоанилинов, которые, однако, предполагают использование в качестве исходных продуктов ароматических соединений. Так, в частности, описаны нитрозирование третичных ароматических аминов, перегруппировка N-нитрозоанилинов (Фишер-Хепп), окисление арилгидроксиламинов, окисление ароматических аминов
И.
Недостатком известных способов является использование тех или иных ароматических соединений в качестве исходных продуктов, что существенно ограничивает возможности известнь1х методов.
Целью данного изобретения является разработка нового способа получения и-нитрозоанилинов, основанного на использовании легкодоступных алифатических соединений, в результате образующих ароматическую систему. Другой целью описываемого изобретения является синтез новых, не известных ранее мета-замещенных и-нитрозоанилинов с различными заместителями у атома азота аминогруппы и ароматического кольца, которые бы обладали ценными свойствами.
5 Поставленная цель достигается новым способом получения новых и-нитрозоанилинов общей формулы 1 где R — метил, фенил, п-хлорфенил, и-метилфенил или 4-пиридил; R> — метил или фенил; R2 — водород, этил, оксиэтил, изопропил или циклогексил; R3 — этил, оксиэтил или циклогексил, или R2 и R3 вместе с атомом азота образуют пиперидиновую или мор фолиновую группу, заключающимся в том, что соединение общей формулы II
644780
/Kz нн
"к. где R и R имеют указанные выше значения, подвергают взаимодействию с ацетоном и амином общей формулы П1 где Rz u Ra — имеют указанные выше значения, или соответствующим основанием
Шиффа при мольном соотношении исходных реагентов, равном соответственно 1; 5—
15: 1,5 — 2.
Процесс проводят при комнатной температуре в течение 24 — 336 ч.
Общий метод получения п-нитрозоанилинов
К 0,01 моля изонитрозо+дикарбонильного соединения добавляют смесь 0,02 моля амина и 4 молей безводного ацетона, Смесь выдерживают при комнатной температуре
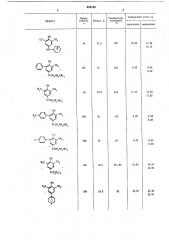
24 — 336 ч, после чего реакционную массу переносят в делительную воронку, содержащую 100 мл эфира, и промывают 3 /О-ным раствором щелочи, затем водой. Эфир упаривают, а продукт, в большинстве случаев маслянистый, промывают диэтиловым эфиром до тех пор, пока он не перейдет в твердое состояние. В некоторых случаях конечный продукт сразу получают в кристалличсском виде. По описанной методике получают соединения, представленные в таблице.
Пример 1. К 0,01 моля (1,29 г) из онитрозоацетилацетона добавляют смесь
0,02 моля (1,46 г) диэтаноламина и 4 мл безводного ацетона. Смесь выдерживают при комнатной температуре в течение
96 ч, после чего образовавшийся осадок коричневого цвета отфильтровывают и промывают на фильтре диэтиловым эфиром. После перекристаллизации из смеси хлороформ: ацетон=1: 3 выход 3,5-диметил-4-нитрозо-N,N-ди- (р-оксиэтил) -анилина составляет 53,5 /о, т. пл. 144 С.
Пример 2, В случае использования изонитрозобензоил ацетон а реакцию проводят аналогично примеру 1. Реакционную смесь выдерживают в течение 161 ч. Образовавшиеся кристаллы зеленого цвета отфильтровывают и промывают диэтиловым эфиром.
Выход 3-метил-5-фенил-4-нитрозо-N N-ди5
Зо
4 (P - оксиэтил) - анилина составляет 70 /о, т, пл. 150 С.
Пример 3. К 0,01 моля (1,629 г) изонитрозоацетилацетона добавляют смесь
0,02 моля (3,62 г) дициклогексиламина и
3 мл безводного ацетона. Смесь выдерживают при комнатной температуре в течение
120 ч, после чего образовавшийся осадок светло-зеленого цвета отфильтровывают, промывают 3 -ным раствором щелочи и водой. Выход 3 5-диметил-4-нитрозо-N N-дициклогексиланилина составляет 41,5 /о, т. пл. 96 С, Пример 4. К 0,01 моля (1,29 г) изонитрозоацетил ацетона добавляют раствор
0,011 моля (1,4 г) изопропилиденциклогексиламина в 2 мл ацетона. Смесь выдерживают при комнатной температуре в течение
48 ч, после чего реакционную массу обрабатывают, как указано в общей методике. Выход 3,5-диметил-N-циклогексил-п-нитрозоанилина составляет 15 /о; т. пл. 136 С.
Пример 5. К 0,01 моля (2,53 г) изонитрозодибензоилметана добавляют раствор
0,02 моля (1,7 г) пиперидина и 3 мл безводного ацетона. Смесь выдерживают при комнатной температуре в течение 40 суток, после чего реакционную массу обрабатывают, как указано в общей методике. Выход 2,6дифенил -4- (N- пиперидино) - нитрозобензола составляет 26 /о, т. пл. 68 — 69 С.
Пример 6. К 0,01 моля (2 53 г) изонитрозодибензоилметана добавляют раствор
0,02 моля (1,98 г) циклогексиламина и 7 мл безводного ацетона. Смесь выдерживают при комнатной температуре в течение 22 суток, после чего реакционную массу обрабатывают по общей методике, Выход 3,5-дифенил-N-циклогексил -4- нитрозоанилина составляет 62 ; т. пл. 72 — 73 С.
Пример 7. К 0,01 моля (1,92 г) 1-(4-пиридил) -1,2,3-бутантрион-2-оксима добавляют раствор 0,02 моля (1,46 г) диэтиламина в 3 мл ацетона. Смесь выдерживают при комнатной температуре в течение 72. ч, после чего реакционную массу переносят в делительную воронку, содержащую 100 мл эфира, и промывают 3 /о-ным раствором щелочи, затем водой. Эфир упаривают, а продукт промывают диэтиловым эфиром. Выход 3-метил-5- (4-пиридил) -N,N-диэтил-4-нитрозоанилина составляет ЗОО/о; т. пл, 115 С.
644780
Продукт
Выход, у, вычислено нс
136
12,05
21,5
CH
9,35
192
150
11,75
53,5
N0
СН
8,96
336
115
8,35
117
78 сн
13,55
89 — 90
43,7
168
12,70
24,5
N(CH CH ОН)а
N(CH СН ОН)т
Х СН„СН бН) Н(СН,СН,ОН), Время синтеза, ч
Температура плавления, ОС
Содержание азота, у, определено
11,98
12,15
9,54
9,48
11,79
11,62
8,93
8,85
8,25
8,36
13,44
13,39
12,45
12,52
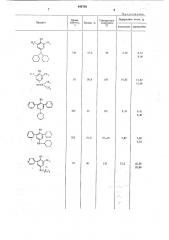
644780
Выход, %
Продукт вычислено
СН
НЗС
8,92
148
41,5
14,55
20,8
106
960
8,18
528
72 — 73
61,8
7,87
72
15,6
115
c5,:
Г) NO
Сь
6 °
1Ч (СЗН5) а
Время синтеза, ч
Температура плавления, ОС
Продолжение (.одержание азота, % определено
9,12
9,08
14,42
14,38
8,41
8,40
7,62
7,73
15,58
15,50
644780
Формула изобретения юон
ll р,— с- с - с-а< и
0 О
Х0
10
N б
3 2
Составитель Т. Власова
Корректоры: А. Галахова и Т. Добровольская
Редактор В, Минасбекова
Техред Н. Строганова
Заказ 2708/9 Изд. № 157 Тираж 520 Подписное
НПО Государственного комитета СССР по делам изобретений и открытий
113035, Москва, 3С-35, Раушская наб., д. 4/5
Типография, пр, Сапунова, 2
Способ получения и-нитрозоанилинов общей формулы 1 где R — метил, фенил, п-хлорфенил, и-метилфенил, или 4-пиридил; R> — метил или фенил; R2 — водород, этил, оксиэтил, изопропил или циклогексил; R3 — этил, оксиэтил или циклогексил, или R и Яз вместе с атомом азота образуют пиперидиновую или морфолиновую группу, отличающийся тем, что соединение общей формулы II где R и R имеют указанные выше значения, подвергают взаимодействию с ацетоном и амином общей формулы Ш
15 где R2 и R3 имеют указанные значения, или соответствующим основанием Шиффа при мольном соотношении исходных реагентов, равном соответственно 1: 5—
15: 1,5 — 2.
20 Источники информации, принятые во внимание при экспертизе
1. Химия нитро- и нитрозогрупп. Т. 1.
Ред. Г. Фойер. М., «Мир», 1972, с. 163 — 178.