Способ получения гидрохлоридов оптически активных антрациклинонгликозидов
Иллюстрации
Показать всеРеферат
(» 646914
L (5!) М. Кл. (6!) Дополнительный к патенту— (22} Заявлено 0З,12.76 (2!)
/2425700/23-04 (23) Приоритет 2 1О1.76 (32) 22.01.75
С 07 Н 15/24
//А 61 К 31/70 (3! ) 269 l/75 (33) Великобритания . Опубликовано05.02.79.Бюллетень Ж 5
Дата опублинования описания 08.02.79
Иностранцы
Федерико Аркамоне, Луиджи Бернарди, Бьянка Нателли и Аурелио ди Марко (Италия} (72) Авторы изобретения
Иностранная фирма
"Сочиета Фармасьютичн Италиа С.п.А" (Италия} (7!) Заявитель
Е (54) СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДОВ ОПТИЧЕСКИ
АКТИВНЦХ АНТРАЦИКЛИНОНГЛИКОЗИДОВ. Изобретение относится к способу получения новых соединений — гидрохлоридов оптически активных антрацнклинонгликозидов, обладающих ценными фармакологическими свойствами.
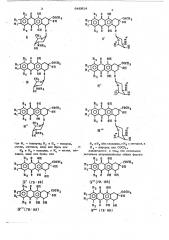
Основанный на известкой реакция образования гликозидной связи 1, предлагаемый способ получения гидрохлорнда оптически активных антрапиклинон-гликозидов общих формул сосн
ОН м о сиo
ОН
Союз Соеетскмв
Соцмалмстйиескм»
Республик
} ввуйврвтвипаб майт
СССР вв левам взобривввв и вткрмтвй (53) УДК547.673. .1.615.7 (088.8 }
О OM
RR
СОЕН
ОН бобы
ОИ
В1
В(сан, ОН
СОСн он
К, а ОК
СО4н, 08
Ri
О Ой О
606Hg с ОН.<оса
0Н. З и
В1 1
2 ОН (та: ss) Ъ О ОН ОН.
Я" (7R: 9В) в, О ои
СОСИ
ОН
CodH3
ОН 1 1
R2 О ОН ОН
Й " (7$:9В) где й„- водород; R> и R - водород, метил, метокси, хлор или бром или 4о
R и R - водород, а Р, - метил, меЧ токси, хлор или бром, или
В, О ОН
К и Р оба-водород, à R< - метокси, и.
Р, - водород или C0CFB, заключается,. в том что оптически активные антрациклиноны общих формул
Я О ОН (64 где 8 R2 и R имеют вышеуказанные ,(В значения, подвергают взаимодействию с
1,2,3,6-тетрадеокси-4-0-трифтор ацетил-
-3-трифторацетиламидо- L -ликсо-гексен-1-пиранозой в безводном бензоле или нитрбметане s присутствии ц-топуолсупьфокислоты, полученное 7-(4 -О-трифторВ ацетил-3 -трифторацетамидо- Ь -ликсо-пираноэип)-производное обрабатывают метанолом, затем в случае необходимости удаляют трифторацетильные защитные группы гидролизом 0,1 н.раствором ед-. кого натра и полученное основание обрабатывают 0,1 н.метанопьным раствором соляной кислоты.
Пример 1. К 4-деметоксидауномицинону (М где R„"-R Ж Н} (1г) в бензоле (200 мп} добавляют 1,2,3,6-тетрад еокси-4-О-трифтор ацетил-3-трифторацетамидо- 1, -ликсо-гексен-1-пиранозу (3 г) и п-толуолсульфокиспоту (30 мг}, Раствор нагревают 8 ч с обратным холодильником в темноте, добавляют пиридин (0,1 мл) и выпаривают в ваку-уме. Остаток растворяют в хлороформе, отмывают водой и 5%-ным раствором бикарбоната натрия. Растворитель выпаривают в вакууме, остаток растворяют в метаноле (350 мп) и оставляют на ночь при комнатной температуре. После, выпаривания растворителя остаток хроматографируют на силикагеле (20 г), элюируя вначале хлороформом, а затем смесью хлороформ - ацетон (19;1) и получают 0,6 T (() -(-)-даунозаминил«4-
-деметоксидауномицинон- И-трифторацетата (g, где R„=P =Р «Н; ЕадСОСРа ), т.ии. 155-155оC; d. 1й = т200 (с
=0,1 диоксаи), и 0,5 r 5-(-)-иаомара (Х, где Р(=Р =R =H; R =C0CFp ), т.пл.
1 -0оС, 1 20 +100 о ( оксан). Полученный трифторацетат растворяют в 40 мл 0,1 н.раствора едкого натра, выдерживают 30 мин при комнатной температуре, добавляют соляную кислоту до рН 8 и экстрагируют хлороформом. После выпаривания растворителя остаток помешают в небольшое количество смеси хлороформ-метанол; 0,1 н.метанольный раствор соляной кислоты добавляют до рН 4,5, затем приливают этиловый эфир до осаждения гидрохлорида о (-) даунозаминнл--4-деметоксидауно мицинона (4-.деметоксидауномицин, Т, где R, R =0 =0, =Н),,Выход 0,35 г; т.пл. 183-185(1C;(oL1 = +210 (с
0,1, метанол). Аналогичным образом
6914 6 получают гидрохпорид P -(-}-дауноэаминил-4-деметоксидауно) ицинона (P-4-деметоксидауномицин, g где Р =Р R .
1 2
R =И.),f<) > - +124 (c,1 этанол).
$ Для 4-деметоксидауномицина Л „256, 460, 486, 520 нм.
В примерах 2-19 проводят опыт, как в примере 1.
Пример 2. При конденсации 4<ц -деметокси-7,9-бис-эпи-дауномицинона .(W, где Р =Б =Б Н) с 1,2,3,6-тетрадеокси-4-О-трифторацетил-3-трифторацетамидо- ь -ликсо-гексен-1-пиранозой полу чают ()(-7,9-бис-эпи-4-деметоксидауномицин- й-трифторацетат (3 где Р, P >.
=g "-Н; Б) -COCF3) т.цл. 210-215 С; о )20 -91 (с-"0,1 диоксан), и (ь -изомер (Й где R< ь Р, Н Rg=C0CFy) о т.пл. 165-167 С; f ) -270 (с
=0,1, диоксан).
Д вЂ” и р -Изомеры разделяют на колонке с снликагелем, злюируя смесью хлороформ — ацетон (80:20) по объему).
После гидролиэа получают гидрохлорид
+ о(. -7,9-бис-эпи-4-деметоксидауномицина («, где R Рд=Р =Р, -"Н), т.пл. 205207 C;j
Пример 3, Гидрохлорид 7,9-бис-эпи-дауномицина (ф, где Р -Р =R Н;
R ОСН ) получают из дауномицинона.
7 А
Пример 4. Гидрохлорид 1-метоксидауномицина (7, где R R =Н; R>-R-OCH ), получают из i-метоксидауномй( ((и р где Vq Hp Rg Py 0CH g) а
Пример 5. Гидрохлорид 1-метокси-7,9-бис-зпи-дауномицина (f6 > где р Д «Н, R Р =ОСН ) синтезируют, ис1" 4= 2 пользуя в качестве исходного соединении
1-метокси-7,9-бис-эпи-дауномицинон (1Ч, где Pj Н; И =Р =ОСН ).
Пример 6. Гидрохлорид 4-деметокси-1,4-диметилдауномицина (I, где
R„=P =Н; R, =R H ) получают, исходя иэ 4-деметокси-1,4циметилдауномипинона ()М, где R =Н; R =Р «СН ). Для
:,целевого цродукта Л 256, 472, 495, 530 нм, Пример 7. Гидрохлорид 4-демзтокси«1,4-диметил-7,9-бис-эпи-дауномилина (3 где R,,яй;-Н; R "-R =СН ) синтезируют из 4-деметокси-1,4-диметилв
lg
-7,9-бис-эпи-дауномицинона (», где
Ц =На Я =Ц) H y) 7
646914 в о о н +3 он сося
ОН
К о Оц в2 о о о
Пример 8.Гидрохлорид 4-демет- окси-l,4-дихлордауномицина (7, где Р аР =Н; ИрР -С6;) получают из 4- °
-деметокСИ- 1,4-дихлордауномицйнона 1»Ч, где R„ н; R2 Р сЩ.- Для целевого про,дукта В„щц,© 262s 480, 508, 545 нм.
Пример 9. Гидрохлорид 4-деметокси-1,4-дихлор-7,9-бис-апи;aay»»n -4 мицииа (ф, где Р «Р Н; Р2Р СС) по лучают, исходи из 4-деметокси-1,4-дихлор-7,9-бис-эпидауно»»4ицинона (1ч, где
Я Н; Р =Р =С ).
П. р и м е р 10. Гидрохлорид 4-деметокси- 1,4-дибромдауномицина (J где
p4=P<"-Н; R =Р =В -) получают, используя в качестве исходного соединения 4.
-деметокси-1,4-дибромдауномицинон (1Ч, гдэ Р ; Р У =В»-).
Пример 11. Гидрохлорид 4-деметокси-1,4-дибром-7,9-6ис-эпи-дауномицина (1», где Я1 В "-Н;. R2-"R>=Br) получают из 4--деметокси-1,4-дибром"-7;9;-бис-эпи-дауномицинона (lV, где =Н; R,-Р,=В»-}.
Пример 12. Гидрохлорид 4-де-, метокси-2,3-диметилдауномицина (Х, R1 3 ° 2 3 4 .- исходя ga 4-деяетокси-2,3 диметилдау"6и (1Ч " РЕНЭ R = ъ=н). После "гидролиза < -4-деметокси-2,3-a»»MeTmra ayHo»4Hmra- К -трифторацетата (J, где Р»=СН, Р -«Р =Н; Р4=СОСРу), тцл. 233-235 С, t )2c», * +181» . (с
0,1, диоксан), получают гидрохлорид -4-деметокси-2,3-диметилдауномицина, т.пл. 190-192 С; (аД20 +180 (c,1, метанол).
Для 4-деметокси-2,3-диметилдауномицинаА»,2«268, 458, 485, 528 нм..
Пример 13. Гидрохлорид 4-деметокси-2,3-диметил-7,9- бис-эпи-дауномицина ($ где R H, 1? =Р =R+=Í} получают из 2,3-диметйл-7,9-бис-эпи-аМ номицинона (>Y, где g H R R H) Пример 14, Гидрохлорид 4-деметокси-2,3-диметоксидауномицина (7, 0Н
8 где R =ОСН R "-k =Р =Н) синтезируют, 2 З
1исходя из 4-деметокси-2,3-дим жоксидауномицинона (1Ч, где Р„ОСН; РЯ -H).
5 Пример 15. Гидрохлорид 4.-деметокси-2,3-диметокси-7,9-бис-эпи-д ауномицина (»», где R =0CH R2«Р «Р4-„
-Н) получают из 4-деметокси-2,4-диметокси-7,9-бис-эпи-дауномицинона (1Ч, »О где R< WCH Р «Р «Н). л я=
Пример Ы. Гидрохлорид 4-д еметокси-2,3-дихлордауномицина (У, где
Р„ ; РхР «Р «Н) получают из 4-деметокси-2,3-дихлордауномицинона (1Ч, 15 где Р„ С ; Р2Р Н) через (. -4-деметокси-2,3-дихлордауномицин- И-трифторацетат (1, где Р„-СР; Р "-Р -"Н; Р4=
"-СОСГ ), т.пл. 238-240 С; д„ 2 +170
Р
{с = 0,1, диоксан).
20 " °
Для гидрохлорида d. -изомера (сА .» »
2о
= +170© (с=0,1 метанол). Для 4-демет:окси-2,3-дихлордауномицина A «272, 466, 494, 530 нм.
Пример 17. Гидрохлорид 4-де25 метокси-2,3-дихлор-7,9-6ис-эпи-дауно- мицина (ég, где R -"С ; Р -I?>=P4=H) получают, используя в качеотве исходного соединения 4-деметокси-2 3-дихлор-7,9-бис-эпи-дауномицин (1Ч, где R4 =
Я
-C0; R =Р "-Н}.
2 Ъ
Пример 18. Гидрохлорид 4-деметокси-2,3-дибромдауномицина (7, где
Р =Вг; R "-R =Р4=Н) синтезируют из 4—
1 а Ъ
-д еметокси-2, 3-д ибро мд ауномицина (1Ч, где R =В "; R =Р =Н).
° 2 3
Пример 19. Гидрохлорид 4-де- метокси-2,3-д ибро м-7, 9-бис-апи-д ауномицина (p, где Я -"В».; R> R>"-R<=H) по40 лучают, исходи из 4-деметокси-2,3-ди1 бром-7,9-бис-эпи-дауномицинона (1Ч, где R "-В»", Rã Рз Н}
Формула изобретения
45.:.
Способ получения гидрохлоридов оптически активных антрациклинон-гликозидов общих формул
lO
R 0 On
646914
1, О О
ЕеЕн
ОН
Ej
1ОСН
ОН к, К1
К,О ОКО
ОН в о оя
О 3, ON
СОСН
ОН
Rg 0 0К 0
ОН О
ОН
10СН, 0Е
Rf
К1 и 0 ОНО
В, О Ок О
Я О ОН
-сосн
ОН
СОСН
ОН
R2 О ОН Он
В, О ОП ОП
Гч" (7В 9E)
Я О ОН ч (7g:9$)
З О 0М
-C6Ct13
0H.
В 1
В О ОК ОН
Я"" (75: 9R) В О ОН ОЫ
Ж" (73: 93) где R< — водород; и и R® — водород, метил, метокси, хлор нли бром, или R> .и R оoб а я в ля ю т сcя в оoд оoрpоoд оoм, à R метил, метокси, хлор или бром, или
Ж .
C р„и Я оба являются. водородом,а 12 ь метокси g — водород нли СОСГ, о тл и ч а ю ш и и с я тем, что оптичес4Q ки активные антрациклиноны обшнх формул
М К
646914
11 где К,, и, Ц имеют вышеуказанные значения, подвергают взаимодействию с
1,2,3,6гетрадеокси-4-0--трифторацетил-3-трифторапетиламипо- 4-:ликсо-гексен
-1-пиранозой в безводном бензоле или иитрометане в присутствии И -толуолсулъфокислоты i полученное 7-(4".-0-три,) фторапетил-3 -трифторапетамидо- Ь -лик со-иираноэил}-производное обрабатывают метанолом, с последующим в случае необходимости снятием трифторацетильных защитных групп гидролизом 0,1 н. йаОН и полученное основание обрабатывают 0,1 н,метанольным раствором соляной кислоты, Источники информации, принятые во внимание при экспертизе
1. Н. Кочетков н др. Химия углево>0 дов, М., Химия", 1867, с. 208.
Составитель Л. Никулина редактор Т. Шерганова Техред Э. Чужик Корректор А. Власенко
Заказ 174/51 Тираж 512 Подписное
БНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4