Способ получения производных бензофурана
Иллюстрации
Показать всеРеферат
ОП ИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Сема Соввтсинк
Сециалистмчаскнх
Рвспублии (61) Дополнительный к патенту (22) Заявлено 171273 (21) 1981053/23-04 (23) Приоритет — (32) 18 ° 12. 72
Государственный комн тет
СССР I по делам нзобретеннй н открытн1 (31) 18 39 7 (33) Швейцария (53) У,И,К547. 814.07 (088.8) O0y6lfHKoB3R01$0579. БюллЕтЕнь №18
Дата опубликования описания 1"»05.79 (72) Автор изобретения
Иностранец
Вильфрид Зам (Швейцария) Иностранная фирма Хехст A.Ã. (ФРГ) (7!) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
БЕНЗОФУРАНА л ен, н афтил ен и ли би фен илэтилиден, причем в остатке имвощиеся двойные ст»яви расположены так, что они находятся в сопряжении с двойными свяэямн одного или нескольких бензофурановых остатков.
Эти соединения могут быть использованы в качестве оптических отбеливателей, а также являются промежуточными продуктами в синтезе биологически активных соединений, красителей и сцинтилляторов.
Известен способ получения 2-(п-нитрофенил)-бензофурана циклизацией о-(n-Йитробензилокси)-бенэальдегида в присутствии карбоната калия в качестве конденсирующего средства в среде метанола при нагревании.
Однако этот способ не является универсальным, т.к. согласно этому способу может быть получен только п-нитрофенилбензофуран, так как только в этом случае соответствующее исходное соединение обладает достаточной реакционной способностью благодаря наличию нитрогруппы. В случае, если вместо нитрогруппы присутствует где
Изобретение относится к способу получения новых производных бенэофурана формулы I
К
Р и Q — атом водорода или низший 10 алкил с прямой разветвленной цепью или P и Q вместе дополняют. бензольное кольцо
R — атом водорода или низший 16 алкил;
n — целое чйсло, равное 1 или 2, причем когда п —целое число, равное 1, то D - бифенил, стирил,, нафтооксаэолил, бензоксазолил, фенил или нафтил, незамещенные или замещенные циано-, нитро-, кар6окси- или карбоалкокси- группой,. и в случае, когда и — целое число. Равное, D - простая связь, фенилен, бифенилен, стырил еи, стильбилен, фури— (111
М ь у. »» р.»
»
1 (51) М. Кл.
С 07 D 307/79
С 07 D 407/02
D 06 Ь 3/12
Ьб 3304 какой-либо иной заместитель, исход- ное соединение уже не обладает достаточной реакционной способностью и осуществить циклизацию с образованием фуранового кольца не удается.
Поэтому этот известный способ может быть использован исключительно лишь для получения одного только соединения, 2-(n-нитрофенил)-бензофурана.
Целью изобретения является новый универсальный способ получения производных бенэофурана являющихся оптиI ческими отбеливателями.
Предлагаемый способ заключается в том, что альдимин формулы XT
20 где Р, Q, R, n и Р имеют указанные выше значения, и 4 — третичный алкил, фенил, хлорфенил, причем возможные заместители в остатке D не должны иметь водородных атомов, ко- 25 торые замещаются атомами металла также легко, как атомы водорода в соседней с остатком D метиленовой группы, подвергают взаимодействию с гидроокисью или алкоголятом щелоч- 30 ного или щелочноземельного металла или их смеси в среде диметилформамида, дизтилформамида, N,И-диметил- ацетамида или трисамида гексаметил фосфорной кислоты при 20-130 С. 35
Растворитель используют в чистом виде или в виде смеси растворителей.
Кроме того, в процессе используют сильное основное конденсирующее средство. Применение находят обладающие 4) сильной основностью соединения щелоч ноземельных металлов и, в особенности, соединения щелочных металлов, напрймер их гидроокиси.
В качестве алкоголятов могут быть использованы такие, которые получены 45 из линейных, разветвленных или циклических алифатических спиртов, содержащих в своем составе до 8 атомов углерода, преимущественным образом иэ линейных спиртов, содержащих в своем 50 составе от 1 до 4 атомов углерода.
Наиболее предпочтительно используют соответствующие соединения натрия или калия, среди которых особое практическое значение имеют гидроокиси и алко- 55 голяты этих Металлов. Также можно использовать смеси подобных оснований.
Ц елочное конденсирующее средство используют по крайней мере в эквивалентном количестве, лучше в несколько раз превышающем эквивалентное, особенно в тех случаях, когда исйользуют соединения, которые содержат группы, способные гидролизоваться, или когда реакцию необходимо проводить при повыиенных температурах и когда часть конденсирующего средства расходуется в результате реакции с растворителем.
Когда в исходных соединениях, вводимых в реакцию конденсации, содержатся чувствительные к гидролизу остатки, например, сложноэфирные карбоксильные группировки, в особенности при повышенных реакционных температурах, выделяют продукт конденсации, в котором эти группы полностью гидролиэованы, например выделяют свободную карбоновую кислоту или соответствующую соль карбоновой кислоты.
Особое преимущество способа эаклю» чается в том, что обычно реакцию можно проводить в мягких условиях. При проведении реакции нет необходимости использовать температуру выше 130 С., Температура выше 130 С применяется о лишь в исключительных случаях. реакция проходит уже при комнатной температуре беэ необходимости подвода тепла извне. Осббенно в случае использования алкоголятов калия или гидроокиси калия. Однако в некоторых случаях предпочтительно или даже необходимо реакционную смесь, которую целесообразно держать в атмосфере азота, медленно нагревать от 30 до 120 С и затем в течение некоторого времени выдерживать при этой температуре.
Важное преимущество способа, которое основывается на легкости, с которой протекает реакция, заключается в том, что целевой продукт может быть получен почти с количественным выходом.
Продукты взаимодействия могут быть выделены из реакционной смеси с помощью обычных известных методов.
Данный способ является универсальным благодаря использованию в качестве исходных соединений, содержащих альдимииную группу, т.е. соединений, обладающих достаточно высокой реакционной способностью независимо от вида заместителя в арильном кольце; циклиэация во всех случаях осуществляется легко. Таким образом, независимо от вида заместителя в арильном кольце, становится возможным получение с высокими выходами соединений 2-арилбензофуранов, которые по известному ранее способу не могли врыть получены.
Пример 1. 21,1 r W È-бисвЂ(о-фторфенилокси)-дибензила нагревают при температуре кипения с 4,7 r анилина и 0,05 r паратолуолсульфокислоты в 250 мл толуола в течение
2 ч, причем отщепляющуюся в процессе реакции воду отделяют с помощью водоотделителя. Непосредственно после этого реакционную смесь охлаждают, отсасывают образовавшийся осадок, промывают его метиловым спиртом и затем сушат в вакууме при 60 С.
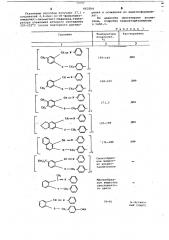
Б 66330 4 6 указанным способом получают 27,1 г рения и осаждения из диметилформамисоединений 4,4-бис-(о-(N -фенилбенэ- да). имидолил)-оксимстил)-бифенила,темп@- По аналогии синтезируют азомература плавления которого составляет тины, подробно охарактеризованные
220-222 С (после повторного раство- в табл.1.
Таблица 1
195-197
168-165
172, 5
185-189
176-180
ЛИФ
Сн, I
79-8 1 (н-Бутиловый спирт) СН И
0 — СН, / н11
Смолообраз-. ное вещество некристаллическое
Иаслообразное вещество светложелтого цвета
663304
Продолжение табл. 1 °
CH = У
0-Сн-Сн=Сн
125-125,5 (н-Бутиловый спирт) 132-134 (неочищенный продукт) Π— Свг
87-95. (неочищенный продукт) CK N й.
167-169
160-16 3
179-181
0 — Снг
Однако в большинстве случаев нет необходимости в раздельном промЮку- точном выделении или в очистке азоме тинов. В этих случаях обработку реак -. ционнбй смеси производят отгонкой в вакууме растворителя, использованного.при получении азометина с последующей заменой подходящим диполярным растворителем и непосредственным провед4нием реакции замыкания цикла, опи.санной в примере 2.
Пример 2. 31,4 г И -fo-(п-цианофенилметокси)-бензилиден)-анилина растворяют при комнатной температуре в 250 мл диметилформамида. К приготовленному раствору прибавляют
6 r гидроокиси калия (порошкообразная, примерно 95%-ная) и реакционную смесь перемешивают в течение 45 мин без подвода тепла извне. непосредственно после этого реакционную смесь вводят при перемешивании в 500 мл ледяной воды и полученную смесь доводят до нейтральной реакции прибавлением
2 н. раствора соляной кислоты. Непосредственно после этого производят отсасывание, промывку водой и.сушку в вакууме при 60 С..В результате проведенных операций получают 21,5 г неочищенного продукта, 2-(n-цианофенил)-бензофурана, температура плавления которого составляет 137-139 С.
Вещество подвергают очистке посредством перекристаллизации из бензина (область температур кипения 1000
150 С). Температура плавления перекристаллизованного продукта составля-, ет 141,5-142,5оС, Пример 3. 57,2 r 4,4-бис- jo-(N-фенилбензимидоил) -оксилметил)бифенила суспендируют в 400 мл диметилформамида. К приготовленной суспензии прибавляют 12,5 r гндроокиси бб 3304 l0 иден-анилина растворяют в 400 мл ная),реакционную смесь сначайа перествору прибавляют 7 r гидроокиси калия (по,.ошкообюазная, примерно 85%ная),реакционную смесь сначала перемешивают в течение 30 мин при 60 С и затем в течение 60 мин при 115 С.
Непосредственно после этого реакм- . -ционную смесь охлаждают на ледяной бане примерно до 5 С, после чего отфильтровывают выделившийся в осадок
- l0 продукт. Полученный продукт промывают сначала метиловым спиртом, а за тем водой. После сушки в вакууме при
60 С получают 30,5 г неочищенного и-бис-(бензофурил-2) -бензола.
218-220
КОН
С11 СН
100
124-125
КОН
9 калия (порошкообразная, примерно
90%-ная) и реакционную смесь медлен но нагревают дб 100-120 С. Укаэанную температуру поддерживают в течение
3 ч, непосредственно после этого реакционную смесь охлаждают до комнатной температуры и фильтруют выделившийся в осадок продукт. Полученный продукт сначала промавают диметилфор амидом, затем водой до нейтральной реакции промывных вод, после чего продукт сушат в вакууме при 60 С.ука занным способом получают 36 г неочищенного 4,4-бис(бенэофурил-2) -бифе нила, который затем подвергают очистке посредством переосаждения из с -хлорнафталина. Температура плавле- 15 ния 350 С, мол.вес 368,45, макс. абсорбция (ДМФ)! 351 мм, б 7,06 104
Найдено, Ъ: С 87,7; Н 4,80, Вычислено, Ъ: С 87,9; Н 4, 79.
П р и м.е р 4.N"to-(феналлилокси)- 0
-бенэилиден)-анилин.
36,3 r растворяют в 400 мл N N-диметилацетамида. К приготовленному раствору прибавляют 12,2 r трет .бутилата калия и полученную реакционную смесь нагревают при перемешиваиии в течение 2 ч.и температуре 80-90оС.
После охлаждений реакционную смесь
;обрабатывают аналогично тому, как это описано в примере 2. В результате проведенных операций получают 26 г 3О неочищенного 2-стирилнафто (1,2-Ь) фурана) которое с целью очистки можно перекристаллизовывать из н-бутилового спирта при добавлении активированного угля. Температура плавления 35 полученного продукта составляет 176177 C.
Пр и м е р 5, 40,3 г N- î-)ивЂ(бенэофурил-2)-бензилокси) -бенэилНеочищенное вещество .перекристаллизовывают из диметилформамида при добавлении активированного угля. Температура плавления полученного продукта составляет 308-309 C.
Пример 6. 37,7 г N-(2-(бензофурил-2-метокси)-нафтилметилен)— анилина растворяют в 400 мл гексаметилтриамида фосфорной кислоты и к .приготовленному раствору прибавляют
7 г гидроокиси натрия. Реакционную смесь перемешивают в течение 2 ч при
60 С и непосредственно после этого
-обработку реакционной смеси производят аналогично тому, как это описано в примере 2. В результате проведенных операций получают 25 r неочищенного .продукта.
Температура плавления полученйого
2- (бензофурил) -нафто1 f 1. 2-Ь) фурана
171о C
По аналогии с описанным выше примером синтезируют соединения, указанные в приводимых табл. 2 и 3.
Таблица 2
663304
199-200
25 саосн
126-128
25 кон
2 5-36
120
222-223
СОЮН
NaOH
NaOH
195
25
КОН
197-198
KOH
100
КОН
145
110
0Я-СН
КОН
110
204
КОН
298
К0Н
Сообк, 114i5
Сюж 140
Продолжение табл.2. гитик кон
Ко-трет, бутилат
КО-трет ° бутилат
66 3304
Продолиение табл.2
171-172,5 ДМФ
КОН
144-145,5 ДМФ
NaOH
NaOH к со
170-172
КОН
90
КОН
193-194
125
NaOH
> 350
ДМА
> 350
125
NaOH
) 350
125
Na0H
) 350
125
120
КОН
120
КОН
) 350
ГМТАФК КОН
121
П р и м е ч а н и е: ГМТйФК-гексаметилтриамид фосфорной кислоты.
3 CHs
127-128
ГИТИК КО-трет. бутилат бб 3304
356
381
391
C,îåÑí, 381
372
384
287-293
258
289
283-285
CR Фк
+ 350-352
391
СН3
CK CR
СН CR 0
0113
6Rg
Сн ск !
ЕН8
Таблица 3
66330 4
Формула и зобретени я где
Составитель И. Дьяченко
Техред N. Келемеш Корректор О. Билак
Редактор Л. Новожилова
Заказ 2733/62
Тираж 512 Подписное
ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035 Москва rK-35 Рачшская наб rï r4 5
Филиал ППП Патент, r. Ужгород, ул. Проектная, 4
1. Способ получения производных бензофурана формулы I (Р и Q — - атом водорода или. низший., ветвленной цепью или вместе дополняют бензольное кольцо;
R †. атом водорода или низший алкил;
n . — целое число, равное 1, или 2, причем когда и— . целое число, равное l, то Р— бифенил, стирил, бензоксазолил, нафтооксазолил илн фенил или наф- 20 тил, неэамещенйые или за- мещейные циано-, йит„зо-, карбокси- или карбоалк-. оксигруппой,и когда пцелое число, равное 2, 25 то.D — простая связь, фенилен, бнФенилен, фурилен, стнрилен, стильбилен, нафтилен или бифе-. нилэтилиден, при условии, Я что в остатке Р имеющиеся двойные связи расйолажейй так, что они находятся в сопряжении с двойными связями одного или неСкольних бенэофурановых остатков, о т л и ч а ющ и и с. я тем, что соединение формулы II где П, Р, О, В и и имеют указанныВ выше значения, 6 — третичный алкнл,. фенил или хлорфенил, причем заместитепи в остатке D не должчы иметь водородных атомов, которые замещаются атомами металла также легко., как атомы водо-. рода в соседней с остатком Р метиленовой группе, подвергают циклизации в присутствии гидрооксила или алкоголята щелочного или щелочноземельного металла или их смеси в среде диметилформамида, дйэтилформамида, N,N-диметилацетамида или трисамида гексаметилфосфорной кислоты при
" 20-130 С.
Источники информации, принятые во внимание при экспертизе
1. К,В.T.. Nathur and Н.S. Nenza Preparation of 2-р-Nitropheng —.
benzofuran, Э.С.S. 1960, р. 1954.