1- @ -и @ -дезокси- @ -рибофуранозиды 5- триметилсилилурацила,проявляющие противовирусную активность
Иллюстрации
Показать всеРеферат
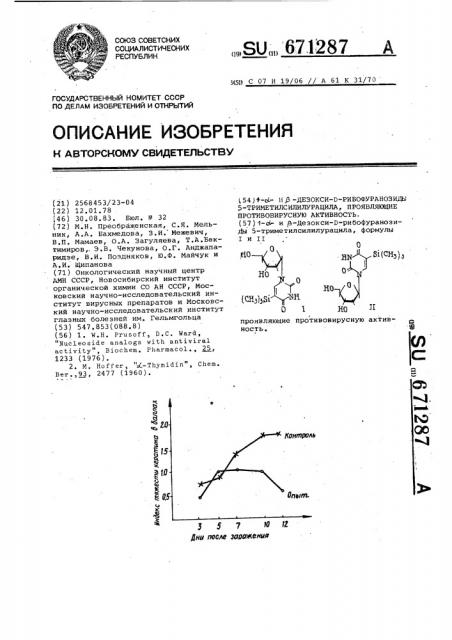
l-ct- И /а-Дезокси-в-рибофуранози- rfbj 5-триметилсилилурацила, формулыI и IIяо,0,lifi T°(СНз)з31\-'1^Н-0.Д^А^БКСНэ);«YHO^HOПпроявляквдие противовирусную актив- ^ ность.S(Л15гвконтроль^ SЮ00^Iч>&IЙ5557 H? Дни после заражения12Опыт.>&1.0-
СО103 СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ABTOPCHOMV СВИДЕТЕЛЬСТВУ
Si(CHD) э
О но
0 1 HQ и
Ь 1.5 f.0
505
3 5 7 ю 1
Дни косм заавкения
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИИ И ОТНРЫТИЙ (21) 2568453/23-04 (22) 12.01.78 (46) 30.08.83. Вюл, Р 32 (72) М.Н. Преображенская, С.Я. Мельник, A.A. Вахмедова, З.И, Межевич, В.П. Мамаев, О.A. Загуляева, Т.A.Áeêтимиров,, Э.В. Чекунова, О.Г. Анджапаридзе, В.И. Поздняков, Ю.Ф. Майчук и
А.И. Щипанова (71) Онкологический научный центр
AMH СССР, Новссибирский институт органической химии СО AH СССР, Московский научно-исследовательский институт вирусных препаратов и Московский научно-исследовательский институт глазных болезней им. Гельмгольца (53) 547.853(088.8) (56) 1. Ч.Н. Prusoff, D.Ñ. Ward., "Nucleoside analogs vith antiviral
activity", Biochem. Pharmacol., 25, 1233 (1976).
2. M. Ho ffer, " -Thymidin", Chem.
Ber.,93, 2477 (1960).
„„SU„„671 287 А
3(5В С 07 Н 19/06 // А 61 К 31/70 54)Ф-cl- И)3 -ДЕЗОКСИ-Р-РИВОФУРАНОЗИДЫ
$-ТРИМЕТИЛСИЛИЛУРАЦИЛА, ПРОЯВЛЯЮЩИЕ
ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ. (57))-с4 и р-Дезокси-D-рибофуранози4ы 5-триметилсилилурацила, формулы и II
0 проявляющие противовирусную активность
Pg 671287
Изобретение, относится к новй(а химическим соединениям 1-а - и р деэок-, .сн-D-рибофураноэидам 5-триметилсилилурацила формулы I u EI
М(СН3), НМ о
О
НО проявлякщим противовирусную BKTHB нОсть
Известно нрименение 5-иод-2 -деэОксиуридина для лечения вирусных заболеваний герпЕтической этиологии (.1 ).
Цель изобретения - новые химичес кие соединения: 1-oL- и р-деэокси-D-рнбофураноэиды 5-триметилсилилурацила, проявляющие противовирусную активность и расширяющие арсенал средств воздействия на живой организм - достигается путем синтеза данных соединений, основанного на известной реакции конденсации триметилснлильных производных урацила. с ацилгалогенозой..(".23.
Способ получения 1-0| и 6-дезокси,-О-рнбофуранозидов 5-триметилсилилурацила обычно осуществляют превращеНией 5-триметилсилилурацила в бис-О-триметилсилильное производное дейст- 35 вием гексаметилдисилазана, с последующей Конденсацией полученного бис-О-триметилсилильного производного 5-трйметилсилилурацила с 2-дезокси-3,5-ди-О-и-толуил-4-0-рибофураноэилхло- 40 ридом в присутствии SnC14 снятием защитных групп метилатом натрия и разделением изомеров тонкослойной хроматографией обычными приемами.
П p m м e p. 1-<Ь H p-дезокси-D- 45
-рибофуранозиды 5-триметилсилилурацила.
Смесь,состоящую иэ 3 r (16,3 ммоль ).
5-триметилсилилурацила, 3 мг сульфа- " та аммония и 12 мл гексаметилдисила-, ° вана, кипятят в течение 11 ч. Избыток гексаметилдисилаэана отгоняют в вакууме, остаток растворяют в 12 мл безводного дихлорэтана и прибавляют к суспензии 5 .г.-(12,9 ммоль) 2-деэокси-3,5-ди-О-п-толуил-с(-D-рибофурано.зилхлорида и 0,5 мл (4,2 ммоль) SnC14
В 12 мл безводного дихлорэтана.Реакционную массу перемешивают 4 .ч при
20-22ОС, затем промывают последовательно насыщенным раствором бикарбо- 60 ната натрия (2x5 мл) и водой. Растворитель отгоняют в вакууме, остаток . хроматографируют на пластинах (20х х20 см) с сипикагелем ЛСЛ 5-40 мкм .(Chemapo1, ЧССР) в системе хлороформ- 65 метанол (10:1), собирая фракцию с
Н 0,6. Получают 3,5 г (50,7Ъ) 2 -дезокси-3,5-ди-О-п-толуил-D-рибофуI I раноэнл-5-триметилсилилурацила. K полученному веществу прибавляют
100 мл 0,1 н раствора метилата натрия в метаноле, через 2 ч реакциойную массу нейтрализуют ионообменной смолой Дауэкс-50Wx8 (Н ) до рН 7 по универсальному индикатору, смолу отделяют, растворитель отгоняют в вакууме, остаток (2,56 г) хроматографируют на пластинах с силикагелем в системе этилацетат-метанол (9г1) при двухкратном пропускании системы растворителей через пластину.
Иэ зоны с большей подвижностью выделяют 0,87 r (44,4Ъ) 1-ф-D-дезоксирибоэида 5-.триметилсилилурацила с т. пл. 60-62 CÄ +9, 9 (с 1, спирт) .
УФ-спектр (96Ъ-йый спирт): Л „,,„„е
265 нм, Е 9060. ПМР (СР ОР, ТМС):
7,84 м.д. (Н6) 6,31 м.д. (Н Т- г
6,6 Гц), 4,42 м.д. (Нзу), 3,96 м.д. (Н,,Т < г 3, 0 Гц, Ю « 3, 3 Гц), (2Н. ), 0,21 м.д. (Me Si). найдено, Ъ: С 47,30; Н 6,59у
N 9,48; Si 8,97. с 2 н2 йгО Б1 1/3 нгО.
Вычислено, Ъ|.С 47,03; Н 6,80;
N 9,14; Si 9,17.
Йэ зоны с меньшей хроматографической подвижностью выделяют 0,79 г (40,3Ъ) 1-сФD-деэоксирибозида 5-три" мехилсилилурацила с т.пл. 64-66ОС, (о 3 + 25,7 (с 1, спирт). УФ-спектр (96Ъ-ный спирт): Л„, „с 265 нм, Е 1010.
?IMP (CD >0D, TMC): 7,95 M.Q. (H 6), 6 29 мд. (Н Ю. 281 Гц J 1 2
2,1 Гц), 4,37 м.д. (Н Эу), 4,28 м.д. (Н4е), 3,57 м.д..(2Н т), 2,7 и 2,04 м.д. (Ну и НгЪ Тгюэс б Гц, Юг 3 Гц,,УМн
15 Гц), 0,23 м.д. (Me3Si ).
Найдено, Ъ: С 46,6; Н 6,50;
N 9,47; Si 8,98.
„> HH2 0 Бх 1/3 нгО.
Вйчислейо, Ъ: С 47,03; Н 6,80;
N 9,14; Si 9,17.
Определение противовирусной активности.
Противовирусная активность ин витро 1-е(j3H -дезокси-рибофуранозидов
5-триметилсилилурацилаl определяют по следующей методике Культуры куриных фибробластов в дозе 10 мл вносят в
100-граммовые матрицы. Повицкой. Через 48 ч при образовании сплошного монослоя культуры инфицируют вирусом repпеса простого типа 1 или осповакцины с множественностью от 0,01 до 1 ЦПД О на клетку. После одночасовой инкубации монослой трижды промывают средой
199 и вносят препарат в дозах от 32 до 250 мкг/мл, матрицы помещают при
37 С на 18-20 ч. Каждую дозу препарата и каждую дозу вируса испытывают в двух матрицах. В качестве контроля
671287. Продолжение табл. 1
0,01
10 .10
250
125
Множественность инфицирования в ЦПД5о/клет ку
Доза препарата, мкг/мл
Число ЦПД „, ингибируемых препаратом
0,1
250
125
103
103
0,01
250
125
Множественность инфицирования в
ЦПД /клеткjj
Доза препарата, мкг/мп
Число ЦПД5(ю ингибируемых препаратом
102
102
125-250
250
Т а б л и ц а 1
62-125
31 не ингибирует
Лечебную эффективность oL-деэоксирибоэида ин витро определяли по следующей методике. Культуры куриных
60 фибробластов инфицируют вирусом простого герпеса с множественностью .
0,1 ЦПД на клетку. Через 4 ч инку-
- Ьации культуры трижды промывают средой
199 ивносят препарат в дозе 250 мкг/мл.
Далее опыт пРовоДят по описанной
103
125-250
250
0,1 служат: а) два матраца с клеточными культурами, инфицированными вирусом, но не обработанные препаратом, б) два матраца, в которые вносят препарат, но культуры не инфицируют вирусом (контроль токсичности препарата). Че- 5 реэ 18-20 ч после инфицирования кульУ туры просматривают под микроскопом и трижды замораживают на сухом льду.
После последнего оттаивания материал центрифугируют при 1000 об/мин в те- >Q чение 20 мин. Затем методом титрова ния на однослойных культурах куриных фибробластов определяют в надосадочной жидкости урожай вируса в опытных и контрольных культурах. Из испытуемых материалов готовят десятикратные разведения на среде 199 и вносят по
1 мл в пробирки с куриными фибробластами. Пробирки инкубируют при 37 С о в течение 5 дней и учитывают результаты по цитопатическому действию.
При описанных условиях постановки эксперимента урожай вируса герпеса в контрольных культурах составляет
10 -10 ЦПД o/ìò а вируса осповакцины — 10 о-10 6< . При,внесении эаяв25 ленных препаратов урожай вируса в зависимости от дозы препарата и инфицирующей дозы вируса снижается на
2.-5 лг ЦПД о . Препараты оказывают не только профилактическое, но и лечеб- З0 ное действие. Выраженной профилактической и лечебной эффективностью обладают дозы 62 мкг/мл и более.
Тимидин снимал ингибирующее действие описанных соединений при вне- 35 сенин в клеточные культуры в эквимолярных концентрациях, что приводило к полному восстановлению репродукции вируса герпеса.
Описанные соединения не являются токсичными для клеток, поскольку они не вызывали видимых цитопатических изменений в неинфицированных клетках при 7-дневном наблюдении. При внутриРюшинной инъекции мышам 5ðïðåïàðà 45 та составляла более 400 мг/кг веса животного
Данные о противовирусной активности заявляемых препаратов приведены в табл. 1, 2 и 3.
Ингибирующее действие 1-о -дезокси-D-рибофуранозида 5-триметилсилилурацила (о(-дезоксирибозида) на вирус герпеса при внесении в клеточные культуры через 1 ч после инфицирования.
Таблица 2 Ингибирующее действие о(-деэоксирибо1зида на вирус осповакцины при внесении в клеточные культуры через
1 ч после их заражения
Таблица 3
Ингибирующее действие 1-(5-дезоксн-D-рибофуранозида 5-триметилсилилурацила (ф-дезоксирибозида) на вирус простого герпеса при внесении в клеточные культуры через 1 ч после их заражения
671287
Редактор П, Горькова Техред В.Далекорей Корректор И. Эрдейи
Заказ 8036/2 Тираж 387 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4 вьайэ методике. Урожай вируса в, контрольных культурах составляет
101. ЦПДдд/мл, а в культурах, обработанных препаратом, он равен 1ОЗЦПДзо(мл т.е. препарат ингибировал Урожай вируса на 4 лг ЦПД,>/мл. .5
Способность тимидина снимать ингибирующее действие с -дезоксирибозида определяют по следующей методике.
Клеточные культуры заражают вырусом 10
repneca с множественностью 0,1 ЦПД50 на клетку, после одночасовой инкуба- ции монослой трижды промывают раствором Хенкса и внооят в клеточную куль" туру последовательно сС-дезоксирибоцид 5 и тимидин в эквимолярйых концентрациях (по 250 мкг/мл) ° Эквимолярные. концентрации тимидина практически полностью снимают ингибирующий эф-. фект препарата, что приводит к полному восстановлению репродукции виРУса герпеса до 10." IIII+< /мл. ,.Учитывая высокую противовирусную активность о -дезоксирибозида ин витро, была исследована его терапевтическая эффективность ин витро.при экспериментальном герептическом кератите кроликов.
Препарат применялся в виде инстилляций 6 раз в сутки водного раствора ЗО в 0,5Ъ-ной концентрации. Предвари-, тельно в течение 10 дней изучалась переносимость О, 5Ъ-ного раствора препарата тканями глаз кроликов. Токсико. аллергических осложнений не наблюдалось °
Изучение терапевтической эффективности препарата проведено на 10 кро». ликах. Из них 5 были контрольными, которыми 6 раз в сутки проводилась инстилляция дистиллированной воды., Заражение осуществляют по общепринятой методике путем скарификации роговицы и внесения в конъюктивальную полость глаз кроликов. Лечение начиналось на 5 сутки от момента заражения, когда развивалась типичная картина герпетического точечного кератита. Об эффективности препарата судили по степени снижения индекса тяжести герпетического кератита в баллах в опытной группе по сравнению с контрольной.
На чертеже представлены результаты исследования. Как видно из чертежа, уже на вторые сутки î- начала. лечения отмечается задержка процесса в опытной группе и прогрессирование в контрольной. В последующие сутки разница между леченными и контрольными глазами возрастает.
Таким образом, экспериментальные данные указывают на выраженное противовирусное действие с -и g-деэоксирибозидов, при сравнительно низкой токсичности.