Способ получения производных 6-амино-5 , 19-циклоандростана или их солей
Иллюстрации
Показать всеРеферат
ОП ИСАНИЕ
ИЗОБРЕТЕН ИЯ
К ПАТЕНТУ
68{) 652
Союз Советскни
Социалистических
Увсиублнн
/ (61) Дополнительный к патенту (22) Заявлено 270276 (21) 2326058/23-04 (23) Прио0итет — (32) (51) М. Кл.
С 07 У 1/00 //
61 К 31/56
Государственный комитет
СССР по делам наобретеннй н открытий
{Зз)— (31)—
{ЬЗ) УД,К 547 689, .6.07(088.8) Опубликовано 150879. Бюллетень № 30
Дата опубликования описания 15.08.79
Иностранцы
Пал Бите, Имре Моравчик, Инге Шзфер, дьюла Хорват, Жужанна Мехешфалви, Янош Борвендег и Илона Херманн (ВНР) (72) Авторы изобретения
Иностранное предприятие Рихтер Гедеон Ведьесети Дьяр PT (ВНР) P1) Заявитель (54 ) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ б — АМИНΠ— 5 P, .
19-ЦИКЛОАНДРОСТАНА ИЛИ ИХ СОЛЕЙ
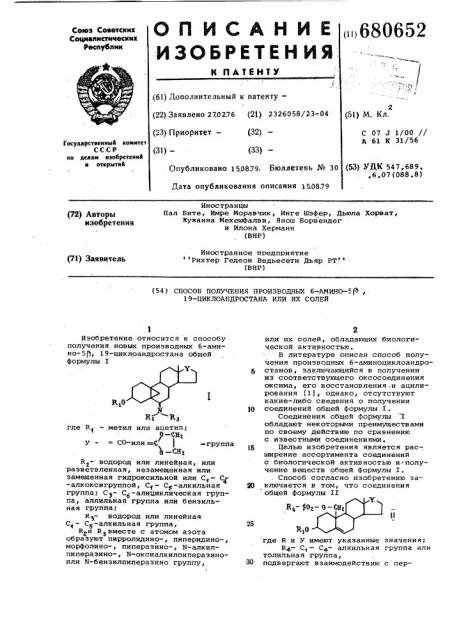
R10
Изобретение относится к способу получения новых производных б-амино-5Р, 19-циклоандростана общей формулы ( где R - метил или ацетил; р-сн у — = СО-или =Г, -группа
3 — Снт
R>- водород или линейная, или разветвленная, неэамещенная или замешенная гидроксильной или С вЂ” С
-алкоксигруппой, С - С>-алкильная группа; С3- С -алициклическая группа, аллильная группа или бензильная группа; водород или линейная
С вЂ” С -алкильная группа, В и Павместе с атомом азота образуют пирролидино-, пиперидино-, морфолино-, пипераэйно-, N-алкилпипераэино-, N-оксиалкилпипераэиноили N-бензилпипераэино группу, 2 нли их солей, обладающих биологической активностью.
В литературе описан способ получения производных 6-аминоциклоандро5 станов, заключающийся в получении из соответствующего оксосоединения оксима, его восстановления и ацилирования (1), однако, отсутствуют какие-либо сведения о получении
10 соединений общей формулы I.
Соединения общей формулы обладают некоторыми преимуществами по своему действию по сравнению с известными соединениями.
l5 . Целью изобретения является расширение ассортимента соединений с биологической активностью и-получение веществ общей формулы Х.
Способ согласно изобретению заЯ0 ключается в том, что соединения общей формулы II
R,о где R и У имеют указанные значения;
Ry- C — C4.- алкильная группа или толильная группа, З0 подвергают взаимодействию с пер680652 вичным или вторичным амином общей формулы III
III 1 ни где В и йз имеют указанные значения о при 50-180 C и мольном соотношении исходных продуктов, равном соответственно 1:2-20 в течение 1-20 ч.
Процесс проводят предпочтительно в полярном органическом растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, или алифатический С - С -спирт, при температуре предпочтительно 50-180 С, предпочтительно в течение 1-10 ч, целевые продукты выделяют известными приемами в свободном виде или виде соли.
Пример 1. Перхлорат
3 -ацетокси-б -диметиламино,-17-оксо-5 Р -циклоандростана
5,00 г (0,01 моль) ЗР -ацетокси-17-оксо-19-тозилокси- ь 5-андростена и 20 мл безводного N,N-диметилацетамида, содержащего 22 вес.% диметиламина, нагревают в запаянной о трубке до 110 С и выдерживают при этой температуре в течение 7 ч.
После нагревания содержимое запаянной трубки выливают в 400 мл ледяной Ьоды и перемешивают в течение
15 мин, Образующийся осадок отфильтровывают, промывают водой, а затем растворяют в 150 мл бензола. Бензольный раствор промывают водой, высушивают и выпаривают под вакуумом.
После растворения остатка в 20 мл безводного этанола раствор нейтрализуют этанолом,содержащим хлорную кислоту. Раствор после выдерживания в тео нение 2 ч при 0-(-5) С фильтруют, кристаллическое вещество промывают безводным этанолом и высушивают под вакуумом при 60 С. Выход 1,70 r т.пл. 200-203 С; после перекристаллизации из метанола т.пл.208-209 С .
Пример 2 ° Перхлорат 3&мзцетокси"б -диэтиламино-17-оксо-5 р --19-циклоандростана
10 г (0,02 моль) 3 р -ацетокси-17 -.оксо-19-тозилокси- ь 5-андростена и 25 мл (0,24 моль) свежеперегнанного диэтиламина нагревают в запаянной трубке до 130 С и выдерживают при этой температуре.в течение 5 ч. После охлаждения реакционную смесь выпаривают под вакуумом, остаток растирают вместе с 50 мл бензола. Образующийся осадок отфильтровывают и промывают бензолом. Объединенные фильтраты промывают водой, высушивают и выпаривают под вакуумом. Полученное вязкое масло растворяют в 20 мл безводного этанола и нейтрализуют хлорной кислотой, содержащей этанол.
После выдерживания раствора.в течение нескольких часов образующиеся кристаллы фильтруют, промывают безводным этанолом и высушивают под о вакуумом при 60. С. Продукт весит
3,20 (32%), т.пл. 181-183 С после перекристаллизации из метанола т.пл. 184-185 С.
Пример 3. Перхлорат ЗВ—
-ацетокси-6 б -пиперидино-17-оксо-5 Р, 19-циклоандростана
А. 20 г (0,04 моль) 3 Р -ацетокси10 -17-оксо-19-тозилокси- А 5-андростена растворяют при нагревании в 20 мл (0,2 моль) свежеперегнанного пиперидина, затем реакционную смесь кипятят с обратным холодильником в, 15,течение 5 ч на масляной бане при
I150 С. После охлаждения избыток
1 пиперидина отгоняют под вакуумом и остаток от выпаривания растирают вместе с 50 мл бензола. Выпадающую в осадок пиперидиновую,соль отфильтровывают и промывают (2x10 мл) бензолоМ. Следы пиперидина удаляют из фильтрата встряхиванием его c г водой. Бензольную фазу высушивают
25 сульфатом натрия, затем выпаривают под вакуумом. Полученное вязкое масло растворяют в 20 мл безводного этанола, а раствор нейтрализуют хлорной кислотой, содержащей этанол.
После выдерживания раствора в течение 2 ч образующиеся кристаллы отфильтровывают и промывают некоторым количеством безводного этанола.
После высушивания продукта в вакууме о при 60 С выход 10,5 г (51%),т.пл.
35 206-210 С,после перекристаллизации из метанола т.пл. 214-216 С.
Т пл. малеината 202-205 С (из этанола).
Б. 20 г (0,04 моль) Зр-ацетокси-17-оксо-19-тозилокси- h5-андростена растворяют в 200 мл безводного диметилформамида и добавляют 12 мл .(0,12 моль) свежеперегнанного, пиперидина. После нагревания реак45 ционной смеси до 100 С ее выдерживают при этой температуре в течение 10 ч, затем выпаривают досуха в вакууме. Далее поступают согласно методике A. Продукт идентичен про5р дукту из метода А, выход 41Â.
В. 20 г (0,04 моль) 3 -ацетокси-17-оксо-19-тоэилокси- Ь 5-андростена растворяют в 80 мл безводного изопропанола, затем добавляют 12 мл (О,I2 моль) свежеперегнанного пиперидина. После кипячения с обрат. ным холодильником в течение 3 ч реакционную смесь охлаждают и выпаривают досуха под вакуумом. Далее поступают согласно методике A. .Продукт идентичен с продуктом метода А, выход 40%.
Пример 4. Хлоргидрат 313-ацетокси-б-((N-метилпипераэино)—
65 -17-оксо-5р -19-циклоандростена.
680652
Исходя из 20 r (0,04 моль) 3p—
- ацетокси-17-оксо-19-тозилокси- а5-андростена и 20 мл N-метилпиперазина, реакцию проводят точно так же, как это представлено в методе А примера 3, однако продукт выделяет в виде хлоргидрата. Выход 9,00 г (48%), т.пл. 213-215 С.
Пример 5. Перхлорат ЗР— †.ацетокси-6 -морфолино-17-оксо-5P -19-циклоандростана
Исходя из 20 г (0,047 моль)
3 Р --ацетокси-17-оксо-19-мезилокси-А5-андростена и 20 ют (0,23 моль) свежеперегнанного морфолина, проводят реакцйю так же, как это представлено в методе A примера 3 и получают продукт с выходом 11 80 r о
Т (49%), т.пл. 202-204 С, после перекристаллизации из смеси метанола .и воды т.пл. 207-208 С, т.пл. хлоргидрата 214-217 С (из этанола) .
Пример 6. Хлоргидрат 3 ) —
-ацетокси-6 ф -трет.бутиламино-17-оксо-5 -19-циклоандростана.
10 г (0,02 моль) 3)ацетокси-17-оксо-19-тозилокси- ь 5-андростена и 22 мл (0,21 моль) свежеперегнанного трет бутиламина нагревают в запаянной трубке до 150 С и выдерживают при этой температуре в течение 5 ч, Затем реакционную смесь обрабатывают так же, как это описано в примере 2, однако с тем отличием, что остаток, полученный после выпаривания досуха бензольного Раствора, растворяют в безводном эфире и хлоргидрат получают с помощью безводного эфира, насыщенного сухим газообразным водородом. Выход 3,9 г(45%),т.пл. 207-208 С, после перекристаллизации из безводного этанола т.пл. 208-210 С.
II р и м е р 7. Хлоргидрат 3 p—
-ацетокси-6 -бензиламино-17-этилендиокси-5(, 19-циклоандростана
1,00 г (1,84 ммоль)3 р -ацетокси-17-этилендиокси-19-тозилокси- а5-адростена растворяют в 3,00 MR
N,N-диметилацетамида и 1,00 мл (9,10 ммоль) свежеперегнанного бензиламина путем нагревания, затем реакционную смесь нагревают до
О
110 С и выдерживают при этой температуре в течение 3,5 ч. После охлаждения гомогенный раствор приливают медленно при непрерывном перемещивании к 150 мл ледяной воды, затем осадок, образующийся после перемешиэания в течение 15 мин отфильтровывают, растворяют в 60 мл бензола и промйвают водой, После высушивания раствор выпаривают в вакууме, остаток. растворяют в 15 мл безводного этанола, нейтрализуют этанолом, насыщенным сухим газообразным хлористым водородом, и выпаривают досуха в вакууме при температуре не выае 50 С . Полученное вязкое масло становится кристаллическим при растирании вместе с небольшим количеством ацетона. Крис. таллы фильтруют, проьывают ацетоном и высу"тивают в вакууме при 60 С получая при этом 0,45 r (44%) продукта, т ° пл. 234-236 С, после пере5 кристаллизации из метанола, т.пл.
239-241 С.
Пр и м е р 8. Хлоргидрат 3 p—
-ацетокси-6 ф -циклогексиламино-17-этилендиокси-5 19-циклoaндрoстаI0 На.
1,00 г {1,84 ммоль) Зр -ацетокси-17-этилендиокси-19-тозилокси- Ь 5андростена растворяют при нагревании в 3,00 мл Н,N-диметилацетамида и 1„00 мл (8,74 ммоль) свежеперегнанного циклогексиламина. Реакционную смесь нагревают до 110 С и выдерживают.при этой температуре . в течение 2,5 ч.
20 В последу щем реакционную смесь обрабатывают так же, как и в примере 8. Выход 0,50 r (50%), т.пл. 218-220 С, после перекристаллизации из смеси ацетона и гексана т.пл. 224-227 С.
Пример 9. Хлоргидрат 3 Р—
-ацетокси-17-этилендиокси-6 ф -цикло-, пропиламино-5 р -19-циклоандростана
10 r {18,4 мчаль) 3 Р-ацетокси-17-этилендиокси-19-тозилокси- 6 530 -андростена и 6,4 мл (92 ммоль) свежеперегнанного циклопропиламина растворяют при слабом нагревании в 50 мл N,N -диметилацетамида. Полученный раствор подогревают до 95 С
35 и выдерживают при этой температуре в течение 5 ч. После охлаждения раствор медленно приливают при постоянном перемешивании к 1 л ледяной воды. Выделяющийся осадок быст40 Ро отфильтровывают,проля1вают водой и растворяют в 150 мл бензола. Бейзольный раствор промывают водой, высушивают сульфатом натрия и выпаривают досуха под вакуумом. Остаток от перегонки растворяют в 30 мл эфира и нейтрализуют эфиром, насыщенным сухим газообразньж хлористым водородом. Выпадакиций осадок отфильтровывают, промывают эфиром, петролейным эфиром и высушивают под инфракрасным облучением. Полученный таким образом неочищенный продукт (4,80 г) суспендируют в бензоле, фильтруют, промывают смесью 1:1 из бензола и петролейного эфира и высу55 шивают при 60©С в вакууме. Выход
3,80 г (44%), т.пл. 212-214 С,после перекристаллизации иэ изопропанола т.пл» -218-220 С.
Пример 10. Хлоргидрат 3p—
-ацетокси-6ф †(2-оксиэтиламино)-17-этилендиокси-5 Р-19-циклоандростана
1,00 г (1,84 ммоль) 3 ф -ацетокси-17-этилендиокси-19-тозилокси- 4 5-андростена растворяют путем нагре65 вания в 5 мл N N-диметилацетамида и 0,5 мл (8,40 ммоль) свежеперегнан7 68
1 ного 2-оксиэтиламина. Реакционную о смесь нагревают до 110 С и выдерживают при этой температуре в течение
5 ч. После охлаждения раствор медленно приливают при непрерывном перемешивании к 50 мл 26%-ного водного раствора хлористого натрия и перемешивают в течение 15 мин. Образующийся осадок фильтруют и растворяют в 30 мл бензола. Бензольный раствор промывают насыщенным водным раствором хлористого натрия, высушивают сульфатом натрия и выпаривают досуха в вакууме. Остаток растворяют в 10 мл безводного этанола и нейтрализуют этанолом, насыщенным сухим газообразным хлористым нодородом. Нейтральный раствор выпаривают досуха в вакууме и остаток растирают вместе с эцетоном, Образующиеся кристаллы фильтруют, проььпзают ацетоном и высушинают в вакууме при 60ОС, получая .при этом 0,35 г (40%) продукта с о т.пл. 119-202 С, после перекристаллизации из ацетона, т.пл. 203-206 С .
Пример 11. Хлоргидрат 3 P—
-ацетокси-17-оксо-6 (--аллиламино-5P, 19-циклоандростана.
5,44 г (0,01 моль) 3 -ацетокси-17-этилендиокси-19-тозилокси- А5-андростена и 3 мл (0„04 моль) свежеперегнанного аллиламина растворяют при слабом нагревании н 20 мл безводного N,N-диметилацетамида. Температуру раствора повышают до 110 С и выдерживают при этой температуре в течение 2,5 ч. После этого реакционную смесь охлаждают до комнатной температуры и прилинают по каплям 200 мл леДяной воды при энергичном перемешивании. Выпадающий осадок быстро отфильтровывают, а затем растворяют бензолом прямо на Фильтре.
Бензольный раствор промывают нодой, высушивают сульфатом натрия и выпаривают под вакуумом. Остаток растворяют н бензнодном этаноле. рН растнора доводят да величины 4 с помощью этанола, насыщенного сухим газообразным хлористым водородом, и раствор оставляют стоять в течение ночи при комнатной температуре.
После этого его выпаривают досуха о при,á0 С н вакууме. Остаток янляется вязким маслом, который становится твердым при растирании вместе с эфиром. Неочищенный продукт от-Фильтруют, промывают эфиром и высушивают под инфракрасным излучением.
Выход 2,00 r (47,5Ъ), т.пл. 208211 С, после перекристаллизации из изопропанола т.пл. 215-216 С.
Пример 12. Хлоргидрат 3p—
-ацетокси-17-оксо-6 g -пиперидино-5Р
19-циклоандростана.
5 г (0,013 моль) 3 Р -метокси-17-оксо-19-мезилокси- ь 5-андростена растворяют чрев слабом нагревании в 15 мл безводного N,N-диметилацет0652
60 бб
l0
8 амида и 5,2 мл ((},052 моль) свежеперегнанного пиперидина. Реакционную смесь нагревают до 110 С и выдерживают при этой температуре в течение 4 ч. После охлаждения раствор медленно приливают при постоянном перемешивании к 500 мл ледяной воды. После перемешивания в течение 10 мин выделяющийся осадок отфильтровывают и растворяют
° °
100 мл бензола. Бенэольный растор промывают водой, высушивают ульфатом натрия и выпаривают в вакууме. Остаток растворяют в 20 мл безводного этанола и нейтрализуют этанолом, насыщенным сухим газообразным хлористым водородом. Нейтральный раствор ныпаривают досуха в вакууме и остаток растирают вмес" те с бензолом. Затвердевший продукт промывают некоторым количеством бензола и после этого смесью из ацетона и петролейного эфира (1:1), затем нысушинают н вакуум-эксикаторе
При 60 С. Выход 2,70 r (51%), т.пл.
217-220 С, после.перекристаллизации из изопропанола т.пл. 222-224 С.
Пример 13. 3 р-Ацетокси-6};.-амино-17-этилендиокси-5Р 19-циклоандростангидрохлорид.
5,0 г (9,1 ммоль) З Ь -ацетокси-17-этилендиокси-19-тозилокси- h 5-андростена и 20 мл безводного
N,N-диметилацетамида, который содержит 25 вес.Ъ аммиака, нагревают в тугопланкой трубке до 110 С и выдерживают в течения 4 ч при этой температуре. После охлаждения тугоплавкую трубку вскрывают и испаряют большую часть непрореагировавшего аммиака. Оставшийся раствор выливают в 400 мл ледяной воды. Выпавший осадок отфильтровывают, промывают водой, и затем растворяют в
150 мл бензола. Бензольный раствор промывают водой, высушивают и ныпаринают н вакууме. Остаток растворяют в 20 мл безводного этанола, нейтрализуют с помощью этанола, насыщенного сухим газообразным хлористым водородом, и выпаривают в вакууме.
Получают аморфное вещество, которое перекристаллизуют из изопропанола.
Выход .1, 70 г (43Ъ), т.пл. 189-192 С.
Пример 14. З Ь-Ацетокси-б ф—
-пирролидино-17-оксо-5р, 19-циклоандростан НС1О, .
5,0 г. (0,01 моль) 3)Ь-ацетокси-17-оксо-19-тозилокси- 6.5-андростена растворяют в I5 мл безводного N N— р1иметилацетамида и 3 мл (0,04 моль) снежеперегнанного пирролидина при нагревании. Реакционную смесь нагревают до 100 С и выдерживают при этой температуре в течение 4 ч. После охлаждения раствор при постоянном перемешивании медленно вылинают н 250 мл ледяной воды. Выпавший осадок отфильтровывают и растворяют
680652
10 в 100 мл бензола. Бензольный раствор промывают водой, высушивают и выпаривают в вакууме. Остаток растворяют в 10 мл безводного этанола и раствор нейтрализуют этанольным раствором хлорной кислоты. Выделившиеся кристаллы отфильтровывают и промывают небольшим количеством безводного этанола. После высушивавания в вакууме при 60 С получают
5,35 r (44,5Ъ) продукта, т.пл. 226228 С, после перекристаллизации из метанола, т.пл. 229- 231 С . Гидроо хлорид - т.пл. 244-247 С (из изопропанола) .
Пример 15. З Ь-Ацетокси-6 —
-N- (2-оксиэтил) -пиперазино-17-оксо-5P> 19-циклоандростан-гидрохлорид.
Следуют методике примера 14 с тем отличием, что используют в качестве исходных веществ 5,0 г (0,01 моль) 3)Ъ-ацетокси-17-оксо-19-тозилокси- Ь 5-антростена и 5 мл (0,04 моль) 4-(2-оксиэтил)-пиперазина и продукт выделяют в виде солянокислой соли. Выход 2,1 г (42,5Ъ), т.пл. 196-198 С.
После перекристаллизации из изопропанола т.пл. 203-205 С.
Пример 1бъ. Зр-Ацетокси-б —
-N-бензилпиперазино-17-оксо-5p
19-циклоандростан-гидрохлорид.
Следуют методике примера 14 с тем отличием, что в качестве исходньж соединений используют 5,0 r (0,01 моль) Зр-ацетокси-17-оксо-19-тозилокси- 5-андростена и 5,2 мп (0,03 моль) -И-бензилпиперазина и продукт выделяют в виде его солянокислой соли.
Выход 2,40 г (44,5%),т.пл. 222224 С. Перекристаллизовывают иэ изопропанола, т.пл. 226-229 С.
Пример 17 ° 3 -Ацетокси-6(-изопропиламино-17-оксо-5 ), 19-циклоандростан-гидрохлорид.
Следуют методике предыдущего примера 16 с тем отличием, что в качестве исходных соединений используют 5,0 г (9,2 ммоль) 3 ацетокси-l7-этилендиокси-19-тозилокси-А5-адростена и 16 мл (184 моль) изопропиламина и продукт получают в виде его солянокислой соли в безводном этаноле с помощью этанола, насыщенного сухим газообразным хлористым водородом, при рН 4. Выход
1,7 r (43,5%), т.пл. 200-202 С .
После перекристаллизации из смеси ацетона с гексаном т.пл. 203-205 С °
Пример 18. Зfb -1щетокси-б ф †(2-метоксиэтил)-амино-17-оксо19-циклоандростан-гидрохлорид .
Следуют методике примера 11 с тем отличием, что в качестве исходных веществ используют 1,00 Г (1,84 ммоль)
3 р -ацетокси-17-этилендиокси-19-тозилокси- а5-андростена и 0,7 мл (6,60 ммоль) 2-метоксиэтиламииа.
Выход 0,43 r (53%), т.пл. 218-222 С.
После перекристаллизации из изопропанола т.пл. 226-227 С.
П Г и м е р 19. ЗР -Метокси-б ) -амино-17-оксо-5 р, 19-циклоандростан-гидрохлорид.
5 Следуют методике примера 13 с тем отличием, что в качестве исходных веществ применяют 5,0 г((0,01 моль)
3 р-ацетокси-17-этилендиокси-19-мезилокси- Ь 5-андростена и 20 мл
)p безводного N,N-диметилацетамида, который содержит 25 вес.t аммиака, j солянокислая соль образуется при значении рН 4. Выход 1,70 r (48%), т.пл. 162-165-С.
После перекристаллизации из иэопропанола т.пл. 164-166 С.
Пример 20. Зр -Метокси-бф - .
-диэтиламино-17-оксо-5 р 19-циклоандростан-гидрохлоридСледуют методике примера 12 с тем отличием, что в качестве исходных веществ применяют 5,0 г (0,01 ммоль)
ЗР -метокси-17-оксо-19-мезилоксиА5-андростена и 5,3 мп (0,05 моль) диэтиламина.
Выход 2,80 г (52,5Ъ), т.пл. 184186 С. После перекристаллизации из смеси ацетона с гексаном т.пл.
186-188 С .
Пример 21. 3 р -Метокси-б — оО -бензиламино-17-этилендиокси-5 pi, 19-циклоандростан-гидрохлорид.
Следуют методике примера 12 с тем отличием, что в качестве исходных веществ используют 5,0 г
35 (0,01 моль) ЗfP -метокси-17-этилендикоси-19-меэилокЛ - а5-андростена и 5 мл (0,04 моль) бензиламина и продукт выделяют из этанола.
Выход 2,95 г (54,6Ъ), т.пл,216-218 C ..
40 После перекристаллизации из этанола т.пл. 222-224 С.
Формула изобретения
1. Способ получения производных б-амино-5, 19-циклоандростана общей формулы Т
Нг Нз где R4 — .метил или ацетил; о — сн
У= =СО- или C — гРУппа;
Ь - eHff
R2- водород или линейная, или разветвленная, незамещеннля или замешенная гидроксильной или С„ — C4-алкоксигруппой, С4 — С-алкильиал группа; С>- С -алициклическая "рупца, 680652 12 ным или вторичным амином общей формулы III p
1 К 3
К1О
Составитель A ..Анисимов
Редактор Т.Девятко ТехредИ.АсталошКорректор В.Бутяга
Заказ 4669/58 Тираж 513 Подписное
ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., 4/5
Филиал 11ПП Патент, г.ужгород, ул. Проектная, 4 аллильная группа или бензильная группа;
R — водород или линейная С - С
-алкильная группа, R è R3 вместе с атомом азота обра эуют пирролидино-, пиперидино-, морфолино-, пиперазино- r К-алкйлпипера зино-, М-оксиалкилпиперазино или
N-бензилпиперазиногруппу, или их
Ьолей, отличающийся тем, что, стероид общей формулы П где R< и У имеют указанные значения
R4- С вЂ” C4-алкильная группа или толильная группа, подвергают взаимодействию с первичгде R u R имеют указанные значе3 ния, 2 3 при 50-180 С и мольном соотношении сходных продуктов, равном соотетственно 1:2-20, с последующим выделением целевого продукта в своl0 бодном виде или в виде соли.
2 ° Способ по п.l, о т л и ч а юшийся тем, что процесс проводят в полярном органическом растворителе,. таком как N,И-диметилформЫ амид, N,N-диметилацетамид или алифатический С - С -спирт.
Источники ийформации, принятые во внимание при экспертизе
1. Патент США 93189606, 20 кл. 260-239.55, опублик. 15.06.65 °