Инсектицидное средство
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистииеских
Республик
ОП ИСАНИЕ
ИЗОБРЕТЕ Н ИЯ
К ПАТЕНТУ п>686594 (61) Дополнительный к патенту (22) Заявлено 17 04 74 (21) 2017872/30-05
18.04.73 (23) ПРиоРитет (32)18.03,74
5635/73
{31) 3705/74 (33) Швейцария (51) М. Кл.
А 01 N 9/24
С 07 С 43/20
Государственаь1й кемвтет
СССР оо делам кзобретенай и открытий (53) УДК 632.951. .2 (088.8) Опубликовано 15.09.79 Бюллетень pgq 34
Дата опубликования описания 15.09.79
Иностранец
Фридрих Каррер (Швейцария) (72) Автор изобретения
Иностранная фирма
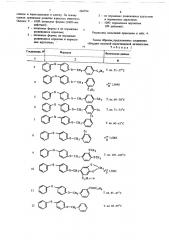
"Циба-Гейги АГ (Швейцария) (71) Заявитель (54) ИНСЕКТИЦИДНОЕ СРЕДСТВО где Z — кислород, NH;
R1 — груттпы о г сн,, О
1О на.
К 2 (Т)
Z — СН вЂ” R2 е
Изобретение относится к химическим средствам борьбы с вредителями сельского хозяйства, а именно к использованию инсектнцидного средства на основе производных дифенилового эфира.
Известен дифенилбензиловый эфир, обладающий инсектицидной активностью (1). Более близким по химической структуре к предлагаемым соединениям является п — феноксидифени ловьтй эфир, обладающий инсектицидной активностью (2). Однако активность его недостаточС целью изыскания новых инсектицидных средств, обладающих высокой инсектицидной активностью, изобретение предусматривает использование соединений общей формулы 2 где R> — водород, галоген, С1 — C3-алкил, метоксил,пропаргилоксил,ацетил,этилоксикарбонил;
R< — водород, метоксил, метил;
R 7 — водород, н-пропил;
Rz — водород, метил или этил; йз- водород, метил;
R — водород, метил, нитрогруппа в количестве 0,1-95 вес.%.
Соединения формулы f можно получить алкилированием 4-феноксифенола илн 4- фенокснфенолята илн 4-феноксианнлина с галогенидом в присутствии основания или связывающе-. го кислоту средства.
686594
В качестве акцепторов кислот или оснований применяют, например, третичные амины, такие как триалкнламнны, пиридин, гидрооксил, алкоголяты и карбонаты щелочных и щелочноземельных металлов. 5
Реакцию проводят при температуре 10-130 С, преимущественно 10-80 С, при нормальном давлении и в присутствии растворителей или разбавителей, В качестве растворителей или разбавителей подходят, например, простые эфиры, такие, как диэтиловый, диизопропиловый эфир, 1,2- днмет окснэтандиоксан,тетрагидрофуран; N,N-диалкнлированные амиды карбоновой кислоты, например, диметилформамид; алифатические и ароматические углеводороды, в особенности бенэол, толуол, ксилолы или этилбензол, диметилсульфоксид; кетоиы, например ацетон, метилэтилкетон или циклогексанон и триамид гексаметилфосфорной кислоты.
Пример 1. Получение 1-фенокси-4I ( (3 4- метилендиокси) - бенэилоксибензол а.
К раствору 18,6 г 4-оксидифениловою эфира в 100 мл безводного ацетона прибавляют 18 г тонкораспыленного, безводного карбоната калия и нагревают смесь до температуры дефлегмацин . ацетона. После 30 мин прибавляют по каплям в течение 1 ч раствор 17,1 г 3,4-метилендиоксихлорметилбензола в 100 мл толуола и затем реакционную смесь выдерживают в течение 18 ч при дефлегмации. После этого реакционный раствор отфильтровывают от осадка и фильтрат полностью освобождают в вакууме от растворителя. Остаток растворяют в сложном этиловом эфире уксусной кислотй — толуоле, приблизительно 1:1, раствор несколько раз промывают очень холодным 10%-ным раствором едкого калия, затем водой и насыщенным раствором хлористого натрия до нейтрального состояния.
После высушивания органической фазы сульфа- 4О том натрия растворитель полностью удаляют в вакууме и затвердевший кристаллический остаток два раза перекристаллизовывают в ацетонит( риле, причем получают 1-фенокси-4-(3 4-метилендиокси) -бензилоксибензол с т.пл. 90-91 С. 45
Пример 2. Получение 2-фенокси-й(3,4-метилендиоксибензол) -анилина.
Раствор 47,6 г 4-фенокси- (3,4-метилендиокси- gp бензилиден)-анилина в 500 мл чистого метанола и 450 мл метилцеллоэольва каталитнчески гидрируют после прибавления 3 г окиси платины при 20-30 С до поглощения 3,36 л водорода.
Катализатор отфильтровывают и фильтрат освобождают в вакууме от растворителей. Остаток хроматографически очищают на силикагеле (элюент:эфир-гексан 1:1) и полученный таким образом чистый 4-фенил-N- (3,4-метилендиокси4 бензил) -анилнн перекристаллизовывают в эфире-гексане (т.пл. 95-96 С) .
Применяемый для каталитического гидрирования исходный материал, 4-фенокси- (3,4-метилендиоксибензилиден)-анилин, получают следующим образом.
Раствор 75 г 3,4-метилендиоксибенэальдегид (пиперональ) и 92,5 г 4-аминодифенилового эфира в 500 мл бенэола выдерживают в течение 8 ч с выделением воды при условиях дефлегмации.
После того, как вода полностью выделена, реакционную смесь концентрируют, выпавший после охлаждения до приблизительно +5 С кристаллиэат промывают на нутче,, кристаллическую массу перекристаллизовывают один раз в сухом бензоле, а затем в ацетонитриле, причем получают чистый 4- фенокси- (3,4- метилендиоксибенэил.иден)-анилин т.йл. 89-91 С, о
Аналогичным образом, как описано выше, получают соединения, приведенные в табл. 1, Формы применения препаратов обычные.
Содержание действующего начала в средстве
0,1-95 вес.%.
Пример 1. Контактное действие на личинки dysdarcus fasciatus.
Определенное количество 0,1 o-ного раствора действующего начала в ацетоне, соответствующее
10 мг действующего начала на м, равномерно при помощи пипетки распределяли в алюминиевой миске. После испарения ацетона на обработанную поверхность миски, наполненную кормом и влажной ватой, раскладывали 10 личинок Oysdercus fasciatus в пятой стадии. Затем миску накрывали ситчатой крышкой.
Приблизительно через 10 дней, т.е. непосредственно после адультной линьки контрольных насекомых исследовали испытуемых насекомых и подсчитывали число нормально развитых адульт ных форм. Результаты приведены в табл. 2.
Обозначения. — 100% летальная особая форма, т.е. насекомые, погибшие после линьки и особые личинки;
4 — летальная особая форма и не летальная особая форма (адультоиды);
3 — летальная особая форма, не летальная особая форма и нормальные адультные;
1 — 100% нормальные адультные.
П р им ер 2. Контактное действие на куколки Tenebrio monitor.
Определенное количество 0,1%-ного раствора дей твующего начала в ацетоне, соответствующее
10 мг действующего начала на 1 м, равномерно распределяли а алюминиевой миске при помощи пипетки. После испарения ацетона на обработанную поверхность миски положили 10 свежеоблу5 686594 лившихся куколок tenebrio monitor. Миску покрывали ситчатой крышкой.
После вылупливания из кокона контрольных насекомых имаго исследовали насекомых, подсчитывая число нормальных адультных форм.
Результаты приведены в табл. 2.
Пример 3. Действие на личинки Aedes
aedypti.
В стакан, наполненный 150 мл воды, наносили пипеткой такое количество 0,1%-ного аце- 1о тонного раствора соответствующих действующих начал, чтобы концентрация действующего начала достигала 10 ч/млн. и 5 ч/млн, После испарения ацетона в каждый наполненный действующим началом стакан помещали от 30 до 40 l5 двухдневных личинок Aedes aedypti. В стак".н добавляли размолотый корм и накрывали стакан медной сеткой.
Через 1,2 и 5 дней проверяли возможное умерщвление. Затем подсчитывали повреждения при окукливании, превращении и линьке в аддультную стадию. Результаты испытаний на инсектицидную активность приведены в табл. 2.
Было проведено сравнение инсектицидного действия предложенных соединений с извест-2>
НЫМИ.
В качестве известных соединений испольэовали:
О
О
С1 С1
ei (W) 40
Контактное деиствие на личинки disdercus
fasciatus проверяли аналогично примеру 1, контактное действие на куколок tenebrio пю г)тог — аиалогично примеру 2.
Пример 4. Действие на Spodoptera lit—
5S
toralis (яйца).
Яйца Spodoptera littoralis погружали в
0,05 o-ный раствор действующего вещества в аиеб тонно-водной смеси. Обработанные таким образом яйца вынимали иэ этой смеси и укладывали в пластмассовую миску при 21 С и 60%-ной относительной влажности.
Через 3-4 дня подсчитывали количество личинок, развившихся из обработанных яиц:
100%-ное действие — нет развившихся личинок;
0%-ное действие — более чем нз 10% обработанных яиц развились личинки.
Пример 5. Действие на личинки Aedes
aedypt i.
На поверхность воды, находящейся в стакане на 150 мл,распределяли такое количество 0,1%-ного ацетонного раствора действующей субстанции, чтобы концентрация действующего вещества достигла 0,5 и 1 ч/млн. После испарения ацетона в каждый стакан с действующим веществом помещали 30-40 двухдневных личинок Aedes aedypti. На каждую концентрацию действующего вещества использовали по два стакана. В стакан добавляли размолотый корм и закрывали медной сеткой.
Через 1,2 и 5 дней проверяли возможное умерщвление. Затем оценивали нарушения при окукливании, превращении и линьке личинок в аддультную стадию.
Пример 6. Действие против Tribo(ium
castaneum.
Пшеничную муку смешивали с таким количеством 5%-ного пылеобразного действующего вещества, чтобы концентрация действующего начала в муке составляла 100 ч/млн.
25 r муки, содержащей действующее начало, насыпали в стакан и затем в него помещали 25 жучков, Через 3 дня жучков отсеивали.
Те яйца, которые за это время отложили жучки, образовали заражающий материал. В течение 8 недель устанавливали процесс образования из янц популяции и подсчитывали число нормально развившихся жучков.
Результаты испытаний приведены в таблице 3.
Пример 7. Действие против личинок
Spodoptera Pittora1is.
К смеси иэ воды и ацетона лрнбавляют такое количество 1 ного ацетонового раствора, чтобы получилась концентрация действующего начала 0,075 sec.%. Затем листья кочанного салата погружали в эту, содержащую действую цее начало, ацетоно-водную смесь и высушивали, развешивая их потом на воздухе. В две большие, закрытые марлей миски, выложенные фнльтровальной бумагой, содержащие листья салата, обработанные действующим началом, помещыи по 10 личинок Spodoptera 3-4 стадии.
Незадолго до их вылулливагп1я из кокона под фильтровальную бумагу в миски насыпали сте-. рильные древесныс опилки. Куколок удаляли иэ
686594
0 — Снг п 1,5840
2на
0 — Сн, СН, 0 СНг С1
Т. пл. 69 — 70 С
Т. пл. 71-72 С
Т. пл.60 — 61 С о-сн
8 и о 1 6003
0 — СНг
0-Снг
СНг
0 и 1,5801
0-Снг аоСгн, Т. пл. 45 — 47 С
0-
Т. пл. 68-69 С о-Сн
12 опилок и перекладывали в клетку. 3а основу оценок принимали развитие взрослых животных.
Оценка: 9 — 100% летальные формы (100%-ное действие);
7 — летальные формы и не нормально развившиеся взрослые;
5 — летальные формы, не нормально развившиеся взрослые и нормальные адультные;
3 — не нормально развившиеся адультные и нормальные адультные;
1 — 100% нормальные адультные (0% действие) .
Результаты испытаний приведены в табл. 4.
Таким образом, предложенные соединения обладают высокой инсектицидной активностью. о Таблица 1 аСн
Т. пл. 107 — 109 C
ОСН
686594
Продолжение табл. 1 а-СН, Т пл 74 75 С
0- gH / 3 В1 T. ï . 81 — 83 С
1 С
О СН3 СОСН3
Т. пл,90-91 С
0- Н C ÍóIï) Т. пл.бб — 67 С
17 бн, 0 — СНт С1
Т, пл. 45-56 С
Щ Т. пл. 59-60 С
Π— СНр 0-СН С:-М Т, пл 92 93 С
0
0 .г Н2
С н
0 — СН п о 1 5858
22
Сн
О-СН ОСН, СНа
Π— М.. СН
1, п о 1,5778
24 о
0 Н2Т. пл. 142 — 144 С
0 — СН
МОю
686594
10
13
18
21
22
24
Испытуемые соединения
Таблица 2
Инсекпщидное действие р 1 пример 2 прим
686594
14
Таблица 3
Действие, %
Соединение,N пример 1 пример 2 ример Ь име (% снижения ерт (% летальных и анормальных особых фор аэвития
Maroon концнтрация ействуощсго начала
10 мг/м 10 мг/м 1 мг/м 0,5 Mr/м 0,05 вес.% 1 ч/милл 0,5 ч/мил 100 q/милл
100
100
100
100
100 100
15 0
100
35
65
75
70
Табл ица 4
Инее ктицидное действие
Испытуемые соединения тест Ж
23
25 где 2 — кислород или ЙН;
R> — группа
Формула изобретения а .
СК2, 0 в Ю ъ, г — Сн — 3,, Инсектицидное средство, содержащее -действующее начало на основе производных днфениловых эфиров и добавки, выбранной иэ группы носитель, раэбавитель, наполнитель, о т л ич а ю щ е е с я тем, что, с целью усиления инсектицидного действия, оно содержит в качестве производного дифенилового эфира соединение общей формулы ь
100 100 !
М 100
100 0 Б где R — водород, галоген, С вЂ” C3-алкил, мстоксил,пропаргнлоксил, ацетил или этилОксикарбонил;
R — водород или мстоксил, мстил;
Й7 водород или н пролил
Йэ — водород, метил или этил;!
5 86594
R3 водород или метил и
R4 — водород, метил или ннтрогруппа в ко личестве 0,1-95 вес.%.
Приоритет по признакам:
18.04.73 при Z — кислород, NH, о ксив,пропаргнлокснл,этилоксикарбо ннл, ацетил;
Р,— водород, метоксил, метил;
R 7 водород или н IlpoflHJI
5 R -водород, метил или этил;
R> и Я вЂ” водород или метил.
18.0Х74 прн R4 — нитрогруппа.
Источники информапии, принятые во внимаа . ние при экспертизе
1. Патент США N 2159025, кл. 260-612, опублик. 1939.
2. Патент США М 2347393, кл. 424-337 опублик, 1944. где R — водоРод, галоген, С, — С,-алкил, мог
Заказ 5371/55 Тираж 755 Подписное
ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4
Составитель Н.Кибалова
Редактор Л. Новожилова Техред М.Петко Корректор С. Шек мар