Способ получения производных 6,7диметокси-1,2,3,4- тетрагидро-1-изохинолин-ацетамида или их солей
Иллюстрации
Показать всеРеферат
1ан
Вв
П ИСАЙ
Союз Советских
Социалистических
Республик
К ПАТЕНТУ (6l ) Дополнительный к патенту (22) Заявлено 27.1277 (21) 2557602/23-04 (23) Приоритет — (32) 30.12. 76 (51) М. Кл.
С 07 0 217/06
A 61 К 31/47 (53) УДК 547.831 ° ,7 ° 07 . (088 ° 8) (33) BHP (31) CX 1711
Государственный комитет
СССР по делам изобретений и открытий
Опубликовано051079, Бюллетень ¹ 37
Дата опубликования описания 051079
Иностранцы
Габор Бернат, Ене Кобор, Золтан Эчери, Эмиль Минкер и Матиаш Колтаи (BHP) (72) Авторы изобретения
Иностранное предприятие Хиноин Дьедьсер еш Ведьесети Термекек Дьяра РТ (ВНР) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 6 т 7-ДИМЕТОКСИ-1,2,3,4-ТЕТРАГИДРО-1-ИЗОХИЙОЛИЛ-АЦЕТАМИДА
ИЛИ ИХ СОЛЕЙ
0 и т-(.-0-СН, О, (ã
СН,-Сов
МеО
Ne0
ИеО
МеО
1т-К (4)
СН,-Сомн-R
В-нн, 5 где Ва имеет указанные значения, с удалением если зто необходимо, бензилоксикарбонильной группы и выделением целевого продукта в свободном виде или в виде соли.
Пример 1. 28,7 r (0,1 моль) 6,7-диметокси-1,2,3,4-тетрагидро-l-иэохинолил-уксусной кислоты растворяют в 50 мл водного раствора, содержащего 4 r гидрата окиси натрия.
Раствор охлаждают до минус 10 — минус 15 С и в течение 30 мин, при охлаждении, добавляют по каплям 17 г (О, 1 моль) бензилоксикарбонилхлорида. Охлажденную реакционную смесь перемешивают дополнительно 3 ч и
Цель изобретения — синтез новых 20 соединений, обладающих ценными свойствами, позволяющими применять их в медицине.
Поставленная цель достигается тем, что 6,7-диметокси-1,2,3 4-тетрагид- .хб ро-1-изохинолил-уксусную кислсту вводят во взаимодействие с бензилоксикарбонилгалогенидом, полученную
2-бензилоксикарбонил-6,7- иметокси-1,2,3,4-тетрагидро-l-изохинолил- 10
Изобретение относится к способам получения новых соединений общей формулы: где и (— водород или бенэилоксикарбонил;
R< — арил, замещенный арил или гетерил, облацающие биоло.гической активностью.
Широко известно взаимодействие карбонильных соединений с аминами (1) .
-уксусную кислоту или ее реакционноспособное производное общей формулы: где R — галоген, ацилокси- алкилокси-, арилокси-, или замещенная арилоксигруппа,вводят во взаимодействие с амином общей формулы:
691087
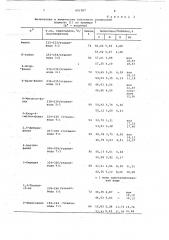
Т а б л и ц а 1
Физические и химические константы соединений формулы (1) по примеру 2 (R — бензилоксикарбонил) Фенил
104-106/бензолэфир
70i41 6,13 6,08:
69,91 6,05 6,17
66 70,86 6,37 5,90
168-169/этанол
П-толил
70,81 6,4 1 6,16
72 . 67 77 $69 5 86
67,47 5ф75, 6г00
64 . 60,ll 5,04 5,10
59 86 5,00 5,09 4-Метокси-фе" . нил 145/бенэол-петролейный эфир
68 55 6,16 5,71
68 87 6 55 5,65
185-186/бензол
82 69,30 6,02 5,58.
69 64 бф63 ..6 02
4-Хлор-4-метил-фенил
>, 4 "ди-бромфенил 125-126 /бензолвбил
84 ббу07 5 74 5,51
66е40 6 01 5 74
52,44 4,24 4,53
52к65 4ю46 4 41 подкисляют 40 мл ЗОВ-ного раствора хлористоводородной кислоты. Выпавшие кристаллы отфильтровывают, высуши - вают и перекристаллиэовывают из смеси бенэола с эфиром. Получают 32,5 r
2-бензилоксикарбонил-б,б-диметокси-1,2,3,4-тетрагидро-l-изохинолил-уксусной кислоты. Т. пл. 153-151О С.
Вычислено, Ъ: С 65,441 Н 6,01;
М 3,63.
С Иль|40 .
Найдеио, Ъ! С 65,26 И 5,901
N 3,46 °
П р и и е р 2. 0 02 моль бензилоксикарбонил-б,7-диметокси-1,2,3,4-тетрагидро-1-изохинолил-уксусной кислоты растворяют в 80 мл безводного тетрагидрофурана, охлаждают до минус 10 — минус 15 С и раствор
0,02 моль триэтиламина и 0,02 моль /
4-Фтор-фенил 142-144/беизолэфир
).
4-Бром- фенил 152-154/этанолф
4-Ацетилфеннл 168-169/бензол изобутоксикарбонилхлорида добавляют
В по каплям при перемешнвании в течеwe 5 мин. После 5-минутного дополнительного перемешивания раствор
0,02 моль соответствующего амина s
5 20 мл тетрагидрофурана добавляют к
" смеси по каплям, перемешивают смесь еще 5 ч и оставляют стоять на ночь.
Выделившийся триэтиламмонийхлорид отфильтровывают и промывают тетрагидщ рофураном. Тетрагидрофураиовые растворы упаривают. Остаток растворяют в
70 мл этилацетата и промывают до нейтральной реакции 2,6 мл воды, 1%-нйм раствором гидрата окиси натрия в 5 2,5 Йл воды. Этилацетат высушивают .. "над сульфатом натрия и упаривают в вакууме. Остаток крнсталлизуют. Данные полученного соединения показаны в табл.1, 691087
Продолжение табл. 1
Т.пл. кристаллов, С/
/растворнтель
Вычислено/ Найдено, %
Выход, Ъ с н
61,66 5 90 9,11
67р32 6,15 8,92
112-115/бензолэфир
3-Пиридил
1,3-Тиаэол- Масло -2-ил
61,66 5,39 8,99
62,02 5,56 8,75
70 67с91 5,50 10,98
67,89 5,95 10,85
166- 167/этанолэфир
2-Хиноксалил
П р и и е р 3. 7,7 г (0,02 моль) 20 хинолил) -ацетамида. Т.пл. 167-169"С
2-бензилоксикарбонил-б, 7-диметокси- . (этанол) °
-1, 2, 3, 4-тетрагидро-1-иэохинолил- Пример 5. 7, 7 г (О, 02 моль) .-Уксусной кислоты растворяют в 30 мл 2-бенэилоксйкарбонил-6,7-диметокснхлороформа и c 2,83 г (0,024 моль) -1,2,3,4-тетрагидро-l-изохинолилхлористого тионина кипятят l ч при 25 -уксусной кислоты и 1,86 г (0,02 моль) действии обратного холодильника. По- анилина растворяют в 80 мл тетралученную реакционную смесь упаривают . гидрофурана и добавляют По каплям в вакууме и хлорид: кислоты, получен- раствор 4, 52 г (0,022 моль) дициклоный в виде остатка, растворяют в . гексилкарбодйимида в 20 мл тетрагид10 мл бенэола, . ЗО рофурана. Реакционйую смесь переме2,9 r ((О0р02 моль) 2-аминохинокса-" шивают при 1 + l ч и при комнатной лина растворяют в 10 мл бензола при температуре .2 ч, Выделившийся дицнкООC и к получейному Раствору одновре локарб мид отфильтровывают, промыменно добавляЮт по каплям -приготов-, вают тетрагидрофураном и фильтрат ленный, как было указано раствор 2 35 упаривают.
-бензилоксикарбонйЛ-6,7-диметокси- . . ПолучаЮт 9,2 г 2-бейзилоксикарбо-1-иэохинолил-ацетилхлорида и 15 мл- нил-б,7-диметокси-1,2, 3,4-тетрагидро2- н. Раствора гиДРата окиси натриЯ. .-1-изохинолил-ацетамид. T.IIë. 104По окончании добавления указанных ......106 C (смесь бензола с эФиром). растворов реакционной смеси дают . ) П р и м е p 6, 7,7 r (0,02 моль) подогреться и при комнатной темпеРа- 2-бензилоксикарбонил-6,7-диметокситуре перемешивают 3 ч. Затем смесь -1,2,3,4-тетрагидро-l-изохинолилотделяют и бенэольную фазу промывают уксусйой кислоты и 2,9 г (0,02 моль)
2 н. Раствором гидрата окиси натрия 2- мино-хинолина тшательно леремешии водой. Венэольный раствор высуши- вакыт и нагревают в токе азота 3 ч вают и упаривают. Получают 9,4. г 45 при 170-180 .g. После охлаждения полу"
2-{2-бензилоксикарбонил-б,7-диметок- T 8,2 г 2-(2-бензилоксикарбонилси-l,2,3,4-тетрагидро-l-иэохинолил) -6,7-дйметокси-1,2,3,4-тетрагидро-l-ацетамид-хиноксалина. T.ïë. 166- ., .-изохинолил-ацетамидо) -хиноксалйна.
167 С {смесь этанола с эфиром). Т,пл. 165-166 С (смесь этанола с эфиром).
П p и.м е р 4. 10,12 г (0,02 моль) Пример 7 ° 0,02 моль 2-бен:и-нитрофенил-(2-бенэилоксикарбоннл" ; эилоксикарбонил-6,7-диметокси-1,2,3, -6,7-диметокси -1,2,3,4-тетрагидро- 4-тетрагидро-1-изохиналил-ацетамид-l-изохинолил)-ацетата.н 2,14 г ного производного растворяют в (0,02 моль) и-толуидина в 50 мл толу- 55 4-5 эквивалентах ЗОВ-ного раствора ола кипятят при действии обратного бромастого- водорода в уксусной кисхолодильника 3 ч. Смесь охлаждают лоте. Через .30-50 мин иэ раствора вы.IIpoMbIBBtoT 1 н. раствором гидрата депяются кристаллы, раствор затверокиси натрия и водой. Толуольный ра- девает. После добавления эфира отдествор высушивают безводным сульфатом .щ ление кристаллов заканчивается, венатрия и упаривают. Получают 9,2 г щество отфильтровывают и промывают
N-Il-ToJINJI-(2-бензилокеикарбонил)-б,7- эфиром. данные приготовЛенного таким
-диметокси-l,2,3,4-тетрагидро-l-иэо- путем вещества приведены в табл.2.
691087
Таблиц а 2
Физические и химические константы соединений формулы (1) по приМеру 7 (R" — водовод) 7
ычислено/Найдено,%
Н N Br
232-233/этанолвода 3:2
Фенил
П-толил
253-254/этанолвода 3:2 ион
18,97
18,67
4-Фтор-фенил
232-234/этанолвода 4:1
72 53,65 5,21 6,59 ион
18,10
54,02 5,35 6,14 11,18
82 46,93 4,56
46,80 4 50
90 54,92 5,76 6,40
55,12 5,69 6,63
94 52,70 5,31
53,01 5,48 ион
17,53
17,40
2,4-Дибром-. фенил
207-208 С/этанолвода 9:1
95 40,38 3,75 4,96 ион
14,13
40,79 3,93 4,91 14,57
4-Ацетилфенил
206-208/этанолвода 7:3
86 56 13 6,61 6,24
55 98 5 85 6,17
324-326/этанолвода 9:1
3-Пиридил
88 41,61 4,96 8,28 31,51
42,36 5,12 8 66 30,98 с. 1 моль кристаллизованной воды
1;,3-Тиазол-2-ил
238-240 /этанолвода 1:1
72 46,39 4,87 — ион
19,19
46с53 5,03 — 19,12
84 52t83 5,28 11,74 16,76
52 83 5,23 11,38 16,48
4-Бром-фенил 234-235/этанолвода 3:2
4-Метокси-фенил, 238-239/этанолвода 2:3
3-Хлор-4-метил-фенил 224-225 /этанолвода 4:1
2-Хиноксалил 192-194 /этанолвода 7!3
74 56,02 5,69 6,88
55,92 5,67 6,49
84 57,01 5,98
57,25 6,10 ион
32,87 ковалент
32,90
691087
Формула изобретения мео
МеО В
СН -СОИН-К (> ) Составитель Г. Жукова
Редактор Т. Орловская Техред М.Келемеш КорректорЕ.Папп
Заказ 5819/57 Тираа 513 Подписное
ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Иосква Ж-35 Разыская наб.< д. 4 5
Филиал ППП Патент, г. Умгброд, ул. Проектная,4
Способ получения производных 6,7-диметокси-1,2,3,4-тетрагидро-1-изохинолил-ацетамида общей формулы: где Rq означает водород или бензилокрикарбойил, Rg означает арил, замещенный арил или гетерил, о т л н ч а юшийся тем, что 6,7-диметокси-1,2,3,4-тетрагидро-1-изохинолилуксусную кислоту вводят во взаимодействие с бензилоксикарбонилгалогенидом, полученную 2-бенэилоксикар" бонил-6,7-диметокси-1,2,3,4-тетрагидро-1-иэохинолил-уксусную кислоту или е реакционноспособное производное общей формулы:
Иео II
Ие0 М-С-О-Ю2 О > (Е)
5 CH -COR
3. где R g — галоген, ацилокси«, алкилокси-, арилокси- илн замещенная арилоксигруппа, вводят во взаимодействие с амином общей формулы:
IO где Rg имеет укаэанйые значения, с удалением, если это необходимо бензилоксикарбоннльной группы и выделением целевого продукта в сво15 бодном виде или в виде соли.
Источники информации, .принятые во внимание при экспертизе
1. Вюлер.К., Пирсон Д. Органические синтезы ., М., Мир, 20 1973, с. 483-486.