Способ получения производных пиридо (1,2-а) пиримидина
Иллюстрации
Показать всеРеферат
Соеоз Советския
Социалистииеския
Республик
ОПИСАНИЕ
ИЗОЬЕЕтЕНИЯ
К ПАТЕНТУ «i 698532 (61) Дополнительный к патенту (22) Заявлено 03.11.77 (21) 2424104/2537600/23-04 (23) Приоритет 26.11.76 (32) 27.11.75
Государственный коиктет
СССР оо делам нэобретеннй н открытнй (31) С! — 1623 (33) ВНР
Опубликовано 15.11,79. Бюллетень Ио 42
Дата опубликования описания 18.11.79 (53) УДК
547.859.1.07 (088.8) (72) Авторы изобретения
Иностранцы
Золтан Чесарогц, Йожеф Кнолл, Петер Сентмиклоши, Иштван Хермец, Агнеш Хорват, lllawop Вираг, Арпадне Вашвари н Агоштон Давид (ВНР) Иностранное предприятие
"Хиноин Дьедьсер еш Ведьесети Термекек Дьяра PT" (ВНР) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРИДΠ— (1,2 — А)— — ПИРИМИДИНА
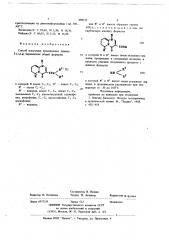
C> — С4 алкилфенил;
R3 — водород; или R2 и R3 вместе образуют группу — (СН2),—.
Способ состоит в том, что карбоновую кислоту формулы
С 0 0Н
R 0 в которой R и R имеют указанные выше значения, преврашают в смешанный ангидрид и проводят реакцию полученного продукта с амином формулы
IS (1) 2
С01ч э к
HN к
В 0 в которой R и R имеют указанные выше значения, в среде органического растворителя при температуре -30 — +100 С.
Процесс проводят следуюшим образом.
Изобретение относится к способу получения новых производных пиридо- (1,2-а)- пиримидина, которые могут найти применение в медицине.
Способ получения амидов карбоновых кислот путем ацилирования соответствуюших аминов смешанными ангидридами в среде органических растворителей широко известен в литературе 111.
Целью изобретения является синтез новых производных пиридо-(1,2-а)-пиримидина, обладающих фармакологическими свойствами. 10
Поставленная цель достигается описываемым способом получения производных пиридо-(1,2-а)пиримидина обшей формулы
1 где R — алкнл С вЂ” С4, I
R — алкил С вЂ” С4, R — водород, алкил С, — С4, алкил С,— С4, г замешенный С1 — С4 алкоксигруппой, галондфенил, нитрофенил, С, -С4 — алкоксифенил, I г . ° .1
„ .3 (51) М. Кл.
С 07 О 471/04!I
А 61 К 31/495
69!
О
I5
ЗО
45
55
Соединение обшей формулы (I!) растворяют в органическом растворителе, предпочтительно в хлорированном углеводороде (хлороформе) или в простом эфире, предпочтительно диоксане или тетрагидрофуране. В раствор, полученный после добавки триалкиламина, предпочтительно триэтиламина или трибутиламина, по каплям вводят при температуре от -30 до . 50 С, предпочтительно от -20 до 0 С; кислотный галогенид, предпочтительно галогенид три-! метилуксусной кислоты, лучше добавку сложного этилового или изопропилового эфира хлормуравьиной кислоты . Затем также по каплям добавляют амин общей формулы (III), расстворенный в одном из указанных выше растворителей. В случае использования амина в виде . адцитивной соли кислоты одновременно вводят триалкиламин, предпочтительно триэтиламин или трибутиламин. Реакционную смесь размешивают при указанной температуре и затем нагревают до комнатной. температуры. Далее смесь взбалтывают с водным раствором двууглекислого натрия, затем с водой. Потом сушат и выпаривают. Остаток перекристаллизовывают из подходящего растворителя.
Пример 1. 089 г (4 ммоль) 16 диметил-3- к арба моил-4-ок со-1,6,7,8-тетрагидро-4Нпиридо-(1,2-a)-пиримидина растворяют в 10 мл хлороформа и в него при размешивании по каплям вводят 0,62 мл (4,4 ммоль) этилового эфира хлормуравьиной кислоты. После 1О мин дополнительного размешивания в смесь добав- ляют приготовленный с добавкой 0,58 мл (4,2 ммоль) триэтиламина раствор 0,70 г (4,2 ммоль) гидрохлорида глицин-трет-бутилового сложного эфира в 10 мл хлороформа.
Температуру поддерживают в процессе добавки и затем еще в течение 1 ч (-) 5 — (-) 10 С. Реакционную смесь выдерживают в течение ночи в холодильнике, а потом три раза промывают
5%-ным раствором двууглекислого натрия; а затем три раза водой. Органическую фазу высушивают над сернокислым натрием и потом выпаривают. Остающийся .темно-желтый смоло4 подобный продукт растворяют в 5 мл смеси этилацетата, пиридина, деляной уксусной кислоты и воды, взятых в соотношении 240:20:6:! !.
Затем производится хроматографирование в колонке высотой 50 см, диаметром 1,8 см, заполненной кизельгуром с размером частиц
0,063 — 0,125 мкм. В качестве элюирующей среды используют вышеупомянутую смесь растворителей. Расход потока составляет 30 мл/ч. Выходящий из колонки растворитель испаряется в вакууме. Остаток от выпаривания выдерживают в течение длительного времени с целью удаления оставшегося от растворителя пиридинацетата при вакууме 10 мм рт.ст. Полу8532 4 чают г окрап|енной, аморфной, смолоподоб- ной массы.. Эту массу растворяют в !0 мл циклогексана и раствор вводят в реакцию в тепле с 15 мл циклогексана. Выпавшие кристаллы на другой день отфильтровыван т и высушивают в воздухе. Получают 1„8 r (60%) 1,6-ди-! метил-1,6,7,8-3- (N-трет.-бутоксикарбонилметил) .
-карбамоил-4-оксо-1,6,7,8-тетрагидро-4Н- пиридо -(1,2-а)-пиримидина, т.пл, 180 — 182 С.
Вычислено,%: С 60,68; Н 7,51; N 12,53.
Найдено,%: С 61,12; Н 7,70; N 11,94.
Пример 2. 4,4 г (0,02 моль) 1,6-диметил-3- карбок сил-4-оксо-1,6,7,8- тетрагидро-4Н-пиридо-(1,2-а)-пиримидина и 3.1 мл (0,022 моль} триэтиламина растворяют в 50 мл хлороформа. Раствор охлаждают до -10 С. 3атем нри размешивании по каплям добавляют
2,1 мл (0,022 моль) этилового эфира хлормуравьиной кислоты, Размешивание продолжают еще в течение 10 мин, после чего добавляют раствор 1,95 г (0,22 моль) анилина в 25 мл хлороформа. В процессе добавки и потом еще в течение 1 ч температуру поддерживают (-) 5— (-)1О С. Реакционную смесь выдерживают в течение ночи в холодильнике, после чего ее три раза взбалтывают с 5%-ным раствором двууглекислого натрия и три раза с водой. Органическую фазу высушивают над сернокислым натрием и испаряют в вакууме. Получают 6,7 г (96%) желтого кристаллического вещества, плавящегося при 180 С. После двухкратной перекристаллизации из этанола получают 1,6-диметил-3- (N-фенилкарбамоил) -4-оксо-1,6,7,8-тетрагидро-4Н-пиридо- (1,2, а) -пиримидин, т.пл. 189-190 С.
Вычислено,%: С 68,67; Н 6,44; N 14,13.
Найдено,%: С 68,60; Н 6,50, N 14,21.
Пример 3. 4,4 г (0,02 моль) I,б-диметил-З-карбокси-4-оксо-1,6,7,8-тетрагидро-4Н-пиридо- (1,2-a) -пиримидина и 3,1 мл триэтиламина растворяют в 50 мл хлороформа. Раствор охлаждают до -10"С и вводят в реакцию сначала
2,1 мл (0,022 моль) этилового эфира хлормуравьиной кислоты, а потом суспензию 1,5 r (0,22 моль) метиламынгидрохлорида в 25,0 мл хлороформа и 3,1 мл триэтиламина. Смесь размешивают в течение 1 ч при (-)5 — (-) !0 С и затем выдерживают в течение ночи в холодильнике. На следующий день взбалтывают три раза каждый с 50 мл 5%-ного раствора двууглекислого натрия, а потом с 50 мл воды. Opra. ническую фазу высушивают над.сернокислым натрием и выпаривают. Получают 3,9 г (83%) желтого вещества, которое перекристаллизуют иэ этанола. Получают 1,6-диметил-3-(N-метилкарбамоил) -4-оксо-1,6,7,8-тетрагидро-4Н-пиридо-(1,2-а)-пиримидин с т.пл. 172 — 174 С.
Вычислено,%: С 61,26; Н 7,28; N !7,86.
698532
Найдено,%; С 61,00; Н 7,40; N 17,75%.
Пример 4. В раствор 4,4 (0,02 моль)
l,б-диметил-3-карбоксил-4-оксо-1,6,7,8-тетрагидро-4Н.пиридо- (1,2-a)-пиримидина и 3,1 мл (0,022 моль) триэтиламина в 50 мл хлоро1 форма при температуре -10 С сначала вводят по каплям 2,1 мл . (0,022 моль) этилового эфира хлормуравьиной кислоты, а потом 1,9 г (0,022 моль) пиперидина в 25 мл хлороформа.
Реакционную смесь размешивают при (-)5— о (-) 10 С в течение 1 ч, а затем выдерживают в течение ночи в холодильнике. На другой день раствор три раза взбалтывают каждый с 50 мл 5 -ного двууглекислого натрия, !
5 высушивают над сернокислым натрием и выпаривают. Получают 5,2 г (90%) l,б-диметил-4-оксо- (1-пиперидилкарбамоил) -1,6,7,8-тетрагидро-4Н-пиридо- (1,2-а) -пиримидина в виде желтого некристаллизующего масла.
Вычислено, 7: С 66,41; Н 8,01; <Ч 14,52.
Найдено,%: С 66,58; Н 8,20; N 14,47.
Пример 5. 4,44 г (0,02 моль) l,б-диметил-3-карбоксил-4-оксо- 1,6;7,8-тетрагидро-4Н-пиридо- (1,2-а)-пиримидина н 3,1 г триэтиламина растворяют в 50 мл хлороформа.
В раствор вводят при -10 С сначала 2,1 мл (0,022 моль этилового эфира муравьиной кислоты, а потом раствор 5,26 r (0,022 моль) дифенилпропиламина в 25 мл хлороформа. Реакционную смесь размешивают в течение l ч при (-)5 — (-) 10 С, а затем выдерживают в течение ночи в холодильнике. На другой день раствор встряхивают с 5%-ным раствором двууглекислого натрия, а потом с водой. Затем сушат
35 над сернокислым натрием, отфильтровывают и выпаривают. Получают 6,8 г (82%) желтого кристаллического вещества. После перекристаллиэации из этанбла получают l,б-диметил-34О (N- (3,3-дифенилпропил) -карбамоил1-4-оксо-1,6-7,8-тетрагидро-4Н-пиридо- (1,2-а) - пиримидина, с т.пл. 173-175 С.
Вычислено,%: С 75,15; Н 7,04; N 10,11.
Найдено,%: С 74,94; Н 6,96; N 9,81.
Пример 6. 4,44 г l,б-диметил-3-карбоксил-4-оксо-1,6,7,8-тетрагидро-4Н-пиридо- (1,2-а)-пиримидина и 3,1 мл триэтиламина растворяют в хлороформе. Раствор охлаждают до -10"С и вводят в реакцию сначала 2,1 мл этилового эфира хлормуравьиной кислоты, а потом приготовленный раствор l,б-трет-бутиламина в хлороформе. Реакционную смесь размешивают при (-)5 — (-)10 С в течение 1 ч, а затем выдерживают в течение ночи в холодильнике. На другой день раствор взбалтывают сначала с
5%-ным раствором двууглекислого натрия, а потом с водой. Затем сушат над сернокислым натрием, фильтруют и выпаривают. Полученные
5,3 г (95%) желтого кристаллического вещест- ва перекристаллизовывают из этанола. Получают 1,6-диметил-3- (N-трет-бутилкарбамоил)° 4-оксо-1,6,7,8-тетрагидро-4Н- пиридо- (1,2- а)-rmtpHamgm с т,пл. 179 — 181 С.
Вычислено,% . С 64,96; Н 8,36; N 15,15.
Найдено,%: С 64,68; H 8,32; N 15,42.
Пример 7. В приготовленный в хлороформе, охлажденный до -10 С раствор 4,44 г (1,6-диметил- 3- карбоксил-4-оксо- 1,6,7,8-тетрагидро-4Н-пиридо-(1,2-а)-пиримидина и 3,1 мл триэтиламина вводят сначала 2,1 мл этилового эфира хлормуравьиной кислоты, а потом 2,7 г р-фенилэтиламина. Реакционную смесь размешивают в течение 1 ч при (-)5 — (-)10 С, а потом выдерживают в течение ночи в холодильнике.
HS OH 8 T p B3633lTblBRIOT сначала с
5%-ным раствором двууглекислого натрия, а потом с водой. Далее сушат над сернокислым натрием и выпаривают. Образовавшиеся 2,1 r желтые кристаллы перекристаллизовывают из этанола. Получают l,б-диметил-3- (N- (2-фенилэтил) - карбамоил) -4-оксо- 1,6,7,8-тетрагидро-4Н-пиридо- (1,2-а) -пиримидин с т.пл. 141 — 143 С.
Вычислено,%: С 70,13; Н 7,12; N 12,91, Найдено,%: С 69,83; Н 6,96: N 12,74.
Пример 8. Аналогично примеру 2, но используя и-хлоран лин вместо анилина, получают l,б-диметил-З- (N- (4-хлорфенил) -карбамоил1-4- оксо-1,6,7,8-тетра гидро-4Н- пи ридо- (1,2-а)пиримидин (выход 83%). После перекристаллизации из димстилформамида т.пл. 234 — 235 С.
Вычислено,",!: С 61,54; Н 5,47; N 12,66.
Cl 10,68.
Найдено,%,: С 61,52; Н 5,80; N 12,55;
С1 10,79.
Пример 9. Аналогично примеру 2, но используя и-этоксианилин вместо анилина, получают l,á-gnve v-3- (N- (4-этоксифенил) - карбамоил1-4-оксо- 1,6,7,8-тетрагидро4Н-пирндо-; .
-(1,2-а)-пиримидин (выход 63%). После перекристаллизации из диметилформамида т.пл. 192—
194 С.
Вычислено,%: С 66,84; Н 6,79; N 12,3.
Найдено,%: С 66,65; К 6,84; N 12,25.
Пример 10. Аналогично примеру 2, но используя м-толуидин вместо анилина, получают l,б-диметил-3- (N- (3-метилфенил) -карбамоил)-4- оксо- 1,6,7,8-тетра гидро-4Н- пи ридо- (1,2-а) - пиримидин (выход 94%). После двойной перео кристаллизации из этанола т,пл. 161 — 163 С.
Вычислено,%: С 69,43; Н 6,80; N 13,49.
Найденов: С 69,40; Н 6,55; N 13,60.
Пример 11. Аналогично примеру 2, но используя и-нитроанилин вместо анилина, получают l,б-диметил-3-(N- (4-нитрофенил)-карбамоил1-4-оксо-1,6,7,8-тетрагилро-4Н-пиридо-(1,?-а)-пиримидин (выход 54 -). После переСООН
О
К аI(X)
3 р XR3
Составитель В. Наэина
Техред И. Асталош
КоРРектоР В. Бутяга
Редактор Н, Потапова
Подписное
Заказ 6957/39 Тираж 513
ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж вЂ” 35, Раушская наб., д. 4/5
Филиал ППП "Патент", r, Ужгород, ул. Проектная, 4
7 6985 крйсталлизации из диметилформамида т.пл, 305—
308 C.
Вычислено,%: С 59,64; Н 5,30; N 16,36:
Найдено,%: С 60,03; H 5,32; N 16,48.
Формула изобретения
Способ лолучення производных пиридо -(1,2-я) пиримидина общей формулы в которои R алкил C> — С4, R! — алкил С! — С4
R — алкил C> — С4, ! ю
R — водород, алкил С1 -C„, алкил С1 -С4, замешенный С! — С4 алкоксигруппой, галоидфенил, нитрофенил, С1 -С4 алкоксифенил, С, -С4 алкилфенил;
R — водород, 32 8 или R и R" вместе образуют группу (СН,), отличающийся тем, что карбоновую кислоту формулы в которой R и R имеют выше указанные значения, превращают в смешанный ангидрид, н проводят реакцию полученного продукта с амином формулы в которой R и R имеют выше укаэанные значения, в органическом растворителе при температуре от -30 до 100 С.
Источники информации, принятые во внимание при экспертизе
1. Вейганд Хильгетаг. Методы эксперимента в органической химии. М., "Химия", 1968, с. 450 — 454,