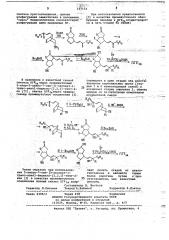
5-нитро-7-син-(3-оксоокт-1-транс-енил)бицикло-(2,2,1)-гепт- 2-ен как полупродукт полного синтеза простагландинов
Иллюстрации
Показать всеРеферат
5-НИТРО-7-СИН-
с «со >анан
1е ; те;н„, . л 4
707153. А
СОКЗ СЯЗЕТСНИХ
С014ИАЛИСТИЧЕСНЙХ
PEQFlYSJlHH пес но
ОПИСЛНИК ИЗОБРКтяния
Н АВ ГОРСКОМЪГ СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЬЙ КОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЬП ИЙ (21) 2664475/23-04 . (22) 20. 09. 78 (46) 15. 02. 83. Бюл. Р 6 (72) A.A. ApxeM, Н.Ф. Бондарь, Е.В. Королева и Т.Н. Омельченко (71) Институт биоорганйческой химии
AH Белорусскбй ССР (53) 547 . 594 . 4 (088. 8) (56) 1. Brown Е. О., L i l ley Т. J ..
А short synthes is of prostag land ins
f rom 5-chloro-5-суапо-7-synformylb i c i c l o (2, 2, 1) rept -2-ene. Chem. Comm, 1975, р 39.
2. Патент ФРГ Р 2323454, кл. С 07 D 5/06, С 07 0 21/00, . С 07 С 61/36, онублик. 1977. )(59 С 07 С 49 21; С 07 С 177 00 г (54)(57) 5-НИТРО-7-СИН"(3-ОКСООКТ1-TPAHC-ЕНИЛ)-БИЦИКЛО -(2,2,1) -ГЕПТ2-ЕН КАК ПОЛУПРОДУКТ ПОЛНОГО СИНТЕЗА
HPGCTAI ЛАНДИНОБ формул" как полупродукт полного синтеза простагландинов. аФ
1 707153
Чэобфетение отйосится к йовым про- и обеспечивает переход к природному = "изводным бициклогейтейа, койкретно йроСтагландийу ПГ Г,, в семь стадий. к 5-нитро-7-син-(3-оксоокт-1-транс- : Цель изобретения - расширение енил)-бицикло-(2,2,1) -геп;-2-ену (I). ассортимента. полупродуктов полного синтеза простагландинов и их анало5 j,"oi, позволянхцих упростить схему полного синтеза простагландийов, а о
Цель достигается 5-иитро-7-син-! (3-оксоокт-1-транс-енил 1-бицикло- 2, 2,1 -гепт-2-еном формулы Щ . По
t0 сравнению с известным 5-хлор-5-циано-7-син-(3-оксоокт -1-транс-енил)Укаэанное сдединение является . бицикло-(2,2,1) -гепт-2-еном (Т1)
" промежуточным в полном синтезе про» . :предлагаемое соединение обеспечивастанландинов (ПГ) - биологически ет более короткий переход к биологиактнвных природнык соединений. чески активнйм пГ. кроме того,"
5-нитро-7-син- (3-оксоокт-1-транс- по сравнению с синтезом аналога (II) еннл)-бицикло-(2,2,1) -гепт-2-ен, из циклопентадиена, синтез предлаеуо свойства и способ получения гаемого соединения (1) иэ того же В" лйтературе не описаны. исходного вещества осуществляется
СтруКтурным аналогом данного сое- с прецаративным выходом и в условидинения„ является 5-хлор-5-циано-7- ях, легко реализуемых в препаратив-I1 син- (3-оксоокт-1-транс-енил)-бицик- ном и промышленном масштабе (нетокло- {2, 2,1) -гепт-2-ен (11) (f) . сичные реагенты, температуры, близкие к комнатным
Способ получения 5-нитро-7-сииH C (ц) (3-оксоокт-1-транс-енил)-бицикло1 5 0 (2,2,1) -гепт-2-ена {I) основан на
l известной реакции присоединения диметил-2-оксогептилфосфоната (1TT) по Виттигу-Хорнеру к карбонильному . -ЗО соединению; в "данном случае,,к
Соединение (TI) также является 5-нитро-7-син-формилбицикло-(2,2,1)полупродуктом полного синтеза про- гепт-2-ену (1у) (2(. стагландийов по схеме Кори-Броуна, Процесс осуществляют по схеме
:»" дСО (") (gsP)Р(о)щ с Р„-- — -+(иео) Р(О)сксс н„— - + н„с 0
11 и-3uji e " М (щ} ь 10, 9
NO2 (Ц мо, >
П *р и м е р. Пс лученйе 5-яитро7-син- (3-оксоокт-1-транс-енил) -би- 45 цикло-(2, 2, 1) -гепт»2-ена.
Раствор 7,45 г (0,034 моль) свежеперегнанного диметил-2-оксогептилфлсфоната в 70 мл абсолютированно-. го дйметоксиэтана охлаждают,® смесью льда с хлористым кальцием до -20 C"и добавляют за 15 йин . 35 мл (0,035 моль) 1н. раствора н-бу тилиития в гексане. РеакциОнную
= смесь перемешивают 15 мин, затем добавляют 3,4 r (0,024 моль)
5-нитро-7-снн-формил-бицикло-(2,2, Ц -гепт-2 ена в 40 мл абсолютиро ванйого диметоксиэтана при «5ОС.
По: Окончании прибавления смесь перемешивают еше 14 ч, постепенно б0
TfoBbEtIBH температуру до комнатной, нейтрализуют водным раствором уксусной кисл»бты, упаривают в вакууме и остаток распределяют между 120 мл %Бристбго метилена и"30 мл насы- 65 щенного раствора хлористого натрия.
Водную часть экстрагируют хлористым метиленом, "экстракты после высушивайия и упаривайия-хроматографи-. руют на силикагеле Л 100/160 р элюйруя продукт смесью растворителей в соотношении хлористый метилену гексан-1:3 с 50% .ацетона. Весь
Сййтез-прбводят в атмосфере аргона. ъ
После очистки получают 3,0 r - --(603) хроматографически чистого
5-нитро-7-син-(3-оксоокт - 1-трансеицфбицнкло- (2, 2, 1) -гепт-2-ена (I), Rj О,бб (пластинки "Силуфол", система гексан:ацетон=5:1); ИК-спектр, смА 984(цс струе 1385, 1548 (9НО ). 4675 {4ññ-с ) 3072(НО=с)
Иол. вес (масс-сйектрометрически) 263.
Вычислено для С Н 1 МО3 263.
5-Нитро-7-сии- (3-оксоокт- 1-трансенил) -бицикло- (2, 2, 1} -гепт-2-ен является полупродуктом полного Д, 54
10715 э
4 !
При использовании предлагаемого (1) в качестве промежуточного обес печения переход кРГ,„осуществляется в пять стадий no схеме
За0Н нс л»алиВ
Он
:. ФФВМ1Ф4ФФФФФеяФФ»
Su grim Π— %М ъ%.Ф
СX« -BugiZ
ОЕ Н
0Н
1) (i,-Ргб) Щ в
>) Н101,аГ ч кз, д
3.. Н1А он
5) Â ç8àí
5 11
О о, ) ъ-3чфън.
rlTFw
5"11
ОН
i
Таким образом, при использова- .чает десять стадий от циклОнии 5-нитро-7-син- {3-оксоокт-1- гептадиена и является " самым транс-енил)-бицикло-(2,2,1) -гепт-2- более коротким путем к проена (1) в качестве. промежуточного зз стагландинам, чем известные соединения полный синтез ПГР вклю- способы.
Составитель В. Жестков
Редактор Л;Письман Техред A.Âàáèíåö Корректор A,Äçÿòêî
» »» ° МЕ
Заказ 6395/2 Тираж 418 Подписное
ВНШ1ПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
»» «°
Филиал ППП "Патент", г. ужгород, ул. Проектная, 4 синтеза простагландинов, причем конфигурация заместителя в положении, "смесь" бициилогептена соответствует - конфигурации цеци природных ПГ..
В сравнении с известной схемой синтеза ПГВ1 через промежуточный
5-хлор-5-циано-7-син- (З-оксоокт-.1транс-енил) -бицикло- (2,2,1) -гепт-2- -.
1 ен (II), синтез ПГГ „через предлагаемое промежуточное соединение (1), совмещает в одну стадию оба восстановления карбонильнйх групп (стадии 1 и б нижеследующей схемы) и исключает стадию оыяления 2, обычно, идущую со значительный осмоленйем реакционной смеси:
ЯиС