Фосфорилированные триметилизотиомочевины, обладающие инсектоакарицидной активностью
Иллюстрации
Показать всеРеферат
ОП Ис
ИЗОБРЕТЕНИЯ -;
Союз Советских
Социалистических
Республик
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (61) Дополнительное к авт. свид-sy
I (22)Заявлено 14.08. 78 (21) 2658288/23-04 с присоединением заявки М
Гааударстеенкый. каинтет (23 ) Приоритет во делам кзааретенкй н аткрытнй
Опубликовано 30. 05. 82. Бюллетень М 20
Лата опубликования описания 30.05.82
H. Н. Мельников, A. Ф. Грапов, В. Н. Зонтова, С. А. Рославцева, A. С. Седых, Н. А. Гусева, E. Н. Кривцова, Б, Я. Либман и Л. Г. Лоскутов (72) Авторы изобретения (71) Заявитель .Ф"" -:»....АВ «Е«ММ4". ЮМ. «Ю Ъ%С. » «вЂ” % (54) фОСфОРИЛИРОВАННЫЕ ТРИМЕТИЛИЗОТИОМОЧЕВИНЫ, ОБЛАДАЮЦИЕ ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ
Ближайшими известными структурными аналогами описываемых соединений являются фосфорилированные метилизотиомочевины общей формулы
О ЗСн (RO) г P N= С вЂ” Нг где 1 — низший алкил (3 ).
Однако данные об их биологической активности в литературе отсутствуют.
Целью изобретения является расширение арсенала средств воздействия на живой организм.!
О г
Поставленная цель достигается описываемыми фосфорилированными триметилизотиомочевинами формулы (1 1, обладающими инсектоакарицидной активностью.
Фосфорилированные триметилизотиомочевины формулы (1) получают путем взаимодействия хлорангидридов соотИзобретение относится к области химии фосфорорганических соединений, а.именно к новым фосфорилированным триметилизотиомочевинам общей формулы з х 36н3
1 — da,), (Т т где 12. — метил, эти л, клорметил или этокси группа; и - этокси, фенокси-, хлорфенокси-, 2,4-дихлорфенокси-, 2,4,5-трихлорфенокси- или пентахлорйеноксигруппа; кислород или сера, обладающим инсектоакарицидной активностью, которые могут найти применение в сельском хозяйстве., Известно использование в качестве инсектицидов L" акарицидов хлорофоса
L t 3 и карбо< ктса f 2 ). (5! )М. Кл.
С 07 F 9/22
С 07 Г 9/24
С 07 F 9/44
Л 01 N 9/36 (53) УДК 547. 26 - 118.07(088.8) 3 707232 4 ветствующих кислот фосфора общей фор. мочевины в 200 мл хлороформа прибав-
l мулы ляют 2,80 r (О, 02 моль) хлорангидри-!
Ж да 0-фенилметилфосфоновой кислоты
1 затем при температуре от О до +10 С
1 у прмбавляют по каплям в течение к
15 мин 4,04 r (0,04 моль) триэтилами на. Реакционную массу перемешивают
7 ч при комнатной температуре, промыс солями триметилизотиомо евины фор- вают три раза водой, сушат над про1в каленным сульфатом магния и упарива- * .- -- -- -- . ют в вакууме. Получают 3,8 г техниН3 ческой N,N-диметил-S-метил-N -фенокЯ . Щ . . симетилфосфинилизотиомочевины. После очистки на пластйнках с незакреплен(СНа)у — g ммм слсем силмкагеля лолучалт амалм. где J - хлор, бром, или йод, тически чистый пРепаРат п, 1,5745, в присутствии двух эквивалентов dg 1,2690, 1 K „ 70у85, РВ „,, органического основания, в качестве 68у94 ° которого могут быть использованы тре- Найдено, io. С 49,01; Н 6,22; тичные ароматические или алифатичес- ?о N 10 10; кие амины, например пиридин или три-: Сн Нр > S метиламин, при 0-50 С в среде инерт . Вычислено, 3: С 48,51; Н 6,29; ного органического растворителя. N 10,28; P 11у37.
Пример 1. Получение N,N-ди- Пример 3. Получение N,N-диметил- -метил- -диэтоксифосфинил- л метил-$-метил- N диэтокситиофосфиизотиомочевины, нилизотиомочевины и N,N-диметил-S5,6 (0,022 ль) йодистоводород.- -метил- -этоксиэтилтиофосфинилизоной соли триметилизотиомочевины растворяют в 200 мл хлороформа. К полученному раствору прибавляют по кап" зо „ K Р створу 4,94 г (0,02 моль) лям 3 8 г (P 022 моль) хлорангидрида. йодистовоцоРоцной соли тРиметилизодиэтилфосфорной кислоты, затем мед- тиомочевины в 200 мл хлоРоформа вноленно вносят 4 45 г (p 44 моль) три- сят 3.76 г (0,02 моль) хлорангиарица этиламина при температуре от 0 до . 0,0-диэтилтиофосфорной кислоты, за+1poC в течение 15 мин. реакционйую " тем прибавляют по капля при темпе" а 3S 0 массу перемешивают 3 ч при комнатной РатУре OT 0 до +"0 C 4 04 температуре и оставляют на ночь. (0,02 моль) тРиэтиламина. РеакционЗйтем»с»месь"йромываюут трижды водои ную массу перемешивают при комнатной (по 20 мл), сушат над безводным суль- темпеРатУРе 2 ч, затем кипятят при фатом натрия, упариваЮо в вакууме и перемешивании 4 ч и оставляют на ночь получают 4,8 г масла, которое экстра- Хлороформ отгоняют в вакУум гируют низкокипящим петролейным эфи- таткУ пРибавлЯют бензол и фильтрУю, ром. Остаток выдеРживают в вакууме осадок на фильтРе пРомывают безвоД1.10 мм рт.ст. и выделяют 3,9 „ ным бензолом. ФильтРат УпаРивают и
1 N,N-диметил-S-метил-N -диэтоксйфос- экстрагируют сначала 30 мл холодно45 финилизотиомочевины, п 1,5ppp, . ro гексайа затем 100 мл гоРЯчего. д 4 1 1590 Мр 62 54 >g ЭкстРакты объединяют и упаривают, no6I,11 * abl" лучают 4,5 масла, представляющего
Наидено g: C 38 41 Н 6 9я6. собой смесь N N-диметил-S-метил-Nр 12 08 : - †. -: - - -- -- — — -диэтокситиофосфинилизотиомочевины
С Н Я 0 PS.
S0 и N,N-диметил"S-метил-N -этокси
В 49,2. Ъ
Вычислено, >: С 38 76; Н 7 53; р 12 18 - - - соотношенйй 5: 1 . .Хроматографией на
„, м e p 2. П„луч ниг -N,N pI,» пластинках с незакРепленным слоем метил-$-метил-N -,ôåíîêñèìåòèëôocôè- силикагеля. выделены два аналитичес5л нилизотиомочевины. КИ ЧИСТЫЕ ПРЕПа атЫ.
К раствору 4,94 r (0,02 моль) йо- Первый. — N,N-диметил-S-метил-N дистоводородной соли триметйслис зотс йяо- -диэтокситиофолсфинилизотиомоче вины.
7 07232 6 виде растворов аэрозолей или эмуль-. сионных концентратов.
Все предлаг аемые вещества проявляют высокую инсектоакарицидную ак5 тивность. При этом некоторые из них зн; ительно в 2,5-20 раз превосходят эт: доны. Так по токсичности для комнатных мух соединения 7 и 8 (см. табл. 2) равны хлорофосу, широко применяемому для борьбы с комнатными мухами и к которому во многих городах образовались резистентные популяции.
Для рисовых долгоносиков соединение
8 более, чем в 3 раза активнее хло- рофоса. В отношении гусениц шелкопряда соединения 5,7 и 8 также более активны, чем карбофос. Особенно высокая активность отмечена у соединений
7 и 8 для личинок комаров. Ларвицид20 ная активность их превосходит актив>
l ность карбофоса в 2,5 и 20 раз., Для паутинных клещей соединения
2 и 4 в 2 раза активнее карбофоса.
Пример 4. Определение инсек25 тоакарицидной активности фосфорилированных триметилизотиомочевин.
Инсектицидные свойства изучены для комнатных мух, рисовых долгоносиков, гусениц непарного шелкопряда зО и личинок комаров-кулексов. Комнатных мух и жуков опрыскивают 0,15 -ными водноацетоновыми растворами соединений в чашках для опрыскивания. Учет гибели проводят через 24 и 47 ч, соотвественно, 5
Найдено, б: С 35>04;,Н 7,09;
N 9,52; P 10,37.
Вычислейо, Ф: С 35,53; Н 7,08>
N 10,36; Р 11,45.
Второй - N,N-диметил-S-метил-N -этокси(этилтио)фосфинилизотйомочевины.
Найдено, 3: С 33,90; Н 6,89;
N 9,56; P 11,24.
Вычислено, Ф: С 35,53; Н 7,08;
N 10,,36; P .11.45.
Свойства других полученных соеди нений приведены в табл. 1, Строение всех полученных соединений подтверждено данными элементного анализа ИК- ПИР- и ЯИР С-спектрами.
ИК-спектры всех соединений содержат йнтенсивную полосу поглощения в области 1600 см (сопряженная C=N), тиофосфинилпроизводные имеют по осу поглощения в области 620-640, см " (P = S), фосфинилпроизводные погло". щают в области 1220-1240 см (Р=О).
В спектрах ПМР фосфинил(тиофосфинил)триметилизотиомочевин наблюдаются синглетные сигналы протонов СН -. группы при 2„32-2>53 м.д и (СК,) группы при 3,11-3,32 м.д. (спектры измерены при 30 С, растворители - дей тероацетон и дейтерохлороформ).
B спектрах ЯМР С имеется сигнал три гонального атома углерода при 166
169 м.д
Полученные фосфорилированные три" метилизотиомочевины обладают высокой инсектоакарицидной активностью. Они эффективны против комнатных мух (ltusCa dOmeStiCa 2), жуков рисового дол-;О гоносика (Caiandra огукае :.), обыкновенного паутинного клеща (Totranvchus
urticae Koch.), гусениц непарного шелкопряда (P. Жират) и личинок комаров.
Пример 5. Определение акарицидной активности фосфорилированных триметилизотиомочевин.
Акарицидные свойства определяют путем опрыскивания водноацетоновыми растворами испытуемых соединений кон" центрации 0,061 высечек из листьев, зараженных паутинными клещами. Учет гибели проводят через 48 ч. Результаты представлены в табл. 3.
Для практического использования в качестве инсектицидов и акарицидов предлагаемые соединения обычно используются в виде активных компонентов
>О композиций, включающий инертные наполнители, носители, растворители, диспергаторы, эмуль гаторы. Инсектицидные и акарицидные композиции могут использоваться в виде твердых, жидких
55 или патообразных препаративных форм.
Твердые препаративные формы могут приготавляться в виде дустов, гранул, смачивающихся порошков. )(идкие - в
Гусениц непарного шелкопряда подсаживают в стаканчики, опрыснутые
0,013-ной концентрацией испытуемых соединений. Учет гибели проводят че" рез 24 ч.
Личинки комаров помещают .е стаканчики, заполненные ацетонововодными
-6 растворами в концентрации 1.1О
Учет ведут через 24 ч. Результаты представлены в табл. 2..с
СО
ОО (va
iA л (Ч
А, л (Ч ф
3 и
40 ф, I» чс
-0 л
1(\ т л
ФЧ л (О о
СФ( л о
01 ( О м, о
CO
N о
ОО
Cl (О
A л аА л о м (Ф) « л
СО л сО
С) i
1«
ФЧ (О (Ч о (О м
Ф
0)
In (ФЧ л ( м
ФФ\
IA
IA м
° »
Ю
60 т
СО л (О
О) (О
CO
° Ъ
lA
Ю с (Ч
Ф м м
8„ ю (4
Ь„ х () ФФ
1
Ф у () г
IC (ф т а
С4
4 (4 х о
С1 л л (О
Ф 4 (4 (() о
СО о
cO r« в с о о о
ФЧ N м (Ч (Ч о
ФЧ
ФЧ М (Ъ IA
« л л
СФ)
-Ф
СО
Cl
Ф
CO.0
ФЧ
CO л
° (О
0) ФЧ л л (Т) О) м
01 O (Ф) О о О о а о л
CO (О
)О (Ф) (n
О) О),л .
О) О к
4) ч
iX
lC х
О) -С О)
ОО
IN N
1 (О м (4 (4 л а е
О) о
° *
)О л м
CO О
ОО
CO м
К>
О)
СO
ФЧ м
О)
С) (О
in л м (О
ФЧ О
С)
Оъ м м м
an o
-С в м («\
СО () 8
3
IО
3 и
)С
О а !!
0(iA ф (5)
0 ) м м о ь
О) о
N М (Ч (Ф)
CO м
ФЧ
c) м
О) 01
-т
CI с )
-Ф м
О) —.т О
-Ф
СО
Фс \
iA м
В (4) м
О
С)
О) !
iA л
IA м
0I
an м
О) ° Ф
С4 (X (p х
ФЧ
ФЧ
ФЧ
Ф"1 л о (О
О1
ФЧ
О)
0) л аА
СО
CI
-л
-Ф л
1 аА
Ct
С) (Ч о
01 (О
ФЧ
CO л
С) (4С (о
О) аА
ФЧ
iA (C
C) (О
ФЧ о
ФФ)
ФЧ
° Э « о О
-М
an
Ю л (Ф\ о о о
С)
ФЧ (4\
С) ! » (Ч
)О о
О
Ч) О С4
cJ л ю
)О
in
CI
Ci
« СО ф
С4
ФФ( х
44
C) (Ф(z ч
С) х
Ф4
С) и (Ч х () Ф() х ()
an
ФГ ! ((. 3
С4 (О о ((\ х (i
-Э
1 (4 (Ъ (() х (О (1
С3
44( Ч ф
В\ с
С4 и х (40
Ф(с
if(ir х
Ч)
О
t a
ass
I с
I м
5 у
Б() R
Х С»
Д О4! I
СО lA
-Ф м
7072 3?
0а ФЧ сО N м О (О (О с
1
I ! !
1
1
1
1
I
I
1 !
I
I
1
1
1
1
1 ! !
1
1
1
1
1
1
1 !
I
Ф !
Ф
1
I
I !
I (I
I
I
1
I !
1 ! ! !
I ! !
I (1
I
1
1
I
I
I !
I
I
I
I
1
I
I ! !
1 !
I !
1
I
I !
1
1 !
I
I
I
I
I ! ! !
I
I
I (1
707232
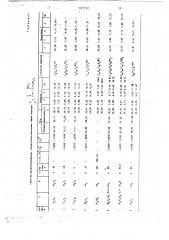
Теблнеа 2
« ее«ее»ее е ее е ее» ее r « е «е е» е
Гибель, 3 от иеиеемтреции е д/м е е е е « комери нелернид
10 еСК 3 велколрлд
0,01 СК „ а коинетние иухм рисоеие долю0 ° 15 С 3 .15 CK Ф е ееее е е е
СНО О . 12 сн о 70
2. f а о 40
50 0>15
0 гн о $27
0 е
100. 0,á025
СН . S 20 (Н S 33!
3 - 40 - 73
6 СьС! 0
4 С С6Н 0 ClQ1 S 100
8.:;.3,4 5-С1 Сен О (Н3 $ 100 0,02 100 0,02
Хлорофос
Карбофос . е е
Таблица 3
Акадицидные свойства соединений доля
Tetranychus urticae Koch.
Х Гибель от конI центрации, 0;064
0 100 0 001
0 93
0 95
S 100 0,001
6
С Ц
3 2
0,06
48
78
0,007
2,4,5-С13С6 0 Я
100
100 0,002
1(арбофос
1 СНО
2 С НО
3 ЩО
4 СНО
5 2,.4-С СеН,О
С Е10
2 6
СН, Сll О
2. 6
,о
СИП
С! О
2,4-С! С !! 0
С Со
2,4-Cl 6ll 0
46 - 100 4,4 10 100 0,0025
100 0,025 100 5.10 91 0, 0040
f00 0,08 100 I ° 10 100 0,0040
11:
Формула изобретения
707232
Составитель И. Красновская
Редактор П. Горькова Техред М. Гергель. КорректорВ. Бутяга!
Тираж 390 Подписное
ВНИИПИ Государственного комитета СССР по"делам изобретений и открытий
113035, Иосква, Н-35, Раушская наб, д. 4/5
Заказ 4737/15
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
Фосфорилированные трИметилизотиомочевины общей формулы !
R 7(я
Р >-k— - м(бн,)
З
З 2 где R — метил, этил, хлорметил или этоксигруппа;
R — этокси-,, Фенокси-, хлорфенокси-, 2,4тдихлорфенокси-, 2,4,5-трихлорфенокси- или
12 пентахлорфеноксигруппа;
Х вЂ” кислород или сера, обладающие инсектоакарицидной активностью.
Источники информации, принятые во внимание при экспертизе
1. Иельников Н; Н. Химия и технология пестицидов. "Химия", И,, 1975, с. 598.:.
10 2. Шрадер Г. Новые фосфорорганические инсектициды. "Иир", М., 1965, с, 160.
3. Алимов П. И., Левкова Л. Н. Изв.
АН СССР; сер. Хим., 1964, с.. 1889.