Способ определения галогена и галогеноводорода
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистических
Республик
,710910
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (61) Дополнительное к авт. свид-ву (22) Зая влено 04.04.77 (21) 2467939/23-26 с присоединением заявки .% (23) Приоритет (51)M. Кл.
С 01 В 7/00
G 01 N 21/ 4
Гваударствеииый комитет
СССР ио делам изобретений. и открытий
Опубликовано 25.01.80. Бюллетень М 3
Дата опубликования описания 25.01.80 (53) УДК
543.42.062: 546.
;.12 (088.8) (72) Авторы изобретения
Г. Ф. Дворко, А. М. Шликевич, В. К. Дубинина, Э. А. Пономарева и Т. Л. Первишко (7l) Заявитель (54) СПОСОБ ОПРЕДЕЛЕНИЯ ГАЛОГЕНА И ГАЛОГЕНОВОДОРОДА
Изооретение относится к аналитической химии и может применяться для определения концентраций галогеноводорода и галогена в органических растворителях, а также в хлорной промышленности, например для определения концентрации хлора и хлористого водорода при хлориро5 вании органических соединений для изучения кинетики разложения галогенорганических соединений, что необходимо для разработки эффективных стабилизаторов этих веществ, для тб контроля чистоты растворителей.
Известен способ определения галогена и галогеноводорода при их совместном присутствии путем титрования галогена раствором тиосульфита, а галогенводорода — раствором щело15 чи (1).
?1аиболсе близким по технической сущности и достигаемому результату к предлагаемому является способ определения галогена и галогеноводорода в форме (галоген-аниона) спектрофотометрическим методом (2) . Галоген определяют по собствешюму поглощению или по поглощению продуктов окисления некоторых органических веществ, а галогсноводород — по обесцвечиванию окрашенных комплексов металлов с красителями.
Однако известные методы анализа смеси галоген- галогеноводород в растворе отличаются значительной трудоемкостью, поскольку для определения концентраций галогена и галогеноводорода необходимо производить отдельные измерения. Эти методы недостаточно точны, особенно в случае большого различия концентраций анализируемых веществ. Известные методы применяются, как правило, в водных растворах, они практически не пригодны для определения малых количеств галогена и галогеноводорода при совместном их присутствии в органическом растворителе.
Цель изобретения — упрощение анализа и повышение точности определения малых количеств галогена и галогеноводорода в органических веществах при их совместном присутствии.
Цель достигается тем,. что к анализируемому раствору галоген-галогеноводород прибавляют окрашенный в зеленый цвет раствор трифенилвердазильного радикала, который при взаимодействии с галогеном или галогеноволородом
3 7l09I образуют вердазилевую сонь, растворы которой окрашены в сине-фиолетовый цвет. Обязатель-ным условием протекания этих реакций является применение избытка трифенилвердазила, взятого в 20 — 200%-ном избытке в присутствии ацетонитрила.
Взаимодействие трифенилвердазилов (1) с галогеноводородом приводит к образованию вердазилиевой соли (П) и лейковердазила (III) .
75 Р
IO
С l 1
С С N ., Ф,у
2 и +НА — -й + г1 МН
/ / / / 15
pb CH„pb CH РЪ
2 (1) РЬ
Я) (й)
Раствор (1) в ацетонитриле поглощает при
Лгпах =- 720 нм (e = 4330), а раствор (II) при Лгпах = 540 нм (e = 12170). Лейковердаэил в вид мой области не поглощает (в бенэоле Лп а„= 300 нм). Следовательно концентрацию галогеноводорода можно определять по изменению оптической плотности как раствора радикала, так и вердаэилиевой соли. Растворы (1), (II) подчиняются закону Ламберта-Вера.
В реакции с галогенами трифенилвердазилы превращаются только в вердазилиевую соль (И).
Ð4
С ь
"+х и х
1 2 ! и
N Ц+, } - () 35
/ /x / /x
ply си2рй Рь Сна РЪ
Из сопоставления схем (1) и (2) видно, что при взаимодействии с галогеном вердазил полностью превращается в вердазилиевую соль, 40 а в реакции с галогеноводородом — только на
50%. Это отличие дает возможность при помощи трифенилвердаэилов определять концентрации галогена и галогеноводорода при совместном их прису."ствии в растворе при условии, 45 что в обоих случах реакция протекает количественно.
Концентрация галогеноводорода в смеси вычисляется по формуле (ИХ)=(а. -n„>-Д„ )=Р.— —," — 1,(М где (I0) — начальная концентрация трифенилвердазила в растворе;
<>g) > ИЬ) — концентрация трифенилвердаэила . и вердазилиевой соли после реакции; 5
Ъ Ч П вЂ” оптические плотности анализируемой смеси при Лп,ах 720 и 540 нм, 6.1 и 2 — экстинкции вердазила и вердазилиевой соли соответственно.
0 4
Концентрация галогена вычисляется по формуле (1,У-(Тих-2(ИУ 4 I
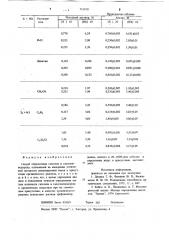
Результаты анализа с помощью трифенилвердазила специально приготовленных смесей галогеноводорода (HCI, HB> HJ) и галогена (Cl,, Br>, J,) в различных органических растворителях приведены в таблице.
Ошибки измерений обычно составляют 1 — 2%.
Метод позволяет измерять концентрации галогена и галогеноводорода в растворе при их содержании 10 4 — 10 М, Кроме трифенилвердазила для анализа смеси галоген-галогеноводород можно применять и другие вердазильные радикалы.
Пример 1. Анализ смеси HCI + Cl в хлорбензоле.
Смешивают 1 объем раствора НС! (2,34
10 4M) и CI> (0,430 10 4) в хлорбензоле с двумя объемами 5,97 М раствора трифенилвердазила в ацетонитриле, измеряют оптическую плотность смеси при 720 и 540 нм.
Концентрации галогена и галогеноводорода рассчитывают по вышеприведенным формулам.
Пример 2. Анализ смеси HB> + Вг в диоксане. . Смешивают 1 объем раствора HBr (1,08 10"4M) и Вг (0,485 10"4M) в диоксане с объемом 4,76 M раствора трифенилвердазила в ацетонитриле и определяют оптическую плотность полученной смеси при 720 и 540 нм.
Пример 3. Анализ смеси H3 + Э,) в бензоле.
Смешивают объем раствора НЗ (2,19.10 ") и 3 ((00,722.10"4M} в бензоле с тремя объемами 3,18 M раствора трифенилвердазила v.
CHqCN и определяют оптические плотности при
720 и 540 нм, Пример 4. Анализ смеси H3 + Ъ в ацетонитриле.
Смешивают 1 объем раствора Ж (0,52 10 4M) и 3 (2,32 10 4M) в ацетонитриле с тремя объемами 5,48 10 4 М раствора трифенил вердазила в CH>CN и определяют оптическиеплотности при 720 и 540 нм.
Избыток трифенилвердазила практически может находиться в пределах 20 — 200%. Нижний предел определяется точностью спектрофотометрического определения. Верхний— практической целесообразнос1ъю. В примерах описания изобретения этот избыток составляет,%:
1-100
2 — 50
3 — 80
Избыток трифенилвердазила в примере 4 около 200% (ошибка определения 2%), при меньшем избытке трифенилвердаэила резко увеличивается ошибка определения.
710910
НЭ + 3q. Однако когда концентрация иода заметно больше концентрации HJ, избыток реагента должен быть увеличен до 200%.
Применение трифенилвердазила дает возможность быстро и точно определять концентрацию галогена и галогеноводорода при совместном их присутствии.
Анализ смеси галоген-галогеноводород в органических растворителях с помощью трифенилвердазила
0,121
1,09
0,118+0,001
1,10+0,02
СН СИ
0,121
8,72
0,1 21+0 002
8,81+0,05
195
1,09
0,19520,002 1,0810,01
0,926+0,05
1,3910,02
8,92
0,936
8,92
1,43
Clq + HCI C6H6
1 75>0,02 1,77
1,13
8,99
С,Н,С1
5,71
1,13.1,22
2,25
Диок сан
8,34
2,95
6,31
2,43
5,18+0,03
4,27+0,03
0,3 20+0 003
0,317+0 004
5,24
0,324
3,12
СН, С!СН Cl 0,324
3,70 .0.02
0,1 849),001
3,64
0,188
0,145+0,001
8,42Ю,ОЗ
0,146
СН, CN
1,10+0,02
0,872 Ц),001
1,12
0,866
0,182+0,004
0,428+0,005
0,178 0,172+0,004
0,180
О 436+0,,002
О 435
0,440
Вг, + HBr Cq lk
Величина принимаемого избытка трифенилвердазила зависит от природы анализируемой смеси галоген — галогенводород и соотношения компонентов в этой смеси. Так, для анализа смеси HCI + Clz достаточно минимального избытка радикала, дпя HBr + Br лучшие результаты были получены при 50 — 100% избытках. Последнее справедливо и для смеси
1,17+0,01
3 45+0,01
1,11+0,02
2,28Ю,05
2,9710,05
6,25+0,04
8,90+0.01
8,83+003
4 42+0,01
9,06+0,07
5 66+0,06
1,24+0,02
8,25+0,08
838+0,06
2 41+0,01
710910
Продолжение таблицы
Анализ, М (X ) 20 (НХ) 10
0,770
6,24
0,760+0 005 6,18110,05
PhCI
0,232
2,08
0,230+0,002
0,258+0,002
2,05)".0,01
0,255
1,38+0,01
Диоксан
0 456
0,132
0,891+0,008
0,202
0,892
0,200+0,001
0,368
0,123
0,210
0,325
1,97
5,44
0,200+0,007
0,320+0,005
1,93+0,005
5,40+0,008 НЗ 1 1
0,586
2,43
0,590+0 005
2 40+0,03 з + H еН6
0,117
4,86
0,118+0,002 4,83+0,05
2,34
4,86
2,40+0,005
4,80+0,07
0,990+0,001 5,3310,07
5,40
1,03
1,36
2,34
1,36+0 02
0,838+0 004 2,34+0.03
4,17+0,05
0,834
4,16
Подписное
Тираж 565
ЦНИИПИ Заказ 8580/9
Филиал ППП "Патент", r. Ужгород, ул, Проектная, 4
Формула изобретения
Способ определения галогена и галогеноводорода, основанный на измерении оптической плотности анализируемой смеси в присутствии органического реагента, о т л и ч а юшийся тем, что, с целью упрощения анализа и повышения точности определения малых количеств галогена и галогеноводорода в органических веществах при .их совместном присутствии, в качестве органического реагента используют раствор трифенилвер0,130+0,002 0 455+0,005
0,366+0 002 0,125+0,002 дазила, взятого в 20 — 200%-ном избытке и определение ведут в присутствии ацетонитрила.
Источники информации, принятые во внимание при экспертизе
1. Дворко Г. Ф., Филинов Ю. П., Василькевич И. М. Сб. Реакционная способность органических соединений, 1975, 11, с. 847.
2. Бабко А; К., Пилипенко А. Т. Фотометрический анализ. Методы определения металлов. "Химия", 1974 (прототип).