Способ получения гидрохлорида оптически активных дауносаминилпроизводных антрациклинонов
Иллюстрации
Показать всеРеферат
ОП ИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (61) Дополнительный н патенту— (22) ЗаявлЕно 11.10.77 (21)2311601/2530649/23-04 (23) Приоритет 21.01.76 (32) 22.01.75
Соеоз Советских
Социалистических
Республик
«>724087 (51) М. Кл, 2
Г 07 Н 15/24//
А 61 К 31/70
Государствениь и хометет
СССР по делам изооретенмй и открытнй (31) 2691/75 (33) Великобритания
Опубликовано 25.03.80. бюллетень № 11
Дата опубликования описания 25.03.80 (53) УДК
547.455.07 (088.8) (?2) Авторы изобретения
Иностранцы
Федерико Аркамоне, Луиджи Бернарди, Бьянка (Италия) Пателли и Аурелио ди Марко
Иностранная фирма
"Сочиета Фармасьютичи Италиа С. и. А" (Италия), (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА ОПТИЧЕСКИ АКТИВН11Х
ДАУНОСАМИНИЛПРОИЗВОДНЫХ АНТРАЦИКЛИНОНОВ
Предлагается способ получения новых произ; водных антрациклинонов, обладающих ценными. фармакологическими свойствами.
Цель изобретения — получение новых полезных соединений, расширяющих арсенал средств воздействия на живой организм, способ основан на известной реакции образования гликозидной связи (1).
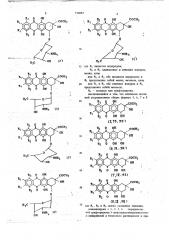
Описывается способ получения гидрохлорида новых оптически активных дауносаминилпроизводных антрациклинонов общих формул
1, .,2,2,3,3,4и4 »
11» О ОН сося» .ОН
К2 О ОН
Оп
СОСН
ОН соси, ОН
R2 0 ОН
Н с
Н»С (2) се (11
ОН
724087
СОСН соса> ; R2
0Н
Rz О ОН, О
10 нк (4) н с (2) н,с
15 где R> является водородом;
Ят и R3 одинаковые и означают водород, метил, хлор или Rq u Яз оба являются водородом и
R> представляет собой метил, метокси, хлор 20 или Яг и Ra оба означают водород и R2 представляет собой метокси;
R4 — водород или трифторацетил, заключающийся в том, что оптически активный антрациклинон общих формул 5, 6, 7 и 8
ООНЗ
ОН
СОСа>
0Н
ОН
30 (5;7S, 98) сОсау
0Н
0Н сосн>
R2 о он Оа(б 7Р., Ы)
R> О ОН
40 к о ) СОСН, ОН
45 а> О ОН ОН (7,7R, 9s) а> О ОН.
Е3 0 ОН
СОСН
ОН
СОСН
R2
az О Оа
Оп
Rz О Оа ОН
{s,7, Я ) 55 где Я,, Rq и Яз нмеюг указанные значения, конденсируют с 1, 2, 3, 6 тетрадеокси-4-0-т рифторацетил-3- гриф горацетамидолнксогекс-1-енпиранозой в безводном растворителе в нрн72408
5 сутствии и-толуолсульфокислоты с последующей последовательной обработкой полученных соединений метанолом, раствором О,lн. NaOH и О,lн. метанольным раствором HCI, В качестве растворителя обычно применяют безводные бензол или нитрометан. Целевой продукт выделяют известными приемами.
Приводимые далее примеры не ограничивают объема изобретения. Ссылка на дауномициноны относится к антрациклинонам, которые I Î имеют такую же конфигурацию, что и естественный дауномицинон (7$: 9$), и ссылка на 7,9-бис-эпидауномициноны — к антрациклийонам с 7R: 9R = конфигурацией. Продукты, получаемые в примерах, являются новыми соединениями за исключением самого антрацикл икона.
Пример 1. а-(-)-Дауносаминил-4-диметоксидауномицинон 4-диметоксидауномицин)-rHnpoXnopmp(1> Я =йг = Яэ = R4 — H) и p- (-)-Дау- 20 носаминил-4-деметоксидауномицинон (P-4-диметоксидауномицин)-гидрохлорид (1, В =йг-Вз= . =В4=Н).
К 1 г 4-деметоксидауномицинона в 200 мл
25 бензола добавляют 3 г 1,2,3,6-тетрадеокси-4-О-трифторацетил-З-трифторацетамидо.- 1.-ликсогекс-1-енпиранозы и 30 мг и-толуолсульфокислоты. Раствор в темноте нагревают 8 ч с обратной флегмой. Добавляют 0,1 мл пиридина
30 и раствор упаривают в вакууме. Остаток поглощают хлороформом и промывают водой и
5%-ным ИаНСО3. Растворитель упаривают в вакууме, остаток растворяют в 350 мл метанола и оставляют стоять на ночь при ком35 натной температуре. После отгонки растворителя остаток хроматографируют на 20 r силикагеля, причем сначала элюируют хлороформом и затем смесью хлороформ: ацетон (19:1); . при этом получают 0,6 г а-(-)-дауносаминил-4-деметоксидауномицинон- N-трифторацетат (1, В1=йг=йэ = Н,R4=COCF3) > т.пл. 155—
158 С, (а)" + 200 (с = 0,1 в диоксане), и 0,30 г P-(-)-дауносаминил-4-деметоксидауномицинон-N-трифторацетата (1, R> =Вг=йэ=Н,R4=
COCF3), т,пл, 148-150 С (а)го + 100 (с = 0,1 в диоксане). Соединение формулы 1 (R Вг Я3 Н, В4 = COCF3) растворяют в
40 мл 0,1 н. NaOH и 30 мин выдерживают при комнатной температуре. Раствор с помощью HCI доводят до рН 8 и экстрагируют хлороформом. После отгонки растворителя получают остаток, который поглощают небольшим количеством смеси хлороформ/метанол, добавляют 01 н. метанольный раствор HCI
55 до рН 4,5, после чего добавляют достаточное количество этилового эфира для осаждения . гидрохлорида а- (-) -дауносаминил-4-деметокси дауномицинона (4-деметоксидауномицин) (1,R, =
6
=Я =R =Я =Н) 035 г т m, 183 — 185 (а)
+210 (с =0,1 в CH3OH). Лз соединения 1 (Я,=йг=йэ=Н, R4 = COCF,) аналогичным образом получают гидрохлорид p- (-) -дауносаминил-4-деметоксидауномицинон (P-4-деметоксидауго о номицин) (2, R =R3 =R3 =R4 =H), (I3.) +124 (с =0,1 в этаноле).
Пример 2. а-(-)-Дауносаминил-4-деметокси-7, 9-бис-эпидауномицинон (а-7,9-бис-эпи-4-деметоксидауномицин) - гидрохлорид (2, В,=В,=RÇ=R4=Н) иP-(-)-дауносаминил-4"-деметокси-7,9-бис-дауномицинон (P-7,9-бисэпи-4-деметоксидауномицин) -гидрохлорид (2, Я1 Вг ВЗ В4 H)
Путем конденсирования 4-деметокси-7,9-бис-эпи-дауномицинона с 1,2,3,6-тетрадеокси-4-0-трифторацетил-3-трифторацетамидо- L-ликсогекс- l-енпиранозой, как описано в примере 1, получают а-7,9-бис-эпи-4-деметоксиI дауиомицин-й- трИфторацетат (2 R> =R3 =R3 =Н, R4 = СОСРэ), т.пл. 210 — 215 С (а)го -91 (с = 0,1 в диоксане) вместе с P-7,9-бис-эпи-4-деметоксидауномицин- N- трифторацетатом (2, R =R =83=Í, R4=СОСГ3), т.пл. 165-167 С (а) о -91 (с =0,1 в диоксане). Эти соединеь ния путем хроматографии на силикагеле при применении хлороформ: ацетон (80:20 по объему) в качестве элюирующего средства разделяют.
Последующий гидролиз соединений 0,1 н.
NaOH, как описано в примере 1, дает гидрохлорид а-7, 9-бис-эпи-4-деметоксидауномицин (2, В, =Вг=йэ=В4=Н) > т.пл. 205 — 207 С, (а), -80 (с = 0,1 в СН,ОН) и гидрохлорид P-7,9t
-бис-эпи-4-деметоксидауномицин (2, R3 =R3
=Вэ=В4=Н), т.пл. 186-187 С, (а) „о 250, (с=0,1 в СНЗОН).
Пример 3. 1-Метоксидауномицин-гидрохлорид (1, R =R4=H, Яг-Вз-ОСНэ) °
При проведении способа по примеру 1, но с применением l-метоксидауномицинона, полую> > 1го чают укаэанное соединение, т.пл. 195 С, (а)
+200 (с =0,1 в СН,ОН), выход 25%.
Пример 4. 4-Деметокси-l,4-диметилдауномицин-гидрохлорид (1, R,=R4=H, R,=R3
=CH3) .
При проведении способа по примеру 1, но при применении 4-деметоксй-l,4-диметилдауномищ4нона получают указанное соединение, тпл 183 — 185 С (а)го + -175 (с = О,l CH3OH), Выход 30%.
Пример 5. 4-Деметокси-!4-диметил-7,9R=R=H, -бис-эпидауномицин-гидрохлорид (2, R1 — 4—
Вг Вэ О С >3)
При проведении способа по примеру I„ но при применении 4-деметокси- 1,4-диметил-7,9бис-эпидауномицинона получают укаэанное соединение.
724087
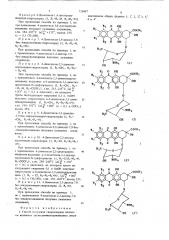
8 циклинонов общих формул 1, 1, 2, 2, 3, 3
4и4
Пример б. 4-Деметокси-1,4-дихлордауномицин гидрохлорид (1, я, =я,=Н я,=я,=С!)
При проведении способа по примеру 1, но при применении 4-демстокси-1,4-дихлордауно: мицинона получают указанное соединение, т.пл. 184 — 185 С (cL)" +175, выход 27% (с = 0,1 CHaOH).
Г1 р и м е р 7. 4-Деметокси-1,4.дихлор-7,9-бис-эпидауномицин-гидрохлорид (2, Я,=Я,=Н, Яг ="з =С!) ° 1О
При проведении способа по примеру 1, нс с применением 4-деметокси-1,4-дихлор-7,9-бис-зпидауномицинона получают указанное соединение.
Пример 8. 4-Деметокси-2,3-диметилдауномицин-гидрохлорид (1, Яф =CHa, Яг =Яг=
= R,==-Н).
При проведении способа по примеру 1, но R1 с применением 4-деметокси-2,3-диметилдауномицинона яьщеляют а-4-деметокси-2,3-диметил- 20 дауномицин-N-трифторацетат (1, R =СНЗ, Яг=
1
= R>=H, R4=COOF>), т.пл. 233 — 235 С, (а)
+181 (с = 0,1 в диоксане), из которого путем последующего гидролиза 0,1 í. NaOH получают гидрохлорид а-4-деметокси-2,3-диме- 25 тнлдауномицина (1, R =CHq, Яг — Яз — Я4-Н) т.пл. !90 — 192 С (а) го +180 (с = 0,1 в СНС!З) выход 35%, Г1 р и м е р 9. 4-Деметокси-2,3-диметил-7,9-бис-эпидауномицин-гидрохлорид (2, R> = 30
=СЕ!,, R, =Я; =R. Н) .
При проведении способа по примеру 1, но . с применением 4-деметокси-2,3-диметил-7,9-бис-эпидауномицинона получают указанное соедиК1 нсние. gC
Пример 10. 4-Диметокси-2,3-дихлордауномицин-гидрохлорид (1, R> =Cl, R =Я, =R4 = !
=Н) .
При проведении способа по примеру l, но с применением 4-деметокси-2,3-дихлордауно- 40 мицинона выделяют а-4-деметокси-2,3-дихлордауномицин-!".-трифторацетат (1, R =CI,R2=ЯЗ=Н, Я,=СОСЕ,), т.пл. 238 — 240 С (а)го + 170 (с = 0,1 в диоксане), из которого путем последующего гидролиза 0,1 и. МаОН получают 45 гидрохлорид а-4-деметокси-2,3-дихлордауноми- 1 1 цина (1, R, = Cl, R,=R>=R<=H), (а) „+180 (c = 0,1 в СН,ОН), т.пл. 258 — 260 С, выход 23%, П р н м е р 11. 4-Деметокси-2,3-дихлор-7,9- В бис-эпидауномицин-гидрохлорид (2, R> =С1, 50
R2 R3 R4 1!)
Прн проведении способа по примеру 1, но с применением 4-деметокси-2,3-дихлор-7,9бис-зпндауномицинона получают указанное соединение. 55
К3 О ОЕ
R1
5 сосн3
0Н
R3 0 ОН I
0
НЗС
ОН
К, î он сосп> 2
Н
ОН к, î on.сосн
ОН
Формула изобретения !. Способ получения гилрохлорида оптически активных лауносаминилпроизводных антраН) 724087
9 01" Н3
ОН
О ОН соса>!
0 Rl
NHQ
О ОН
coen) к О!
5 сосн
20 2
fg 73,9R) СОСН3
ОН в, о он
Eg О ОИ 0Н (У, zR,9/) к о он
21. сосн
ОН
ОН
О Он к, о он Ьн
Г У, 2. 1 -110.С0СН3
ОН
40 он !
ЦНИИПИ Заказ 478/46 Тираж, 495 Подписное
Филиал ППП "Патент, r. Ужгород, ул Проектная, 4 где R> означает водород;
R и R3 являются одинаковыми и означают водород, метил, хлор
1О или R, и R, оба означают водород и R представляет собой ме1ил, метокси, хлор или R, и йэ оба означают водород и R, означает метокси;
R4 — водород или трифторацетил, отличающийся тем, что оптически активный антрациклинон общих формул где R, R2 и Ra имеют приведенные значения, конденсируют с 1,2,3, 6-тетрадеокси-4-0-трифторацетил-3-трифторацетамидоликсогекс-1-енпиранозой н безводном растворителе в
45 присутствии П-толуолсульфокислоты с последующей последовательной обработкой полученных соединений метанолом, раствором 0,1 н.
Na0H и 0,1 н. метанольным раствором HCI.
2. Способ по и. 1, о т л и ч а ю щ и й50 с я тем, что в качестве растворителя применяют безводные бензол и нитрометан.
Источники информации, принятые во внимание при экспертизе
1. Кочетков Н, Химия углеводов. М., 55 Химия, 1967, с. 215.