6-ацетоксиметилен-3-оксо-2-окса-бицикло-/3,3,0/-окт-7-ен как промежуточное соединение в полном синтезе простагландинов и способ его получения
Иллюстрации
Показать всеРеферат
1. 6-Ацвтоксиметилен-3-оксо-2-окса-бицикло-
«,« »
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК () () ОПИСАНИЕ ИЗОБРЕТЕНИЯ
H «BTOPCKOMY CBNPETEllhCTBV
О О
° °
11
СН вЂ” Π— С вЂ” С
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2664445/23-04 (22) 20.09.78 (46) 28.02.85. Бюл. У 8 (72) А.А. Ахрем, Н.Ф. Бондарь, Е.В. Королева и Т.Н. Омельченко (71) Институт биоорганической химии
АН Белорусской ССР (53) 547.384(088.8) (56) 1. Заявка ФРГ У 2623184, кл. С 07, С 79/347, опубл. 1977 r.
2. S. Ranganatan et aI.> NitroethyIene as versatile keten eguiva-.
Ient, J. Amer. Chem. Soc., 1974, v. 96, р. 5261. (54) 6-АЦЕТОКСИМЕТИЛЕН-3-ОКСО-2ОКСА БИЦИКЛО (ЗэЗэ0)=0KT-7-ЕН
КАК ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ В ПОЛНОМ СИНТЕЗЕ ПРОСТАГЛАНДИНОВ И
СПОСОБ ЕГО ПОЛУЧЕНИЯ
4(»() С 07 D 307/83; С 07 С 49/633)
С 07 С 177/00
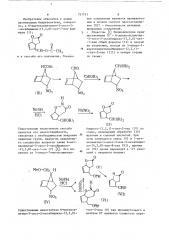
3 (57) 1. 6-Ацвтоксиметилен-3-оксо-2-окса-бицикло-(3,3,0)-окт-7-ен @opмулы
Н как промежуточное соединение в полном синтеэе простагландинов.
2. Способ получения соединения поп. 1, отличающийся тем, что 7-ацетоксиметилен-5-нитробицикло-(2,2, 1)-гепт-2-ен последовательно обрабатывают основанием и кислотой в среде алифатического спирта С(-С при температуре 0— (-10 С);
731731
Il
СН-o-C-(:.Н. по схеме сн(ов
НСОАс
СНО сн(ов, Х02 сш) ®
Н
N
МаОН
НС1
И® 2
Н 2
МЕΠ— СИ2 Н
NO2 (rv) Изобретение относится к новым производным бициклооктена, конкретно, к 6-ацетоксиметилен-3-оксо-2-оксабицикло-(3,3,0)-окт-7-ену формулы (1): о
1 и к способу его получения. УказанСущественным недостатком способа является его многостадийность, связанная с необходимостью введения защитных групп. Аналогом заявляемого соединения является также 6-метоксиметил-3-оксо-2-оксабицикло-(3,3,0)-окт-7-ен (U) P2) . Его получают из 5-нитро-7-метоксиметилСущественным недостатком 6- метоксиметил-3-оксо-2-оксабицикло-(3,3,0)ное соединение является промежуточным в полном синтезе простагландинов (ПГ) — биологически активных природных соединений.
Известны P) бициклические предшественники Пà — 6-диалкоксиметил-З-оксо-2-оксабицикло-(3,3,0)-окт-7-ены общей формулы (II) и способ их получения, исходя из 5-нитро-710 ацетоксиметиленбицикло-(2,2,1)—
-гепт-2-ена (III). в четыре стадии бицикло-(2,2, 1)-гепт-2-ена (IV) по схеме, включающей обработку (IU) щелочью и соляной кислотой. При этом получается смесь (V) и 7-метоксиметил-4-оксо-3-аэа-2-оксабицикло-(4,3,0)-нон-8-ена (UI), причем от (UI) далее переходят к (Ч) реакцией с нитритом натрия:
-окт-2«ена (U) как промежуточного в синтезе ПГ является сложность переНсОАс
HG0A
И О вЂ” — - — 3>
N02 c=o
НΠ— N
H (!иа) H
1.
0» -С=0
ОАС
ОАс
3 73173 хода от него к универсальному пред= шественннку Пà — альдегидолактону
Кори (VZZ) ° Этот переход теоретически может быть осуществлен в две стадии (омыление и окисление}, но требует специальных условий экспери. мента для сохранения двух лабиль— ных элементов структуры — двойной связи и лактонной группировки.
Целью данного изобретения является расширение ассортимента предшественников ПГ, использование коНастоящий способ получения б-ацетоксиметилен — 3 — оксо-2-оксабицикло-(3,3,0) -окт-7-ена (1) основан на 35 известной способности нитросоединений взаимодействовать с основаниями и кислотами. На этой же реакции основан и способ получения аналога (V). Однако, несмотря на то, что 40 взаимодействие нитросоединений с основаниями и кислотами известно, в.том числе и в ряду нитробициклогептанов отмечается неоднозначность протекания этой реакции в за- 45 висимости от строения нитробициклогептена. Наличие двойной связи в седьмом положении исходного (ТТТ) предопределяет возможность иного направления циклизации промежуточ- 50 ной гидроксамовой кислоты (ТТЕ а) с образованием продукта, отличного от заявляемого. Поэтому применение этой реакции в качестве способа заявляемого соединения (!} не являет» 55 ся очевидным.
Процесс осуществляют в среде полярного растворителя. В качестве торых упрощает путь перехода к конечным продуктам, Поставленная цель достигается способом получения 6-ацетоксиметилен-З-оксо-2-окса-бицикло-(3,3,0)—
-окт-7-ена путем последовательной обработки 7-ацетоксиметилен-5-нитробицикло-(2,2,1)-гепт-2-ена основанием и кислотой в среде алифатического спирта С -С при температуре 0-10 С.
Процесс протекает по схеме: растворителя используют спирт, преимущественно метанол, температуру реакции поддерживают в интервале 0-(-10 С) . Оптимальное время про. о текания процесса 4 ч. Затем реакционную смесь обрабатывают и целевой продукт выделяют хроматографированием на силикагеле.
Пример 1. К охлаждаемому льдом раствору (О С) 0,52 г (0,25 мМоль) 5-нитро-7-ацетоксиметиленбицикло-(2,2,1)-гент-2-ена в
4 мл метанола по каплям добавляют
10 мл 207.-ного раствора едкого нат— ра и перемешивают 3,5 ч. Полученный раствор прикалывают к 10 мл концентрированной соляной кислоты при температуре -10 С. Реакционную
0 смесь перемешивают в течение 45 мин, экстрагируют хлороформом, органическую фазу промывают водой, растворитель удаляют в вакууме, остаток хроматографируют на силикагеле
100/160 (и, элюируя продукт смесью бензол:этилацетат 6:4;
731731
Редактор П. Горькова
Техред С.Легеза
Корректор М.Демчик
Заказ 569/4 Тираж 384
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Подписное
Филиал ППП "Патент", r Ужгород, ул. Проектная, 4
Получают 0,15 г (ЗОЖ) хроматогра- фически чистого 6-ацетоксиметилен-З-оксо-2-оксабицикло-(3, 3, О) -окт-7-ена (1) Rg = 0,44 (пластинки
"Силуфол", бенэол: этипацетат 9: 1) .
ИК спектр, см : 1740 (-С- СН ), Н
Ф
О
1775 (С = О лактона). Мол. вес (масс-спектрометрически) 194. Вычисл но для C(оН1й 0,1 194 °
Пример 2. К охлаждаемому льдом с солью (-10 С) .раствору о
1,04 г (0,5 ммоль 5-нитро-7-ацетоксиметиленбицикло-(2,2,1)-гепт-2-ена в 15 мл изопропилового спирта по .каплям добавляют 20 мл 20Х-ного раствора едкого натра и перемешивают 3 ч. Полученный раствор прикапывают к 20 мп концентрированной соляной кислоты при температуре -10 С
Э и продолжают перемешивание полчаса.
Далее реакционную смесь обрабатывают как описано в примере 1. Получают 0,32 г (32X) хроматографически чистого 6-ацетоксиметилен«З-оксо-2-оксабицикло-(3,3,0)-окт-7-ена (1), идентичного вышеописанному об,разцу. .!
Пример 3. К охлажденному раствору 1,2 г (0,6 ммол) 5-нитро-7-ацетоксиметиленбицикло-(2,2, 1)—
-гепт-2-ена в 40 мл метанола при температуре Π— -3 С прикапывают о охлажденный до О С раствор метила. та натрия, приготовленный из 0,33 r
5 натрия растворением в 10 мп метанола. Реакционную смесь перемешивают ,3 ч. Полученный раствор охлаждают до О С и при энергетичном перемеб шивании прибавляют к смеси 1,7 М соляной кислоты и 20 мп метанола, поддерживая температуру реакционной смеси в пределах -10 — -5iC Перемешивание продолжают 1 ч при О С о и 1 ч при комнатной температуре.
Далее реакционную смесь обрабатывают как описано в примере 1. Получают 0,4 г (32X) 6-ацетоксиметилен-З-оксо-2-оксабицикло-(3,3,0)-окт-7-ена (1), идентичного вышеописанному образцу
Использование заявляемого 6-аце- токсиметилен-З-оксо-2-оксабицикло-.
-(3, 3,0)-окт-7-ена (1) в качестве предшественника альдегидолактона
Кори (1ПТ) позволяет осуществить короткий одностадийный переход от (1) к универсальному предшественнику (VliI). Этот переход осуществляют
30 путем стереоспецифичного омыпения".
6-ацетоксиметиленовой группы в соединении (I) в мягких условиях.