Способ получения -и -замещенных -фенилакрилонитрилов
Иллюстрации
Показать всеРеферат
0 П И С А- Н вЂ” -И -Е
ИЗОБРЕТЕНИЯ
Союз Советских
Социалистических
Республик
<">732250 (61) Дополнительное к авт. сеид-ву— (22) Заявлено 261076,(21) 2415954/23-04 (51)М. Кл.
С 07 С 121/70
С 07 С 120/00 с присоединением заявки Нов
Государственный комитет
СССР ио делам изобретений и открытий (23) Приоритет—
Опубликовано 0505.80. Бюллетень ¹ 17
Дата опубликования описания 0505.80 (5З> УДК547.339.2..07 (088.8) (72) Авторы изобретения
С.A.Áàðòàíÿí, P.Ñ.Âàðòàíÿí и P.P.Исраелян
Ордена Трудового Красного Знамени институт тонкой органической химии им.A.Ë.Ìíäæîÿíà AH Армянской CCP (71) Заявитель (54 ) СПОСОБ ПОЛУЧЕНИЯ P- И Р„Р -ЗУДДЩННЦК ф; ЭЕНИЛАКРИЛОНИТРИЛОВ
15
30
Изобретение относится к способу получения а — и в„в -з амещен ных ос -фенилакрилонитрилов, которые являются ценными полупродуктами при производстве лаков, каучуков и лекарственных препаратов.
Известен способ получения цианофенилметиленциклогексана конденсацией бензилцианида с 4-метилциклогексаноном в присутствии метилата натрия (1).
Однако выход целевого продукта невысок и составляет 49%.
Известен также способ получения (-замещенных oL -фенилакрилонитрилов конденсацией бензилцианида с пиперидонами-4 в присутствии алкоголята натрия в среде органического растворителя, например, метанола, при кипении (2). Выход целевогс продукта 4-(цианофенилметилен) -Nметилпиперидина при конденсации бензилцианида с 1-метил-4-пиперндоном составляет 52%.
К недостаткам известных способов относится низкий выход целевых продуктов.
Цель изобретения — повышение выхода целевого продукта.
Поставленная цель достигается способом получения В- и p Bl-замещенных Е-фенилакрилонитрилов общей формулы
С-С(С Н )С=14, 5 где R — водород, низший алкил, ВоЯ водород, низ1аий алкил, фенил или (л группа — составляет цикло2 пентилиден-, циклогексилиден-, 2,2-диметилтетрагидропиранилиден4,2,2-диметилтетрагидротиопиранилиден-4,1-метил-, 1,2-диметил-, 1,2,5-триметилпиперидилиден-4, конденсацией бензилцианида с соответствующим карбонильным соединением в среде органического растворителя при повьхаенной температуре, отличительная особенность которого состоит в том, что конденсацию проводят в двухфазной системе:: бензол - водный раствор NaOH в присутствии катализатора — триметил- или триэтилбензиламмонийхлорида. °
Предпочтительно использУют эквимолярное бензилцианиду количество
732250 катализатора при соотношении карбонильное соединение; бензилцианид катализатор = 2,5 ; 1 : 1 при проведении реакции в течение 20-24 при 65-70оС.
Предлагаемый способ позволяет сушественно увеличить выход целевого .продукта.
Пример 1. Цианофенилметиленциклогексан.
K смеси 4,7 & (0,04 моля) бензилцианида, 7,4 г (0,04 моля) триэтилбензиламмонийхлорида, 10 г 50Ъ водного раствора гидроокиси натрия в 50 мл бензола при перемешивании медленно, по каплям добавляют 9,8 г (0,1 моля) циклогексанона в 20 мл бензола. ф
По окончании реакционную смесь перемешивают 6-7 ч при 75-80 С, отгоняют бензол и добавляют эфир для осаждения катализатора. Фильтрат сушат над сульфатом магния. Эфир от- 26 гоняют и остаток перегоняют. Собирают фракцию при 157-159ОС/4 мм рт.ст.
Получают 5,2 r смеси цианофенилметиленциклогексана 97% и 1,3-дифенил2-кетимино-1-цианопропана 3% (ГЖХ). р
Полученную смесь заливают 2-3-х кратным (по объему) количеством смеси эфир : петролейный эфир = 1 : 1 и охлаждают до 0-5оC. Выпавшие кристаллы отфильтровывают, раствор центрифугируют, декантируют и отгоняют растворитель. После повторной перегонки получают 4,9 г продукта (65%) с температурой кипения 158-159оC/4 мм рт.oT °, п " 1,5482; d< 1,0221. МН„ найдено 61,320, вычислено 60,334.
Найдено, Ъ : С 85,70; Н 7,85.
С Н,N
Вычислено, % : С 85,29„ Н 7,61.
Пример 2. Цианофенилметиленциклопентан. 46
К смеси 4,7 г (0,04 моля) бензилцианида, 7,4 r (0,04 моля) триэтилбензиламмонийхлорида, 10 г 50% водного раствора гидроокиси натрия и
50 мл бензола при перемешивании медленно по каплям добавляют 8,4 r
,G,1 моля) циклопентанона в 20 мл бензола. По окончании реакционную смесь перемешивают 6-7 ч при 75-80 С о и оставляют на ночь. Затем экстрагируют бензолом, бензол отгоняют и добавляют эфир для осаждения катализатора. Фильтрат сушат над сульфатом магния. Эфир отгоняют и остаток перегоняют. Собирают фракцию при 161163oC/5 мм рт.ст. Получают 4,p r смеси цианофенилметиленциклопентана 82Ъ и 1,3-дифенил-2-кетимино-1-цианопропана 18Ъ (ГЖХ). Полученную смесь заливают
2-3-х кратным (по объему) количеством d0 смеси эфир : петролейный эфир = 1 : 1 и охлаждают до 0-5оC.
Выпавшие кристаллы отфильтровывают, раствор центрифугируют, декантируют и отгоняют растворитель. После 45 повторной перегонки получают 3,9 r цианофенилметиленциклопентана (54%) с температурой кипения 162-163 С/5 мм рт,ст.;пЯ 1,5588, d„ 1,0221. МН найдено 56,866, вычислено 55,716.
Найдено, % : С 85,57; Н 7,58.
Н„, Н.
Вычислено, % : С 85,25; Н 7,10.
Пример 3. 4-(Цианофенйлметилен)-2,2-диметилтетрагидропиран.
К смеси 4,7 г (0,04 моля) бензилцианида, ?,4 r (0,04 моля) триэтилбензиламмонийхлорида, 10 г 50Ъ водного раствора гидроокиси натрия добавляют 122,8 г (0,1 моля) 2„2-диметнлтетрагидропираноца-4 в 20 мл бензола. По окончании реакционную смесь перемешивают 6-7 ч при 75-80 С и оставляют на ночь. Затем экстрагируют бензолом, бензол отгоняют и добавляют эфир для осаждения катализатора, фильтрат сушат над сульфатом магния. Эфир отгоняют и остаток перегоняют. Собирают фракцию при 144146 С/3 мм рт.ст.
Получают 7,5 г смеси 4-(цианофенилметилен)-2,2-диметилтетрагидропирана 96Ъ и 1,3-дифенил-2-кетимино1-цианопропана 4% (ГЖХ). Полученную смесь заливают 2-3-х кратным (по объему) количеством смеси эфир петролейный эфир = 1 : 1 и охлаждают до 0-5оC.
Выпавшие кристаллы отфильтровывают, раствор центрифугируют, декантируют и отгоняют растворитель, После повторной перегонки получают
7,2 г продукта (80,5Ъ) с температ,.:— рой кипения 144-145 oC/3 мм рт. ст.; и 1, 533 3, dq 1, 0372. МНвнайдено
68, 048, вычислено 66, 595.
Найдено, Ъ : С 57,78; Н 7,81. д Hn,ON
Вычислено, Ъ : С 57,27; Н 7,49.
Пример 4, 4- (Цианофенилметилен) -N-метилпиперидин.
К смеси 4,7 r (0,04 моля) бензилцианида, 7,4 г (0,04 моля) триэтилбензиламмонийхлорида, 10 г 50% водного раствора гидроокиси натрия и
50 мл бензола при перемешивании медленно, по каплям добавляют 11,3 г (0,1 моля} N-метилпиперидона-4 в
20 мл бензола. По окончании реакционную смесь перемешивают 6-7 при
75-80оС, я оставляют на ночь. Затем экстрагируют бензояом, отгоняют бензол, добавляют эфир для осаждения катализатора.
Фильтрат сушат над сульфатом магния. Эфир отгоняют и остаток перегоняют. Собирают фракцию при
155-157oC/2 мм рт.ст.
Получают 5,3 r смеси 4-(цианофенилметил)-N-метилпиперидина 95Ъ и 1,3-дифенил-2-кетимино-1-цианопропана 5% (ГЖХ).
Полученную смесь заливают 2-3-х кратным (по объему) количеством
732250 смеси эфир : петролейный эфир =
1 : 1 и охлаждают до 0-5ОC.
Выпавшие кристаллы отфильтровывают, раствор центрифугируют, декантируют и отгоняют растворитель. Посл повторной перегонки получают 5 r продукта (60%) с температурой кипе ния 156 -157 С/2 мм рт.ст.; п в1,5618, d4 1,0539. MR y найдено 65,307, вы- чйслено 64,274.
Найдено, %. С 79,48; Н. 7,73;
С.ц Н„,на
Вычислено, В г С 79,25; Н 7,55.
Температура плавления гидрохлорида 192-193 С.
Найдено, В : CI 14,20; Ы 11,83;
С 67,921 Н 7,02.
С„, Н„ Ы,C1Вычислено, Ъ:CI 14,?О; N 11,67;
С 67,64; Н 6,84, Пример 5. 4-(Цианофенилметилен)-1,2-диметилпиперидин.
К смеси 4,7 r,(0,04 моля} бензилцианида, 7,4 г (0,04 моля) триэтилбензиламмонийхлорида, 10 г 50В водного раствора гидроокиси натрия и
50 мл бензола при перемешивании медленно, по каплям добавляют 12,7 r (0,1 моля) 1,2-диметилпиперидона-4 в 20 мл бензола. По окончании реакционную смесь перемешивают 6-7 ч при 75-80 С и оставляют на ночь. 3атем экстрагируют бензолом, бензол отгоняют, добавляют эфир для осаждения катализатора.
Фильтрат сушат над сульфатом магния. Эфир отгоняют и остаток перегоняют. Собирают фракцию, кипяшую при
158-160ã. C/2. ìì рт.ст.
Получают 6,4 г смеси 4- (цианофе нилметилен} -1,2-диметилпиперидина—
94% и 1,3-дифенил-2-кетимино1 -цианопропана 6% (ГЖХ).
Полученную смесь заливают 2-3-х g кратным (по объему) количеством смеси эфир : петролейный эфир = 1 : 1 охлаждают до 0-5ОC. Выпавшие кристаллы отфильтровывают, раствор центрифугируют, декантируют и отгоняют растворитель. После повторной перегонки получают 6 г продукта (66%) с температурой кипения 158-159 С/2 мм рт.ст., n 1,5368, 64 1,0317.MR найдено 70,256; вычислено 69,892.
Найдено, В : С 79,98; Н 8,13. ® Cqy Hqe Ng.
Вычислено, %: С 79,65; Н 7,97.
Температура плавления гидрохлорида
212оС
Найдено, % : CI 13,651 1Я 10,79; 5 С 68,84; Н 7,39.
С„з Н„, CI.
Вычислено, % :CI 13,52;N 10,67;
С 68,57; Н 7,24.
Аналогично получены остальные со)() единенияее
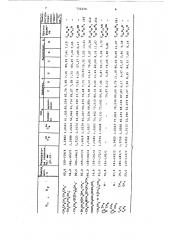
Физико-химические свойства по., ченных соединений приведены в таблиц е
732250
СЧ Р1
Л LA
СЧ СЧ
04 и й
Ф о х х
Ф Ф о CJ
4О
СЧ
04
04
04 х
I ь
1 1 I
Я
С е х ьЪ
Я Ф о
0 с с х
Ф ь
4Р х н
1ч
;>, а 441 ао Ф
РЪ с
СЧ л
Сс
Ю с л л
Ю IA
Л! >О ь с
Сс. Сс
Сс л с
Ч2
00 с
lA о
Ц
v х о
lO л с с
Сс С
C) 4СЪ с
Сс
РЪ
Р) ь
IA
Ю ь
LA
CO с
ОЪ 44Ъ
N Р4 с
ССЪ ЦЪ
00 00
4>Ъ
4О с
О\
Сс
Ю
Ю с о
Ю аО с
С>
Сс аО с с
CO л с л
Л4
4О С"Ъ л ь
4 1
lA, СЧ с
ОЪ !
СО
lA 00
00 IA с с
1 !
«4
CO ь
РЪ
4 с
Сс
СЧ л ь
С л с
Ю Сс
4СЪ ь с
lA IA
СО 00
Ю
4О с
Ю
РЪ
IO ь
Сс
С0
СО
Сс с
1А Ф
РЪ ь
C)
I
СО с
Ch (! и хо ьй 4О
РЪ «4
РЪ 1 с с
О 4>Ъ iO lA
Ю
Л4
IA ь
CA
СЧ ,ОЪ
С0 с
О\
>О
СЧ :Р
Ю с
РЪ
ОЪ
4О л
°, CO
\О
О 4О
Ю
РЪ CD
° «(Ц;
ЧЭ 4СЪ
СО cI
С> с
Сс
С>
Р Ъ ь
ОЪ
1О
iO аА
СЧ
С>
ln
РЪ
РЪ ь
С Ъ (С>
«4
СО
Сс
Сс
Э
Ц
CC хо х
Ю
О\
4>Ъ ь
iA
ОЪ
РЪ ь3 ь
СО iO
Л СЧ
СЧ N
СЧ СЧ о ю с ь л л
СЧ
Сс
РЪ
Ю с л
ОЪ
С Ъ
IA
Ю ь ч
С !
РЪ
Ю с л
РЪ
4О
Ю с
Л4
СО
СЧ аО
Ю ь
Л4
РЪ
СЧ
РЪ
Ю ь
° 4
СО
4СЪ
Ю ь
РЪ
С Ъ
Ю ь л
00 CO
° Ф 4С)
44Ъ LA ь с
«4 !
4>Ъ с
СО
iO
РЪ
Щ л
IA
IA Ф
IA с л
C)
tA
1 с
IA ь
«4
lA
IA
РЪ
lA с
СЧ
° "4
4О л
<У\
lA ч
РЪ
\О Ф
Л4
4>Ъ Ф
РЪ
СЧ
1
C)
° Ф с
РЪ
IA цО
1
00 «4!
lA 4О л
СЧ
СЧ
Ю
4СЪ л
РЪ с
СЧ
«4
С> л
С Ъ
01
°
° I
ОЪ л
Ц о
5 000 а.Х о о с> с.
4С4 чУ Ю
lA 0O
С>
4 Ъ
С> с
Ю (Ч
444 444 х в х х
О О о т
CJ
I,! 46 1 1 !эа! хохи
Л! ахМо
Ф 01 Э Х Ц найc:r х
1 Х йх
444 Э °
f44 $ I4 на
III CIQ A
Г
cJ
04 х о
04 х х о> CJ х
04
-о х х
CJ
04 х
СЭ
Ф х, CJ
CJ
C)
404 х о х о
I о х
CJ
1 х х и
04 х
CJ
44 х
Ю
04
Х CJ
04 х х о
1 б
Я
4 л4 р
Б
03
Х 4
С х ,Св 0Ъ
04 х х ,4 С.4 О
732250
Формула изобретения
R„, СС(С Н )C==N
Составитель M.Måðêóëoâà
Редактор С.Тимохина Техред М.Петко Koppeктор И.Муска
Заказ 1533/2 Тираж 495 Подписное
ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д.4/5
Филиал ППП Патент . г.Ужгород, ул.Проектная,4
Способ получения ь- и p p.- çà1 мещенных ot --фенилакрилонитрилов общей формулы где я — водород, низший алкил у 1 з водород, низший алкил, фенил или группа С
Rq
l составляет циклоR пентилиден-, циклогексилиден-, 2,2-диметилтетрагидропиранилиден-4, 2,2-диметилтетрагидротиопиранилиден-4, 1-метил-, 1,2-диметил-, 1,2,5-триметилпиперидилиден-4, конденсацией бензилцианида с соответствующим карбонильным соединением в среде органического растворителя при повышенной температуре, о т л и-. ч а ю шийся тем, что, с целью повышения выхода целевого продукта, конденсацию проводят в двухфазной системе: бенэол — водный раствор
Na0H в присутствии каталиэатора— триметил- или триэтилбензиламмонийхлорида.
2, Способ по п.l о т л и ч а ю р шийся тем, что конденсацию проводят при 65-7Оос и малярном соотношении карбонильное соединение: бенэилцианид : катализатор, равном
2,5 : 1 : 1.
Источники информации, принятые во внимание при экспертизе
1. An Ker R.М., Cook A Í., Chem. Soc. 1948, 806
2, Lee С.М., Beckett A.H., Sugden J.Н., Tetrahedron, 22,2721, 1966.