Способ получения 2-арил/алкил/ бензазолов
Иллюстрации
Показать всеРеферат
° >
ОП И " "В
Союз Советских
Социалистических
Республик
«ц732259
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (61) Дополнительное к авт. свид-ву— (22) Заявлено 2806.77 (21) 2500074/23-04 с присоединением заявки йо (23) Приоритет— (51) И.Кл
С 07 0 235/18
С 07 О 235/20
С 07 l3 263/56
С 07 О 277/66//
A 01 И 9/22
А 61 1 31/415 (S3). 4 ",547. 781.785.07 (088. 8) Государственный комитет
СССР по деяаи изобретений и открытий
Опубликовано 050580. Бюплетень И9 17
Дата опубликования описания 050580 (72) Авторы изобретения
Б.Х.Стрелец, О.Г.Акулина, Л,С.Эфрос и Ю.И.Акулин (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ 2-АРИЛ (АЛКИЛ) БЕНЗАЗОЛОВ
1» / илаИэобретение относится к способу получения 2-арил (алкил) бенэазолов как известных, так и новых, которые могут использоваться в качестве моно- 5 меров и красителей, лекарственнЫх препаратов и оптических отбеливателей, инсектицидов и сцинтилляторов.
Известен ряд методов полученйя
2-3амещенных бензазолов. 10
Известен способ получения бензимидазолов взаимодействием о-фенилендиамина с карбоновыми кислотами при нагревании в соляной кислоте f l) .
Однако этот метод пригоден только для получения 2-алкилзамещенных бенэазолов.
Более усовершенствованным способом получения 2-замещенных бенэазолов является метод, по которому 2-алкили 2-арилбензазолы получают с хорошими 20: выходами при нагревании о-фенилендиаминов, о-аминофенолов и о-аминотиофенолов с карбоновыми кислотами в полифосфорной кислоте при 200-250о С (2).
Недостатком способа, является ограниченность его применения из-за возможных окислительных побочных процессов в полифосфорной кис лоте при высокой температуре, например,в случае нитропроиэводных, след- 30 ствием чего может быть невысокое качество продуктов.
Цель изобретения — упрощение технологии процесса, повышение качества продукта, и расширение ассортимента
2-арил(алкил)бенэазолов.
Поставленная цель достигается тем, что 2-замещенных бензола формулы Ж А КИ,О,5, R,R -Н,NH2i0CHr,,NO,ÑOÎÍ, получают вз аимодействием о-фениленциаминов, о-аминофенолов или о-аминотиофенолов с хлорангидридами карбоновых кислот при 120-230 С в амидных растворителях, с. выделением целевого продукта при охлаждении реакционной массы до 0-20 С, преимущественно
732259 при соотношении исходных реагентов ,):)-):1,2.
И качестве растворителя используют, налример диметилформамид, диметилацетаммд, N-метилпирролидон, гексаметилтриамид фосфорной кислоты в количестве 50-100 мл на 0,1 моля исходного хлорангидрида. Изменение в соотношении исходных продуктов (от 1:1 до
1:2 и 2:1) не приводит к повышению качества. Уменьшение количества растворителя нецелесообразно из-за увеличения продолжительности реакции вследствие гетерогенности и понижения качества продуктов, увеличение расхода .. растворителя ведет к снижению выхода.
При температуре ниже 120 С реакция о сильно замедляется, верхний предел ограничен температурами кипения растворителей и воэможностью протекания побочных реакций. Без охлаждения реакционной массы после проведения реакции выход конечного продукта уменьшается, нижний предел охлаждения ограничен температурой замерзания растворителя и относительно малой зависимостью растворимости конечных продуктов от температуры при температуре ниже О С.
Предлагаемый способ позволяет получать чистые продукты непосредственно из реакционной смеси с высокой температурой плавления, в то время как в известных способах аналогичные или более низкие точки плавления целевых соединений получают только после дополнительной их очистки.
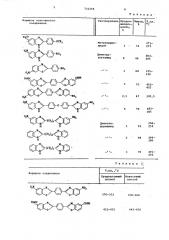
В табл.1 и в примерах представлены некоторые продукты, полученные по предлагаемому способу. В табл.2 представлены сравнительные данные по
1 чистоте продуктов по предлагаемому способу прямо из реакционной смеси и аналогичных продуктов, полученных известными способами с последующей очисткой, например,перекристаллизацией.
Из табл. 2 можно сделать вывод, что полученные по предлагаемому способу соединения по чистоте не только не уступают,но и превосходят аналогичные соединения, полученные известными способами.
Пример 1 ° Получение б-нитро2-(tl-нитрофенил) бенэоксазола. При охлаждении растворяют 20 г (0,122 моль) 2-амино, 5-нитрофенола в 100 мл диметилацетамида. В полученный раствор загружают 25 r (0,135 моль) и-нитробенэоилхлорида.
Охлаждение снимают, реакционную массу нагревают до кипения, Полученный раствор кипятят в течение 5 ч ° Выпавший при охлаждении до 20 С ! осадок отфильтровывают, прсмывают водой и сушат, Получают 20,9 г (60%) б-нитро, 2-(п-нитрофенил) бенэоксазола, т.пл.
2 14-215 С.
Найдено, %: N 14,9.
С1 нмКзО
Вычислено, %1 N 14,7.
Ф
Пример 2. Получение 2,2-(1,4-фенилен(бис)-5-нитробензоксаэола).
В 100 мл диметилформамида растворяют
20 r (0,,122 моля) 2-амино, 4-нитрофенола н при перемешивании загружают ь.
13,7 r (0,068 моля) терефталоилхлорида.
Реакционную массу нагревают до кипения в течение б ч. Выпавший при охлаждении до 20 С осадок отфильтровывают, промывают водой и сушат.
Получают 21 5 r (76%) 2, 2-(1,4 3р -фенилен (бис) -5-нитробензоксазола), т,пл. 370-372
Найдено, %: N 13,9.
С, Н„о Н,,о .
Вычислено, %: N 14,0.
2 .)
Пример 3. Получение 2-(m-нитрофенил) -бенэимидазола. В 50 мл .диметилацетамида растворяют 10,8 r (О, 1 моля) -фенилендиамина, при перемешивании и охлаждении до О С прибавляют 18,6 r (0,1 моля) m-нитробензоилхлорида, после, чего реакционную массу греют при 120 С 8 ч, охлаждают до О С и отфильтровывают.
Осадок промывают водой, сушат.
Получают 16,3 r (78%) 2-(m-нитрофенил) бенэимидазола с т.пл. 204-206.
Найдено, %: N 14,4.
С1э Чя И О„
Вычислено, % N 17, О .
4р. Пример 4. Получение 5-яитро-2- (tl-нитрофенил) бензимидаэола. В
50 мл гексаметилтриамида фосфорной кислоты растворяют 15,3 г (0,1 моля)
4-нитро-о-фенилендиамина, при охлаждении добавляют 18,бг(0,1 моля)
tl-нитробензоилхлорида, после чего реакционную массу нагревают до кипения (232 С) 1 ч, охлаждают, отфильтровывают выпавший осадок, промывают растворителем и водой, 5р сушат.
Получают 22,5 г (80%) 5-нитро, 2-(n-нитрофенил) бензимидаэола, т.пл.
55 360-362о
Найдено, %: N 19,7.
С > н м4о
Вычислено, %: N 19,8.
732259 Таблица
Формула полученного соединения
Растворитель Продолжительность, ч
НС0 X осн, 1
/X мо, Н
Х мо, О К
/1
0 Н 1 11 йО,. „-«Ч;, Д (сн,)„
Н H
" (сн,), Я н
Метилпирролидон
271
74 273
30 344 305
Диметили етамид
60 235236
52 452455
47 320,5
2,5
56 182185
° !
250
92 252
Диметилформамид
84 299300
° °
76 291-
292
Таблица 2
К02
370-372
358-360 .МЗСООК
445-450
452-455
360-362
357-358
НМ И
Н
245-24 7
204-?06
303-305
274-276
Формула изобретения
ИЛИ
, О О - - о R
Составитель Г.Жукова
Техред Н. Ковалева Корректор В,Синицкая. Редактор Н.Кравцова
Заказ 1534/3 Тираж 495 Подписное
ЦНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП., Патент, г. Ужгород, ул, . Проектная, 4
1 ° Способ получения 2-арил (алкил) 25 бенэазолов формулы
<АЕ Х-КН,О,З; R R -Н,NH,ÎÑÍ N0 (QGH;
35 на основе о-фенилендиаминов, о-аминофенолов или о-аминотиофенолов,с приме- нением полярного растворителя при 40 нагревании с выделением целевого продукта, отличающийся тем, что, с целью упрощения технологии процесса, повышения качества продукта и расширения ассортимента, 2-арил(алкил) бенэаэолов, о-фенилендиамины, о-аминофенолы или о-аминотиофенолы подвергают взаимодействию с хлорангидридами карбоновых кислот, в качестве полярного растворителя используют амидный растворитель, процесс ведут при 120-230 и выделение осуществляют при охлаждении реакционной массы до 0-20 С.
2..Способ по п,1, о т л и ч а ю шийся тем, что исходные реагенты используют при соотношении 1:1 — 1:1,2.
Источники информации, принятые во внимание при экспертизе
1„ PhiIIips М.А., I. Chem, Soc.
1928, 2395, 2. Hein D.W. I Am.Chew. Sac. 1957, (79 427-429.