Ионоселективный электрод для измерения концентрации тетрафенилборатаниона
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕПЛЬСТВУ
Союз Советских
Социалнстйческих
Яеслублик
<1>748221 (61) Дополнительное к авт. свид-ву (22) Заявлено 190578 (21) 2618140/25 с присоединением заявки No (51)М. Кл.
G 01 N 27/30
Государственный комитет
ССС Р но делам изобретений н открытий
Ф (23) Приоритет
Опубликовано 1 07,80. Бюллетень N9 26 (53) УД(543.257 (088.8) Дата опубликоваии я Ьписаиия 18.07,80 (72) Авторы изобретения
A.À. Пендин н П.К. Леонтьевская
Ордена Ленина и ордена Трудового Красного Знамени государственный университет им. A.А. Жданова (71) Заявитель (54) ИОНОСЕЛЕКТИВНЫЙ ЭЛЕКТРОД ДЛЯ ИЗМЕРЕНИЯ
КОНЦЕНТРАЦИИ ТЕТРАФЕНИЛБОРАТ-AHHOHA
Изобретение относится к средствам потенциометрического контроля жидких сред, а именно водных растворов на содержание тетрафенилборат-аниона и может найти применение в аналитичес- 5 кой химии водных растворов солей тетрафенилборат-аниона, а также растворов солей К, и, GS, А и четвертичных аммониевых оснований.
Предлагаемый электрод термодинами-16 чески обратим к тетрафенилборатаниону (BPh ), потенциал на котором возникает в результате окислительновосстановительных процессов на благородном металле с участием катионов 15 труднорастворимой соли, в условиях равновесия фаза постоянного состава данной соли — раствор (1) .
Известные ионоселективные электроды не позволяют определять концентра- 20 цию тетрафенилборат-ионов с достаточной точностью.
Наиболее близким по природе аниона, селективность к которому наблюдается, является электрод.с мембраной25 из органического полимерного материала, пластифицированного полярными компонентами, способными селективно сольватировать большие органические катионы и анионы- f2) . 30
Известны электроды с мембраной из поливинилхлорида, -пластифицированногс диметилолемамидом, и найлона, пластифицированного фенолом, чувствительные к концентрации BPh4 .
Недостатком известных электродов является узкий интервал составов растворов, внутри которого электроды обладают чувствительностью к концентрации Врал г 10 †. 10 М в случае электрода с мембраной из поливинилхлорида и 10 -10 M в случае электрода с мембраной из найлона. Кроме того, зависимость электродного потенциала этих электродов от логарифма концентрации
BPh4 составляет менее 50 мв, что свидетельствует о неполной электродной функции вследствие низкой специфичности электродов.
Цель изобретения — повышение специфичности электрода и расширение диапазона измерений — увеличение интервала концентрации солей BPh внутри которого сохраняется полная электродная функция.
Поставленная цель достигается тем, что в качестве чувствительного элемента (электродоактивного материала) электрода используется гетерогенная система, состоящая из фазы постоян748221
ЬО
65 ного состава, кристаллической соли тетрафенилбо >ата диэтилферрицения ((С2 Н )2 Fec) ) в нитробензоле, нанесенная на инертный металл, например, платину.
Кристаллическую соль (Cz H>) Fec
2 5 2
BPh4 получают при добавленйи к водному раствору перхлората диэтилферрицения((С2 Н )Рес СР04 ))водного раствора тетрафенилбората натрия (йаВРЬ ).
Количество компонентов гетерогенной системы подбирается таким образом, чтобы обеспечить присутствие в ней кристаллов (С2 Н5) Fec BPh4, при этом достигается высоковяэкое состояние гетерогенной системы. Кроме того, количество (c2 н )2 Fec должно равнять- 5 ся или превышать количество нитробен- эола..Состав гетерогенной оистемы следующий, sea.%: (C2 Н5 ) Z F ee S P h4 30-35 (С2 Нз )2 Fec 35-35 20
Нитробензол 35-30
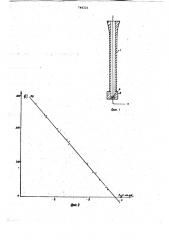
На фиг. 1 приводится предлагаемый электрод, общий вид, на фиг. 2 — зависимость ЭДС от ВВСВоЬ ; на фиг. 3— зависимость ЭДС (1) oz kgCBPh4 в трехкомпонентных водных растворах, на фиг. 4 приводятся кривые потенциометрического титрования растворов йаВРЬ4 растворами определенных солей.
Электрод содержит фторопластную трубку 1, фторопластную гайку 2 с резьбой, инертный металл (платина) 3, гетерогенную систему 4. . Пример . Берут 10 мл 0,3 М раствора перхлората серебра, содержащего хлорную кислоту в концентрации
1 М и разбавляют его водой до 100 мл.
В полученный раствор вносят 1,5 r (C2 Н5 )> Fec. Реакционную смесь интен(С2 H g)2 Fec ВРН4
Раствор в орга- Водный ническом раст- раствор ворителе
Исследование электродов проводят в гальваническом элементе 1:
Стеклянный Исследуе- Гетероэлектрод с мый генная Pt натриевой раствор система функцией (i),Потенциалы электродов в бинарных водных растворах NaBPh4 в интервале концентраций последнего 4 10 -1 10 M устанавливаются в течение 1-2 мин, показания отдельных образцов электров совпадают в пределах «+ 2 мв, в еделах этой погрешности показания воспроизводятся при перенесении электродов из растворов с большим содержанием йаВРЬ4 в растворы с меньшим содержанием соли и обратно.
Величина ЭДС гальванического элемента, составленного из электродов с полной тетрафенилборатной и иатровой функцией равно:
Е = Е + 2VPgO- + (йаВРЬ4), сивно перемешивают в течение 2-3 ч. За этот промежуток времени происходит количественное окисление (С2 Н5)2 Fec. Затем реакционную смесь отфильтровывают от металлического серебра и (C2 H5)2 Fec. Фильтрат разбавляют водой до концентрации (С2 Н5 )2 Fec С 004 1; 5 10 М. К одному литру фильтрата медленно добавляют
150 мл раствора NaBPh4, концентрацией 0,01 M. Из раствора выпадает мелкокристаллический осадок (C H5)Z FecBPh4 голубого цвета. Кристаллы отделяют от маточного раствора, многократно промывают. водой и высушивают при комнатной температуре над хлористым кальцием.
Смешивают 0,05 г (С2 Н5)2 Fec c
0,05 r нитробензола и к смеси при тщательном перемешивании добавляют
О, 04 г сухой соли (С2H5)2 FecBPh4.
Полученную оДнородную массу перено- . сят на инертный металл электрода.
Количество гетерогенной системы, наносимое на 1 см поверхности инертного металла, составляет 0,12-0,14 г.
Гетерогенная система при условии ее хранения при -5ОС в темноте в бескислородной атмосфере сохраняет свои свойства в течение 10 сут.и более.
Работа предлагаемого электрода реализуется за счет равновесной электрохимической реакции окисления (восстановления) (C> Н5) Fec ((С Н5) Fec ) на инертном металле при равновесии растворения (С2Н5)2 FecBPhgx в жидкой части гетерогенной системы и водном растворе, содержащем.ион ВРА . Электродная реакция следующая: (Cg Н5)2 FecBPh4 е(Рt)
Кристаллическая фаза
I где Е= 5 - РРЬ-,Ф ; стандартный потенциал стеклянного электрода с натровой функцией, Р— стандартный потенВРЬ„ циал электрода, обратимого к тет.рафенилбората аниону.
2 3RT
V = = 55 М44 44 Н 25 С, 2F а, t(NaBPh4 ) — средняя активность тетрафенилбората натрия.
В связи с тем, что данные о коэффициентах активности NaBph a водных растворах в литературе отсутствуют, область электродной функции определялась по зависимости ЭДС гальванического элемента от концентрации NaBP4
На фиг. 2 приводится зависимость ЭДС оа сясьоь4, проаэаопааа (- .)
4 дЕ(f) а 0Я 7Р 4 т
748221 сохраняет постоянное значение и в следуемом интервале концентрации соли NaBPh4 и равна (11522) мв. Последнее указывает на незначительное отклонение от единицы средних ионных коэффициентов активности NaSPh4 в интервале концентрации 10 2 — 104 М.
Стандартный потенциал стеклянного электрода, определяемый путем измере-. ния ЭДС гальванического элемента, со ставленного из стеклянного электрода с натровой функцией и хлорсеребряного электрода в растворах с известной активностью хлористого натрия, составляет (332 1) мв. Стандартный потенциал электрода, обратимого к BPh4, рассчитанный по формуле: РВр, = Е—
- P g - 2Y Lg CBPh4, Равен (-115>3) мв.
Значение ЭДС (1), равное (278i2)Ms, соответствует концентрации NaBPh4 в растворе: (4 0,2) ° 10 2 М, значение
ЭДС (1), равное (-18+2) мв, соответствует концентрации йаВРЬ4 ..(1 0,05)к
1 10 М.
Проверка специфичности электрода проводилась путем измерения ЭДС гальванического элемента (1) в растворах, содержащих помимо йаВР4 одну из следующих солей: N2CE, NaBr, йаХ, NANO>, NaCe 04, N2CHbCOO N2BF4 . Во всех растворах поддерживалась постоянная ионная сила(р = 0,02). Зависимость ЭДС (1) от (gCBPh4 в трехкомпонентных водных растворах приводится на рис.3, где 1 — BF4, 2 — СЕ 04, 3 — й0, 4—
Cg Соо, 5 — СЕ, б — Вг, 7 -Г. Вели чийа углового коэффициента линейного участка зависимости равна (58 + 2)мв.
Данные, приводимые на фиг. З,свидетельствуют о том, что электрод сохраняет фенилборатную функцию при более чем 100-кратном избытке всех исследуемых конкурирующих анионов, за исключением BF4 . По степени мешающего. действия на реализацию электродной функции исследуемые анионы можно расположить в ряд:
В Р )) СЕ 04 i NO> wi СН а СОО з Cf >q B 2 Х
Предлагаемйе электроды могут быть использованы при количественном определении ионов K, Rb Cs, Ag,.
В4 и (где и = Н, С„ Й „,„) методом потенциометрического титрования.
На фиг. 4 в качестве примера приводятся кривые потенциометрического титрования растворов йаВРЬ4 растворами следующих солей: йн4се (1), ксР (2), ссе (3), (сн,.)„йсе (4), АдйОВ(5). Концентрация титранта
0,3 М титруемого раствора — 0,01 М.
Гальванический элемент составлен из электродов обратимого к ВРЬ4 .и насы40
Формула изобретения
Ионоселективный электрод для измерения концентрации тетрафенилборатаниона, включающий чувствительный элемент, отличающийся тем, что, с целью повышения специфичности электрода и расширения диапазона измерений, в качестве чувствительного элемента использована гетерогенная система, состоящая из кристаллической соли тетрафенилбората диэтилферрицения в растворе диэтилферроцена s нитробенэоле, нанесенная на инертный металл, например, платину.
Источники информации, принятые во внимание при экспертизе
1. Дарст P. Ионоселективные электроды. И., 1972.
2. Analyt, Chemistry 42 (5), 1970, 1674. щенного калломельного. Точность определения концентраций составляет f 2%.
Обсчет кривых титрования в случае растворов НСЕ показывает, что потенциал предлагаемого электрода во всех точках кривой титрования описывается уравнением Нернаста: р = 10 Y fgCBPh4, где РВРН 11013 мв— нормальный потенциал фенилборатного электрода в гальваническом элементе с переносом, С - — концентрация аниона Bph
Концентрация BPh4 после точки эк-. вивалентности рассчитывается из данных о растворимости соли RSPh<(1,50к
>10 4 М) в предположении полной диссоциации соли. Следовательно, при условии забуференности раствора на концентрации BPh4 электрод может использоваться для измерения концентрации BPh до 10 . Так, потенциал
20 электрода в растворах, находящихся в равновесии с кристаллической солью
КВРп при концентрации ионов К+, равной 1,77 10 М составляет (+ 235) мв, что соответствует кон25 центрации BPh4 1,2. 10 M. Рассчитанная из данных по растворимости
КВРЬ4 равновесная концентрация ВРЬ4 в этом растворе равняется 1,4 ° 10 М.
Таким образом, использование в ка30 честве электродного материала гетерогенной системы, состоящей из диэтилферронена, тетрафенилбората, диэтилферрицения и нитробензола позвОляет получить высокоспецифичный электрод, 35 сохраняющий электродную функцию в широком интервале составов растворов солей тетрафенилборат-аниона.