Способ получения антрациклинов
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
Союз Советских
Социалистических
Республик
К ПАТЕНТУ (61) Дополнительный к патенту (51)М. Кл з (22) Заявлено 120777 (21) 2503813/23-04 (23) Приоритет .- (32) 13.07 ° 76
С 07 Н 15/24 //
А 61 К 31/70
Государствеииый комитет
СССР ио делам изобретеиий и открытий (31) 23986/76 (33) Великобритания:
Опубликовано 30,1030. Бюллетень Йо40 (53) УДК547.455..07 (088.8) Дата опубликования описания Зц1ц80
Иностранцы
Серджо Пенко, Франческо Анджелуччи и Федерико Аркамоне (Италия) — -(72) Авторы изобретения
Иностранная фирма
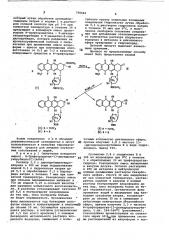
"Сочиета Фармасьютичи Италиа С.п.А." (Италия ) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ АНТРАЦИКЛИНОВ в трет-бутаноле в присутствии двух 5 .эквивалентов иодата натрия окисля- . ют при комнатной температуре в течение 2 ч с получением 9-дезщетил-.
«9-оксо-й»трифторацетилдаунорубицина общей формулы XXX
20 0 OR
RCl где Х означает C ли С
ОН К ! отличающийся тем, что М-тоифтораце- 3п з0 0 OH
И
НО
М
mC0CF
Изобретение относится к способу получения новых производных антрапиклина, обладающих ценными фармакологическими свойствами .
Цель изобретения - получение новых полезных соединений, расширяю» щих.арсенал средств воздействия на живой организм, достигается путем синтеза последних, основанного на известных реакциях окисления и восстановления Щ .
Описывается, согласно изобретению, способ получения антрацкклинов
Общей формулы Y
0 ОБ
2 тил-13-дигидродаунорубицин общей формулы ЙХ
0К
CR0RCRs с 0Н
776562 тильную группу отдельных эпимерных соединения гидролизуют путем обработки 0,1 н.раствором гидроокиси натрия в течение 30 мин при О С, и полученное свободное основание соедине» ния при добавлении стехиометрического количества. раствора. хлористого водорода в метаноле и диэтилового эфира превращают в гидрохлорид.
Целевой продукт выделяют извест10 ными приемами.
Процесс по предлагаемому способу может быть представлен, схемой
0 OR
0 OH
СНоНСХЗ
ОК
0НЗО 0 ОН 0
Сн 0 0 ОН
0 (c) ННСОСР, 0 ОН
0Н
ОХ
ll
0 ОН МНВ (Ej: a =. СОСР (С):R =Н
МНВ (F):Ê = Сов (R):В = Н
Новые соединения С и Н обладают .антимитотической активностью и могут 40
HcHoJlbsoBàòüñÿ в качестве терапевтических средств для лечения опухолевых заболеваний у людей.
Пример 1 (получение исходного, сырья). N-Трифторацетил-13--дигидрода 45 унорубицин(С)(MAR4)
Раствор 3,0 г даунорубицингидрохлорида в 300 мл воды подщелачивают водной 0,1 Й гидроокисью натрия до рН 9,5 и обрабатывают 0,3 г боргид- <> рида натрия в течение 7 мин при комнатной,температуре. Реакционную смесь при сильном перемешивании выливают.s
750 мп водной 0,25 н.соляной. кислоты = для удаления избыточного восстановите ля..В растворе устанавливают значения 55 рН 8,6 и экстрагируют хлороформом до тех пор, пока экстракты больше не будут окрашиваться. Органические фазы высушиваются над безводным сульфатом натрия и концентрируни в вакууме49 до объема 50 мл. Остающийся красного цвета раствор, в котором устанавливают рН 3,5 (по конго красному) с помощью безводного метанольного раствора хлористого водорода, смешивают с избы- 65 который путем обработки цианидборгидридом натрия и водным 1 н.раствором соляной кислоты при рН 3-4 при комнатной температуре в .течение 24 ч превращают в эпимерную смесь производных N-трифторацетила — 9-дезацетилдаунорубицин и 9-деацетил-9-эпидаунорубицин, которую разделяют на хроматографической колонне с силикагелем при применении смеси хлороформа - ацетон при соотношении соответственно от 8:2 до 7:3 в качестве элюирующего средства и й-трифторацеточным количество дизтилового эфира, причем получают 2,8 г чистого 13-дйгидродаунорубицина В в виде гидро», хлорида. Выход 933.
Суспензию 2,8 г соединения В в
300 мп хлороформа при ОоС в течение
1 ч обрабатывают 20 мп трифторацетангидрида. Реакционную смесь выпаривают в вакууме досуха. Остаток растворяют в 200 мп метанола и нейтрализуют водным насыщенным раствором бикарбоната натрия . Спустя. 30 мин выдержчвают при комнатной температуре, растворитель удаляют в вакууме и водный раствор экстрагируют хлороформом до тех пор, пока экстракты более не будут окрашиваться. Органические фазы промывают водой и высушивают над безводным сульфатом натрия, концентрируют до объема 30 мп и смешивают с избыточным количеством петролейного эфира, причем получают 2,3 r чистого
N-трифторацетил-. 13-дигидродаунорубицина, т .пл. 164-166оС (разложение), тонкослойная хроматография на силикагеле марки 60 F> при применении система растворителей из хлороформа и аце776562 тона .(2:1 по объему) дает R< 0,25.
Выход 70%.
Пример 2. 9-Дезлцетил-9-оксо-М-трифторацетилдаунорубицина (Д)(МАВ18) .
Раствор 2,3 r полученного соединения С в 120 мл трет-.бутанола обрабатывают 1,53 r йодата натрия, растворен- ных в 120 мл воды. Реакционную смесь в течение 2 ч перемешивают- при комнатной температуре. Выпавший в осадок (соединение Д) отфильтровывают, проьывают водой и высушивают в вакууме °
Получают 1,34 r чистого соединения
Д, т.пл. 200 С (разложение); тонкослойная хроматография на силикагеле марки 60 Г при использовании системы растворителей из хлороформа и аце- 1S тона (2:1 по объему) дает Я 0,57.
Выход 64%.
Найдено, %: Н 4,26, С 55,6.
27 24 10
Вычислено, %: Н 4,18, С 55,9. 20
II р и м е р 3. 9-Дезацетилдауно.— рубицин (G) (ИАР29) и 9-дезацетил-9-эпидау нору бицин (Н ) (MA R 30 ) ..
Раствор 1,34 г соединения Д в
250 мл диоксана и 50 мл воды подкис- 25 ляют водной 1 н.соляной кислотой до рН 3 и обрабатывают 0,78 r цианборгидрида натрия в течение 24 ч при комнатной температуре, причем подпер живают кислые условия путем добавки Зо
1 н.соляной кислоты. Реакционную смесь смешивают с 300 мл воды и пять раз экстрагируют по 200мл хлороформа.
Промытую водой и высушенную над безводным сульфатом натрия органическую фазу выпаривают в вакууме досуха.
Остаток (1 r) хроматографируют на колонне с силикагелем при использовании сначала смеси хлороформ— ацетон 8:2 V/V и затем смеси.хлороФорм — ацетон 7:3 ЧIЧ в качестве элю- ® ирующего средства, причем получают *
0,67 г чистого соединения Е, т.пл.
204-2060С (разложение). Выход 50%.
Тонкослойная хроматография на силикагеле марки 60 Г б при применении 4$ системы растворителей из хлороформа и ацетона (2:1 по объему) дает
R 0,44 и получают 0,078 r чистого соединения F т.пл. 180-182 С (раз,— ложение), Выход 6%, Й определенным при таких же условиях, что и для соединения Е, 0,3.
Чтобы гидролизовать N-трифторацетильную группу, соединения Е и F обрабатывают следУющим образом. К
0,67 г соединения Е 50 мл
0,1 н.гидроокиси натрия, спустя
30 мин при ООС устанавливают с помощью 0,1 н,соляной кислоты рН 8,4 и раствор повторно промывают хлороФормом. Объединенные экстракты су- О шат над безводным сульфатом натрия н концентрируют в вакууме до объема
20 мл . Раствор при добавке стехиометрического количества метанольного раствора хлористого водорода и ди- 63 этилового эфира дает осадок красного цвета, который отделяют, промывают диэтиловым эфиром и высушивают в вакууме. Соединение С имеет т.пл.
166-167 С (разложение),fHg = 282 (с. = 0,15, метанол).
Тонкослойная хроматография на силикагелевых пластинах F> (марка) с системой растворителей из хлороформа и ацетона.(13гб:1 по объему) дает R 0,55.
Получено-0,56 г соединения G, Выход 84%. Общий выход 9-дезацетил-9-кето-й-трифторацетилдаунорубицина (MA R-18) 27% .
Найдено, %: Н 5,45; С 57, 16; и 2,68.
С25Нtl йО НСС °
Ийчислено, Н 5,42, С 57,52," и 2,68.
Соединение Н 0,065 г имеет т .пл.
176©С (разложение), R при таких же словиях, что и для соединения G равно 0,4.
Найдено, %: Н 5,52, С 57,61; и 2,63.
Ю 27
Вычислено, %| Н 5,42; С 57,52
N 2,68.
СеФ +104 (с = 0,148 МеОН) . бщий выход 9-дезацетил-9-оксо-й-трифторацетилдаунорубицина(MAR 18)
3%.
Формула изобретения
Споооб получения антрациклинов общей формулы 1
0 (Щ
СН30 0
О à гН, oH где Х означает,ег 0ли С.
ОН -Н. отличающийся тем, что
М«трифторацетил-13-дигидродауноруби цин общей формулы 11
0 ОН 0H0H 3
0Н 000 F3 в трет-бутаноле в присутствии двух
776562
CK3O . 0 aN 0 ф):, Составитель Г. Коннова
Редактор Л.Герасимова Текред И.Асталош Корректор В. Синицкая
t Ь
Ф4
Заказ 7795/70 .. - o Тираж 495. Подписное
ВНИИПИ Государственного комитета СССР . по делам изобретений и открытий
113035, Москва, Ж-.35, Раушская наб., д. 4/5
Филиал ППП "Патент",г. Ужгород, ул. Проектная, 4,7 эквивалентов иодата натрия окисляют при комнатной температуре в течение
2 ч с получением 9-дезацетил-9-оксо-И-трифторацетилдаунорубицина общей формУлы 111 который путем обработки цианилборгидридом натрия . и водным 1н.раствором соляной кислоты при рН 3-4 при комнатной температуре в течение 24 ч -преврацаат з эпимерную смесь производных й-трифторацетила .- 9-дезацетилдаунорубнцнн и 9-дезацетнл-9-эпидаунорубнцин, которую разделяют на хроматографической колонне с силнкагелем при применении сначала смеси
5 хлороформ - ацетон при соотнсюаении
8 2, затем 7:3 соответственно в качестве элюнрующего средства и N-.òðèфторацетильную группу отдельных эпимерных соединений гидролизуют пу» тем обработки 0,1 н.раствором гидроЮ окиси натрия в течение 30 мин при
0% и полученное свободное основание соединения при добавлении стехиометрического количества раствора хлористого водорода в метаноле и дичти35 лового эфира превращают в гидрохло, рнде
Источники информации, принятые во внимание прн экспертизе
1. Общий практикум по органичес ц кой химии. Под ред. А.Н.Коста,М., "Мир", с. 332, 484, .1965.