Фунгицидный состав
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистических
Республик
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
<о784732 (61) Дополнительный к патенту (22) Заявлено 021277 (21) 2548554/05 (51)М. Кл. (32) 03.12.76 (23) Приоритет
А 01 N 43/50
С 07 0 233/72
Государственный комитет
СССР по делам изобретений и открытий (31) 145915/76 (33) Япония
Опубликовано 3011,80, Бюллетень М 44
Дата опубликования описания 301180 (53) УДК 632.952 (088 ° 8) Иностранцы
Тиезо Такаяма, Тосиро Като, Сигео Ямамото, Есио Хисада, Нобуюки Камеда и Акира ФудзинаМи (Япония) (72) Авторы изобретения
Иностранная фирма
"Сумитомо Кемикал Компани, Лимитед" (Япония) (71) Заявитель (54) ФУНГИЦИДНЫЙ СОСТАВ
Изобретение относится к химическим средствам защиты растений, конкретно к фунгицидному составу на основе производных 1-циклоалкилкарбонил-3-(3,5-дикалоидфенил)-имидазоли- 5 дин-2,4-диона.
Известен фунгицид, действующим веществом которого является производные 3-(3,5-дигалоидфенил)-имидаэолидин-2,4-диона (1) . !
О
Более близким по технической структуре к предлагаемым является фунгицид на основе производных 1-алкилкарбонил-3-(3,5-дигалоидфенил)-имидаэолидин-2,4-диона 21. 15
Однако укаэанные фунгициды недостаточно активны при малых концентрациях.
-Цель изобретения — изыскание новых фунгицидных средств, обладающих 2О высокой фунгицидной активностью.
Для достижения этой цели предлагают испольэовать в качестве производных 1-циклоалкилкарбонил-3-(3,5-дигалоидфенил)-имидазолидин-2,4- 25
-дион соединений общей формулы х Д Ч,с-к-с-й
С-С-Я тс где R — циклоалкил C>-. С, 2,2, 3, 3-тетраметилциклойропил, 2,2-диметил-3-дихлорвинилциклопропил, 2,2-диметил-3-изобутенилциклопропил;
Рои R (каждый) - водород или метил, Х вЂ” хлор или бром) при условии, что Рт — циклопропил, когда Рои R+ одновременно обозначают метил, R - циклопропил или циклогексил когда один из радикалов
R и Рот водород, а другой метил,Р циклопропил, à R и R оба обозначают водород, когда Х вЂ” бром, в количестве 1-80 вес.% °
1-Циклоалкилкарбонилимидазолидиндионы I могут быть получены обычными способами, например взаимодействием соединения формулы
Х с-C- (")
ii 2
Х о в, где R1, Р и х имеют указанные значения, с циклоалкилкарбоновой кислотой общей формулы
Р,-С- ОН
1l (i ii)
784732 где R„ èìååò указанные значения, или с ее реакционноспособным произвсдными, например с галоидоангидридом циклоалкилкарбоновой кислоты обшей формулы
R — С (I V)
1 где R имеет указанные значения и У атом галоида, или с ангидридом циклоалкилкарбоновой кислоты формулы (v) lt pe R1 имеет указанные значения, Пример 1. 0,05 моль производного 3-(3,5-дигалоидофенил)-имидаэолидин-2,4-диона формулы II u
0,0б моль триэтиламина растворяют в
150 мл толуола и к реакционной смеси при перемешивании медленно прибавляют по каплям 0,06 моль хлорангидрида кислоты !Ч. После этого смесь нагревают до кипения с дефлегмацией и кипятят в течение 7 ч. Затем смесь фильтруют и фильтрат концентрируют под вакуумом. Полученный остаток тщательно промывают водой высушивают и перекристаллизовывают из этанола, получая производное 1-циклоалкилкарбонил-3-(3,5-дигалоидофенил)—
-имидазолидин-2,4-диона общей формулы Т с высоким выходом. 30
Пример 2. 0,05 моль производного 3-(3,5-дигалоидофенил)-имидазолидин-2,4-диона формулы II и 0,15 моль ангидрида кислоты формулы V растворяют в 50 мл толуола. Смесь нагревают до кипения с дефлегмаций и кипятят в течение 15 ч. Затем раствор охлаждают до комнатной температуры и выливают при перемешивании в насыщенный раствор бикарбоната натрия.
Образующийся твердый продукт отфиль- 0 тровывают, промывают несколько раз водой, высушивают и перекристаллизовывают из спирта, получая целевое производное 1-циклоалкилкарбонил-3†(3,5-дигалоидофенил)-имидазолидин- ц
-2,4-диона формулы 7 с высоким выходом.
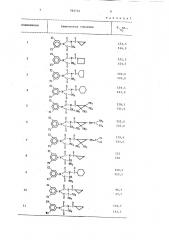
Согласно одному из указанных вариантов способа получают 1-циклоалкилкарбонилимидазолидиндионы I, приведенные в табл. 1. ,Формы применения соединений формулы I обычные: растворы, эмульсии, суфпенэии, порошки, пасты, грануляты1
Действующие начала согласно изобретению могут находиться в смеси другими фунгицидами, а также g инсектицидами, акарицидами, нематицидами и удобрениями.
Нижеприведенные примеры демонстри- 40 руют очень высокую активность 1-циклоалкилкарбонилимидазолидиндиоНов 1.
В этих примерах номер соединения соответствует номеру соединения в табл. 1. 65
Пример 3. Испытание. фунгицидного действия относительно фунгицидоустойчивых патогенов.
10 мл среды кар .офельного агара с сахарозой переводят в раствор нагреванием, и к раствору прибавляют эмульгируемый концентрат, содержащий испытуемое соединение. Смесь выливают в стеклянные чашки Петри диаметром
9 см. После отверждения агара мицеллярные кружочки (диаметром 5 мм) фунгицидно-устойчивых спор грибков серой плесени (Sotrytis cinerea) устойчивого к 1,2-бис-(3-метоксикарбонил-2-тиоуреидо)-бензолу, которые выделяют из винограда и исходного штамма (чувствительного) Вotrytis cinerea помещают в центры агаровой пластинки и инкубируют в течение 3 дней при 200С. После инкубации измеряют диаметр площади выросшей колонии и вычисляют процент замедления развития по следующей формуле по отношению к необработанному участку:
Диаметр колонии обработанПроцент заного участка медления развития Диаметр колонии необработанного участка
Результаты представлены в табл. 2.
Пример 4. Испытание защитного действия относительно черной пятнистости груши AIternariа Кikuchianа.
Трехлетнее грушевое дерево (вид:
20 -seiki) выращенное в цветочном горшке диаметром 30 см, используют в качестве испытуемож растения. Эмульгируемые концентраты, содержащие испытуемые соединения, раз; бавляют водой до требуемой концентрации. Когда каждое растение даст
3-4 молодых ветви с 10 — 20 листьями на каждом, их опрыскивают приготовленными водными растворами дозой
30 мл/побег. Растения помещают в теплицу на 7 дней после опрыскивания.
Затем всю почву вокруг растения заражают, опрыскивая суспензией спор
А!ternarià Kikuchiàna, выращенных в растительном питательном агаровом бульоне в течение 7 дней. Затем зараженные растения помещают на 24 ч в увлажнительную камеру, после чего в теплицу на 2 дня.
Определяют степень поражения, применяя оценку болезни (в баллах) (О, 1, 2, 3, 4, 5) следующим образом:
Степень пора- Балл поражежения ния
Непораженная площадь
Площадь поражения листа менее 10%
784732
Степень поражения, %
5 х общее число контролируемых листьев) х 100!
5 вычисляют согпоражения) х о листьев)
Степень поражения
5х (общее число листьев) Площадь поражения листа от
10 до менее 20%
Площадь поражения листа от
20 до 40%
Площадь поражения листа от
40 до 60%
Площадь поражения листа от
60% и выше
Степень поражения ласно уравнению. (бал х (числ
Результаты представлены в табл. 3. и р и м е р 5. испытание защитного 25 действия по отношению к стеблевой гнили фасоли Sclегоtinià sciегоtiorum.
Фасоль выращивают до стадии второго листа в цветочном горшке диаметром 15 см. Эмульгируемый концентрат, р содержащий испытуемые соединения, разбавляют водой и опрыскивают фасоль дозой 10 мл/горшок. После высушивания на воздухе в течение 4 ч фасоль заражают мицелярными кружочками (диаметр 5 мм). После заражения растения помещают в помещение с повышенной влажностью и выдерживают в темноте при 20оС 4 дня. Степень поражения вычисляют на основе следующей стандартной шкале оценки.
Балл: Оценка степени пора- . жения
Нет заражения
Слабое заражение 45 вокруг обработанного инфекцией места
Заражена площадь порядка 1/б от обработанного инфекцией листа
Заражена площадь порядка 3/5 от обработанного инфекцией листа
Заражена площадь порядка 3/5 от обработанного инфекцией листа
Заражена площадь порядка 3/5 и более от Щ обработанного инфекцией листа
7(балл)х (число листьев) х
Результаты представлены в табл. 4.
Пример б. Испытание защитного действия по отношению к голубой плесени.
Плоды апельсин хорошо обьывают водой и высушивают на воздухе. Эмульгируемюе концентраты, содержащие испытуемые соединения, разбавляют IIoдой до требуемой концентрации (активного ингредиента) и высушенные на воздухе апельсины погружают..в водные растворы концентрата на 1 мин ° Затем высушивают на воздухе и поверхность плода заражают опрыскиванием суспенэии Penici11ium italicum, выращенных в среде картофельного агара в течение 5 дней. После этого фрукты помещают в увлажнительную камеру на 7 дней и после заражения затем определяют степень заражения, оценивая в баллах (О, 1, 2, 3, 4 и 5).
Результаты оцениваются в баллах следующим образом (по средней величине балла):
Степень пора- BBJUI жения
Незараженная площадь О
Поражена площадь менее 20% поверхности 1
Поражена; площадь от
20 до менее 40% поверхности 2
Поражена площадь от
40 до менее 60% поверхности 3
Поражена площадь от
60 до менее 80% поверхности 4
Поражена площадь порядка 80% и более 5
Результаты приведены в табл. 5.
Таким образом, предлагаемые соединения обладают выеокой фунгицидной активностью при малых концентра- . цияк.
784732
Соединения
Т. пл., ОС
154,5
156,0
101,5
104,5
102,0
103,0
159,5
161,0
С1
С1
128,5
131,0
122,0
125,0
119,0
144,5
Ь 0 и II
С-М-С
СНЗ
122
110,5
113,5 и
СН3
96,5
97,5
0 О
II с-м-с
Ю I
С 2 и
140,5
143,5.Химическое строение
0 Q ! II
-И- С: — м
М
С- СН, и
С-Б-С
У 1 с- СН
II
С вЂ” N-C H C — СН C -N- C
М С -СН
If
СН3 С -М-С
С -СН
0 Q и и С 3 .С-М-С СК= С
1 СН
И II cs
С вЂ” Я-С CH С
С1 С вЂ” СН
СН СН т а б л и ц а 1
784732
Ъ замедления развития,Ъ
Соединению
Ъ замедления развития,Ъ
94
10
94
10
10
94
94
10
94
10
94
10
94
10
94
10
83
94,, 78
94
10
94
94
10
91
94
10
94
94
94
10
94
10
100
10
10 (Известно) 70
1,2-Бис— (3-метоксикарбонил-2-тиоуреидо)-бензол
Фунгицидная активность по отношению к исходному штамму (чувствительному)
Sotrytis ctnerea
Концентрация активного ингредиента, части на млн .
Таблица 2 фунгицидная активность по отношению к фунгицидноустойчивым спорам
Botrytis с1пегеа
Концентрация активного ингредиента части на млн °
784732
1000
0i0
100
1,0
1000
0,5
100
3,2
1000
0,8
100
3,0
1000
1,0
100
2,8
1000
1,0
100
4,5
1000
100
5,0
1000
0 5
2,5
100
1000
0,8
4,0
100
1000
2,0
5,5
100
1000
2,5
100
6,8
1000
0,0
0 0
П
Я- С-С,Н, l
С1 2
0 (Известно) 100
2,5
100
4,5
58,0
1000
5 0
63,5
100
72,5
Соединения
С1 Cl ! I ! Р- S — С вЂ” С-Я ! ) а С1 Cl
О (Известно) Не обработано
Концентрация активного ингредиента, части на млн.
Таблица3
Степень поражения,Ъ
784732
Таблица4
О,О
100
0,0
100
2,5
100
0,0
100
0,0
100
2,5
100
0,0
100
0,0
100
2,5
100
0,0
100 ор
47,5
100
100,0
100
0,0
100
0,0
100
0,0
1ОО
0,8
0 5
1Оа
1,3
100
100
0,0
100
0i0
0,2
100
Соединения (известно))
Необработанное
Концентрация активного ин-: гредиента, части на млн.
Степень поражения,3
Таблица э
784732
Продолже ние табл, 5
100
0,0
О
И с ) -с - 013 м
200
2,6 (Известно) 0 0
II с ю- с -с,н, м сн
200
3,1
CI (Известно) Необработанные
5,0
Формула изобретения
0 !! гс-ы-с -к, N с-с-а, !! о в
50
Составитель А. Максимов
Редактор Т. Никольская Техред Е.Гаврилешко
Корректор H. Муска
Заказ 8575/65 Тираж 723
ВНИИПИ государственного комитета СССР по делам изобретений и открытий
113035, Москва, >(-35, Раушская наб., д. 4/5
Подписное
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
Фунгицидный состав, содержащий действующее начало на основе производных 1-циклоалкилкарбонил-3-(3,5-дигалоидфенил)-имидаэолидин-2,4-диона, а также вспомогательные компо- 35 ненты из группы твердых или жидких носителей отличающийся тем, что, с целью повышения фунгицидной активности, он содержит в качестве производного 1-циклоалкил- 4р карбонил-3-(3,5-дигалоидфенил)-имидазолидин-2,4-диона соединение общей формулы где R> — цикло ил СЪ- Сб. 2.2.3.-3-тетраметилциклопропил, 2,2-диметил-3-дихлорвинилциклопропил, 2,2-диметил-3-изобутенилциклопропил; и и R (каждый) — водород или метил)
Х- хлор или бром; при условии, что Rq циклопропил, когда R< и R одновременно обоэнаS чают метил, R — циклопропил или циклогексил, когда один иэ радикалов R< и R>- водород, а другой метил, и R - циклопропил, à R< и R оба обозначают водород, когда Х вЂ” ром, причем содержание действующего начала в составе составляет 1-80Ъ.
Источники информации, принятые во внимание при экспертизе
1. Патент Великобритании
9 1251907, кл. С 2 С, опублик.
03.11.71.
2. Патент CIIJA М 3716552, кл. 260-309.5, опублик. 05.10.70 (прототип).