Способ получения 7-замещенных аминоацетамидооксадетиацефалоспоринов
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Союз Советских
Социалистических
Республик
«и786901 (61) Дополнительный к патенту (22) Заявлено 01. 09. 77 {21) 2517656/23-04 (5f)PA. Кл 3 с
С 07 0 498/04 Л
A 61 K 31/535 . (32) 01. 09. 76 (33) Япония (23) Приоритет— (31) 105117/76
Государственный комитет
СССР по делам изобретений и открытий
Опубликовано 0712.80-Бюллетень М2 45
Дата опубликования описания 07.1280 (53) УДК 547. 867, 2.
° 07. (088. 8) Иностранцй 9 7 м (,= „".)
Масаюки Нарисада, Терудзи Цудзи, Мицуру Ес dka, Хирому Мацумура,Есио Хамасима,Ватару Нагат (Япония)
Иностранн.-<я фирма
< . / i . ". 1,:, ° i " ú
"Сионоги энд Ко, ЛТД" (Япония)
Ъ ъ4::а. -, . " (72) Авторы изобретения (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ 7-ЗАМЕДЛЕННЫХ
АМИНОАЦЕТАМИДООКСАДЕТИАЦЕФАЛОСПОРИНОВ
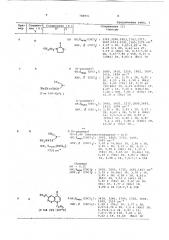
10 г em)» )(p(® сов 41
В 0ОКН НСОМН _#_ — N, I
N < сн S yrg
0 н i (L) Г 0
coй2 Знз
15 где Ar) — 2-тиенил, 3-тиенил, Фенил, и-оксифенил или и-С -С,--алканоилоксифенил; группы СОВ и СО — независимо друг от друга свобод- 20 ная или защищенная карбоксильная группа;
Y — атом водорода или метоксигруппа, 25, или их солей ацилированием соответствующего производного 7-амино-3†(1-метилтетразол-5-илтиометил)-1-оксадетиа-3-цефем-4-карбоновой кислоты соответствующим производным 30 где й" означает группу
0 0 ф
- К X-R
Ъ б где и — низший алкил, О а> мСм б
R группу
Изобретение относится к способу получения новых биологически активных химических соединений, а именно 7-замещенных аминоацетамидооксадетиацефалоспоринов, которые могут найти применение в медицине.
Известен способ получения 1-оксадетиацефалоспоринов общей формулы фенилмалоновой кислоты или ее моногалоидангидридом (1).
Эти соединения обладают биологически активными свойствами.
Целью изобретения является синтез новых производных 1-оксадетиацефалоспоринов, расширяющих арсенал средств воздействия на живой организм.
Эта цель достигается основанным на известной реакции способом получения 7-эамещенных аминоацетамидооксадетиацефалоспоринов общей формулы
786&01 где Я и Я вЂ” низший алкил и R - атом » водорода, О
II
-М _#_ 87
rCi (1 группу где R+ - мезил;
->- С@-R9
Ф группу
R С011НСНСОЪ7, (ф1
АГ где R" и Рг имеют .указанные значения 4О и И вЂ” оксигруппа или атом галогена, в среде растворителя при температуре от -30 до +25 C..
Пример 1. 128 мг 0- -(4- 45
-этил-2,3-диоксо-1-пиперазинилкарбониламино)-фенилуксусной кислоты суспендируют в 4 мл сухого бензола и добавляют 34 мкл оксалилхлорида и 3 мкл диметилформамида; Смесь перемешивают в течение 2 ч при комнатной температуре и выпаривают досуха при пониженном давлении. Добавляют бенэол, смесь выпаривают досуха и получают 0-g- (4-этил-2,3-диоксо-1«-пиперазинилкарбоииламино)-фенилацетилхлорид.
Отдельно растворяют 101,7 мг дифенилметил-74.-метокси-7р-амино-3— (1-метил-1Н-тетразол-5-илтиометил)-1-оксадетиа-3-цефем-4-карбоксилата Щ в З.мл дихлорметана и охлаждают до
0 С. К смеси добавляют раствор получециого выше D-А- (4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-Аенилацетилхлорида в 2 мл дихлорметана и где R8 - низший алкил и R9 — фенил-(низший)алкенил или фенил, замещенный двумя ацетоксигруппами,окситиопиранил или 8-низший алкил-3-низшая алкокси-5-оксо-5,8-дигидропиридо 12,3-c) пиридазинил;
Аг - фенил или монозамещенный окси-, карбамоилокси- или ацетоксигруппой фенил;
Y — атом водорода или метоксигруппа;
R - дифенил (низшая) алкоксигруппа,25 который заключается в том, что соединение Формулы
Y н м
0 д) зо
2 (4 I
COR2
Hg л где Y и R имеют указанные значения, подвергают ацилированию соединением формулы через 5 мин добавляют 16 мкл пиридина. Смесь перемешивают в течение
2,5 ч при 0 C и разбавляют этилацетатом, экстрагируют раствором бикарбоната натрия и водой. Экстракт сушат над сульфатом натрия, выпаривают досуха при пониженном давлении.
Остаток хроматографируют на колонке с силикагелем. Из 2%-ных элюатов смеси уксусной кислоты-этилацетата получают 30,2 мг дифенилметил-7<К;метокси-7p- jD-J.- Ьенил-N-(4-этил-2,3-диоксо-1-пиперазинилкарбонил)—
-глициламино)-3-(1-метил-1Н-тетразол-5-илтиометил)-1-оксадетиа-3-цефем-4-карбоксилата н виде бесцветной пены.
ИК-спектр,Ф„А,„(СНС1 ).3410,3280,i
1790,1710,1685 см .ЧМР-спектр,сГ(СВсц: 1, 17 t (7гц) ЗН, около 3,4 4Н, 3,50,s,3H, 3,85 s
3Н, около 3,9 2Н, 4,?7 s 2H, 4,52 s
2Н, 5,07 s 1Н, 5,64 d (7 Гц) 1Н, 9,88 d (7 Гц) 1Н.
Пример 2. 59 мг D-g-(п-оксифенил)-14-(1,3-диметилуреидокарбонил)-глицина растворяют в смеси диметилформамида и дихлорметана. (по 0,5 мл) в атмосфере азота. Добавляют 26 мкл N — метклморфолнна и
20 мкл этилхлоркарбоната при — 5 C u смесь перемешивают в течение 30 мин при той же температуре. К этой смеси добавляют 100 мг дифенилметил -7-амино-3-(1-метил-1Н-тетразол- 5-нлтиометил)-1-оксадетиа-3-цефем-4-карбоксилата в 2 мл дихлорметана при †30 и полученную смесь перемешиваtom в течение 1,5 ч при той же температуре. Смесь разбавляют соответствующим количеством дихлорметана, дважды промывают охлажденным на льду раствором бикарбоната натрия, дважды 1н.соляной кислотой и три раза водой и сушат над сульфатом магния.
Растворитель выпаривают при пониженном давлении и получают бесцветное масло. Это масло обрабатывают небольшим количеством смеси бензолэтилацетат (9:1) и получают 75 мг дифенил 7-(D-d-(и-оксйфенил)-N—
†(1,3-диметилуреидокарбонил)-глициламино)-3-(1-метил-1Н-тетразол-5-илтиометил)-1-оксадетиа-3-цефем-4-карбоксилата в виде бесцветных кристаллов. Выход 48,43, т мапл.21II220oC (с разложением).
HK-спектр,Ф„ кс .. 3340,3230, 1801, 1732,1685,1660,1640 см ".
ЯМР-спектр,Юф ЭмЗО)2, 70 d (4 Гц)
ЗН, 3,13 s ЗН, 3,95 s 3H, 4,32 шир.s
2Н, 4,68 шир. 2Н, 5,23 d (4 Гц) 1Н, 5,33 d (7 Гц) 1Н, 5,73 dd (4;10 Гц)
1Н, 6,7-7,8 m 16Н, 9,02 О (10 Гц)
1Н, 9,37 s 1Н, 9,82 d (7 Гц) 1Н.
D-а(-. (п-Оксифенил)-N-(диметилуреидокарбонил)-глицин можно получить по реакции О-(-с ;.(п-окси енил)-гли786901 ацетат (1:1) Фракции собирают м выпаривают досуха. г1олучают 107 мг дифенил -Метил-7- (0-N-(3,4-диацетоксибензоил)-фенилглициламино)-3-(1-метил-iff-тетразол-5-илтиометил)-1-оксадетиа-З-цефем-4-карбоксилата.
Выход 61 6%.
Я1".Р-спектр, Ю(СОС(): 2, 23 а 6Н, 3,73 s ЗН, 4,23 шир.s 2Н, 4,38 шир.s 2Н, 4,90 d (4 Гц) 1Н, 5,65 dd (4; 9 Гц) 1Н, 5,97 д (7 Гц)
1Н, 6,97 s 1Н, 7,0-7,9 m.
Пример ы 4-9. Соединения, приведенные в табл.1, получают аналогично примерам 1-3.
В примерах 10-14 вместо свободной кислоты (111 ) используют ее хлорангидрид и получают целевые соединения (1) в условиях, приведенных в табл.2.
В табл.3 приведены Фиэические константы целевых соединений по примерам 10-14. Таблица 1
Y 2
Ф Н - Н2 Л вЂ” 1 Е(1
D R C0 HCHCOOH
ООСНРп2 (Д) Y
9-Я1 Сомн СНСоин
НФ" СНгс — wet
СООСНРь
Ш
_#_ — М где Tet = .
СН
Соединение (1Н ) Соединение (I) сl1 ктры
При Соедине мер ние (il )
Н ИЕ,Фм,<„„(СНС1 g ): 34 10 .
1512
ЯМР, К (CDC1> ): 3,82
4,52
5,75 (8Hz ) m 18
11,02
rr0
ffJ< (СНС1. ): 3415, 1803, 1743, 1697, 1390, 1365,1171 см "
ЯМР, д (СОС1 ):. 3, 18 s ЗН, 3,57-3,38 m 7Н, 4,12 brs 2Н, 4,47 Ьгs 2Н
4,87 д (4Нг) 1Н, 5,40-5, 80 m 2Н, 6,85 s 1Н, 7,007,67 m 16H, 7,12 0 (8Нт) 1Н.
li н5 02
3 цина с триметилсилилдиэтиламином с последуюшей реакцией полученного
0-Ц.-(п-тримЕтилсилилоксифенил-N-триметилсилил)-глицинтриметилсилила с диметилуреидокарбонилхлоридом, т.пл.218-220 С (разложение).
Н р и м е р 3. К раствору 116 мг
D-:1-(3,4-диацетоксибензоил)-Фенилглицина и 100 мг дийенилметил-7-амино-3-(1-метил-1f!-тетразол-5-илтиометил)-1-оксадетиа-3-цефем-4-карбоксилата в 4 мл дихлорметана дсба-:,— !
О ляют 77 мг 1-этоксикарбонил-2-этокси-3,4-дигидрохинолина и перемешивают в течение 3 ч при комнатной температуре. Реакционную смесь э;.=трагируют этилацетатом и водой, этил- 15 ацетатный слой последовательно промывают разбавленной соляной кислотой, раствором бикарбоната натрия, водой и раствором хлористого натрия.
Смесь сушат и растворитель отгоняют. Щ
Остаток хроматографируют на колонке с силикагелем (содержит 10% воды) и элюированные сл есью бензол-этил1802,1707,1668,1605, см
s ЗН, 4,28 brs 2Н, brs 2Н, 5,02 d (4Hz)1Н, dd (9;4Hz) 1Н, 5,93 d
1Н, 6,95s 1Н,7,10-7,93
Н, 9„17 d (4Hz) 1Н, d (8Ч ) 1Н.
786901
Продолжение табл, 1
Соединение (I) спектры (ЗН ИК,Я „(СНС13) : 3315,3320,1803,1743,1717, 1697,1513,1391,1365,1170 см
ЯМР, Д СОС1) ; 3,27 s ЗН(3,67-3,83 m 7H, 4,25 brs 2Н, 4,62 brs 21 ., 5,10 4 (4Hz) 1Н, 5,57-5,90 m
2Н, 6,67-7,80 m 15H, 8,15 d (10ННг) 1Н, 8,83 d (8Hz) 1H
11 Сн 602-N
Н (О-рацемат)
ИК;1) „ (СНС1 ):
ЯМР, 0 (СОС1) 3680, 3430, 3250, 1802, 1697, 1616, 1499 см-"
3,38 s 3H, 3,75 s ÇH, 4,25 s
2Н, 4,55 s 2Н, 4,98 d (4Hz)
1Н, 5,65 (7Hz) 1Н, 5,72 dd (10;4Hz) 1Н, 6,93 d(15Hz) 1Н, 6,97 s 1Н, 7,10 d (10Hz)1H, 7,40 s 20H, 7,85 d (15Hz) 1Н, 10,37 d (7Hz) 1Н
Се
XР? 1н= CHCO (1 .Пл 124-126 С 1 (L-ра цемат ) ик,0 „(снс1 ): 3695, 3435
1613, 1496
ЯмР Д (CDC1 ): 3,35 ь ЗН, 2Н, 4,62
1Н, 5,5-5, (15Hz) 1Н, 7,6 и 21Н
10,42 d (7,1800,1693, s ЗН, 4,27 ,10 d (4Hz)
6,87
s 1H, 6,8d (15Hz) 1Н, ic
Н (О-рацемат)
Rf=0,44 (бензин:этил
ИК(„,ах(СНС13) 3450
ЯМР, Д (CDC1 ): 3,10
3 95
2Н, (5Hz
6,48
1Н, ацетат = 4:1)
1800, 1715, 1695, см -"
d (4 (5Hz) ÇH, 3,80 s ÇH, s 3H, 4,25 s 2Н, 4,5" s
5,00 d (4Hz) 1Н, 5,37
) 1H, 5,65 dd (9;4Hz) 1Н, d (9Hz) 1Н, 6,83 d (5Hz)
6,98 s 1H, 7,0-7,7 m 11Н (Эпимер)
)Rf = 0,35 ИК,V (СНС 13)
1ЯРР (Д (C DC! ) 3420, 1800, 1715, 1692,1667 см
3,10 d (4,5Íz) ЗН, 3,78 ь ЗН, 3,85 s ÇH, 4,28 s 2Н, 4,63 d (бНг) 2Н, 5,10 d (4Hz) 4Н, 5(40 d (5Hz) 1Н, 5,67 dd (8;
4Hz) 1Н, 6,77 d (6Hz) 1Н, 6,98 а 1Н 7,0-7,7 m 11Н
С1 0 ((" (плох " 3 с?(ЯМР, д (СОС13):
Й 5 (Т,TIll, 225- 227 (С) 3430, 1592, 1,50
4,07-4
5,33-6
7,0-7, 9,02 s
0Н
?1—
NK ) ()(дк (CHClg) <7г4 си
3,83
2Н, 5
8 m 2Н
6,90
7,80
Hz 1Н
3240, 1799, 1702, 1640, 1518 см (7Hz) ЗН, 3,77 s ÇH,,70 m 9Н, 5,0 d (4Hz) 1Н,,3 m 2Н, 6,97 s 1Н, 78 m 15H, 7,85 s 1Н, 1Н, 10,60 (8Hz) 1Н
786901
10 л !
»1 г»! л х р х о
»
lA т-! х > х
3о л г л л с-!
Ю rf н х х о
1„ о лл лл лл лл
N (»! ГЧ СЧ о
»
О
Г4
»
ГЧ
Ю (»! д
9 х
С4
Щ о х х
09ОЕ х х !о
О 9 о и х Е о о
Ю сМ о ! Ю
ave
О9Х х х
CV lA л л
СЧ N
О
Ю
СЧ х
v х о
СЧ
Ю
-Ф
LLl
Ж
О
ТР х!
» и к
О
C
И
Х
9 а
9 х
Ц
9 о и (!! а Ъ
Е". ф
o.u
9о
И
Е
9 о !.аа1 охо
9 C Х
vv!х х о,!! хоев охаe и ц-н
o cv л л г- л г! с-!! I л .С
С4 С4 ! ( о о о а о
u I u
z . Q z м v С ф
I I
И И
С4
I о х !
1 л
04 ! о о и
С х !
И
III
9
Ц х
И о а !
» а о
786/01
Таблица 3
OHCTBHTEI1
O+ Е и-Н NCOO-РН—
Н ИК, 1„, (CHC1> ): 3500,3400,3270,1780,1740, 1705, 1680 см
SIMP, д (CDC13) CDAD (5: 1): 1, 20 t (7Hz )
ЗН, 3,3-4,7 m 10Н, 3,86 s
ЗН, 5,08 d (4Hz) 1Н, 5,65 dd (4;7Hz) 1Н, 5,58 brs 1Н, 5 95 s 1Н, 7, . 0 д (8Нг) 2Р
Н ИК,Ф „(СНС1 ): б (СОС1. ):
3270 (br) 1790, 1755 (sh), 1712, 1685 см
1,20 t (7Hz) ÇH, 2,26
3Н« 2-4,6 m 10Н, 3,84
ЗН, 5,00 d (4Hz)1Н, 5,70d (7Hz) 1Н, 5,75 dd 4;
7Hz) 1Н, 6,88 s 1H, 7,08d (9Hz) 2Н, 10,01 d (7Нг)
1Н п-АсО-PhИК, 11„(CHC 1 ): 3500, 3420, 3270, 178=
1740 (sh)i 1715,1690 см
ЯМР, 0 (СОС1.:CD OD (5:1): 1,20 t(7Hz) . Н, 3,40-4,60 m 10Н, 3,60 s ÇH, 3,85 s ÇH, 5,10 s 1Н, 5,60 brs 2Н, 5,75 brs 1H, 6,95 s 1Н, 7,12 d (9Hz) 2Н, 9,75 hrs
1Н п-Н NCOO-Ph — Оме
Н ИК мок (CDCf): 3290,1793,1715,16
ЯМР, g (CDC1 y): CDOD (5: 1 ): 2, 97
3,50-4,60 m SH 3
4,90 (4Hz) 1Н, 5,4 (6Hz) 1Н, 5,50 dd
9Hz) 1Н, 6,69 d
6,75 s 1H 9,77 4
1Н
13 п-ÍÎ-Ph—
Ме-N
ИК,4 „,„ (CHC1 3280, 1788, 1740, 1715, 1685 см
ЯМР, д (СОС1 ):CDOD (5:1) : 3,03 s ЗН!
3,40-4,60 m 8Н, 3,80 s
4,98 (4Hz) 1Н, 5,505,80 brs ÇH, 6,85 s 1H, 7,04 d (9Hz) 2Н, 9,90 d (6Hz) 1Н где Rd означает группу
О, О
-К _#_= Rh
\ п-Н,МСОО-Ph—
О -О
1 б
Ие -lf N\/ формула изобретения
Э
60 R низовий алкил, 0
8>
-NCN
l группу б5
Способ получения 7-замещенных аминоацетамидооксадетиацефалоспоринов общей формулы
Т я 60мнснсОмн м сн2s-l„.х В
Ат 0 сов сд
92 см
3Н,,75 ь ЗН, 5 d (4Нг, (7Hz) 2Н (6 Hz, 13
786901
R - низший алкил и R - атом водорода, 0
II г
N-R7
3 где Р+ и группу где R мезил, -М-С0-К9
RS группу где R8
ArY
R2 атом водорода или метоксигруппа; дифенил (низшая) алкоксигруппа, Составитель 3.Латыпова
Редактор Е.Хорина Техред H ° Kosanesa Корректор И.Муска.Заказ 8893/бб Тираж 495 Подписное
ВНИИПИ Государственного комитета СССР по делам изооретений и открытий
113035, Москва, lK-35, Раушская наб., д.4/5
Филиал ППП "Патент", r.Óæãîðîä, ул.Проектная,4 низший алкил и k I — фенил+изший) алкенил или Rфенил, замещенный двумя ацетоксигруппами, окситиопиранил или 8-низший алкил-.
-3-низшая алкокси-5-оксо-5, 8-дигидропиридо (2, 3-с)— пиридазинил; фенил или монозамещенный окси-, карбамоилокси- или ацетоксигруппой фенил; отличающийся тем, что соединение формулы где Y u R имеют указанные значения, а
Я подвергают ацилированию соединениеr.; формулы
RL C014 HC H C0W (ф)
3$ - At где R u Ar имеют указанные значения и М вЂ” оксигруппа или.атом галогена, в среде растворителя при температуре ,рр от -30 до +25 С.
Источники информации, принятые во вниманйе при экспертизе
1. Патент СССР по заявке
Р 2464302/23-04, кл. С 07 0 498/04, приоритет 25.03.76.