Гидрохлориды производных 1(3) @ -2 метил-8 @ -индоло-(3,2- @ ) (1,3) бензодиазепина и способ их получения
Иллюстрации
Показать всеРеферат
1.. Гидрохлориды производных1
СОКИ СОВЕТСНИХ
СОЩИАЛИСТИЧЕСНИХ
РЕСПУБЛИК аа 0D. (51) 4 С 07 Э 487/04
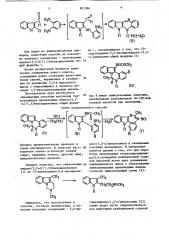
СН3
Н1
С14 НС1
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛ М РЕ ИЙ И ОТНРЫТИ (21) 2835411/23-04 (22) 30. 10.79 (46) 30.12.85. Бюл. 9 48 . (71) Всесоюзный научно-исследовательский-химико-фармацевтический институт им.Серго Орджоникидзе (72) А.Н.Гринев и С.Ю.Рябова (53) 547.892.07(088.8) (54) ГИДРОХЛОРИДЫ ПРОИЗВОДНЫХ 1 (3) Н-2-МЕТИЛ-8Н-ИНДОЛО-/3,2-d//1,3/ÁÅÍÇÎДИАЗЕПИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ, (57) 1. Гидрохлориды производных
1(3)Н-2-метил-8Н-индоло/3,2-d//1,3/бензодиазепина общей формулы
Н где R — атом водорода, хлора, метил или метоксигруппа.
2. Способ получения гидрохлоридов производных 1(3)Н-2-метил-8Н-индоло-
/3,2-d//1,3/-бенэодиазепина, о т л ич а ю шийся тем, что производное 12-ацетиламино-5,6-дигидроиндоло
/1,2-с/хиназолина общей формулы где R имеет вышеуказанные значения, обрабатывают разбавленной 10-15Х-ной соляной кислотой при кипячении.
3. Способ получения по п.2, о т—
O л и ч а ю шийся тем, что процесс проводят в среде растворителя, в ка-, честве которого используют диоксан.
1 803386 l
Ф
Данное изобретение касается новой Соединения общей формулы пред. гетероциклической системы-индоло/3,2- ставляют собой кристаллические ве-d//1,3/áåíçoäü àçåïèHà и ее производ- щества красного цвета, растворимые ных общей формулы I в воде и в спирте, устойчивые на о
Яе 5 воздухе, высокоплавкие (т. пл. 31О С
12 М! СНЗ и более с разложением).
11
10 НС1 (>) где R означает атом водорода, хлора, метил, метоксигруппу.
В литературе описаны системы типа
А 1 и типа Б нижеследующих структур соответственно:
Т$
Сн (А !
74 N
1 1
Н Н (Б) Объектом изобретения является также способ получения соединений общей формулы
Известен способ синтеза соединений формулы (А) путем взаимодействия 1,2,3,4-тетрагидро-2,5-диметилпиридо/4,3-в/индола с тозилазидом при нагревании (45 С) в течение двух дней или при кипячении в течение трех часов в пропаноле, согласно
0) нижеследующей схеме т$
«- 3 + / О2 снЗ
Новизна системы индоло/3,2-d//1,3/ бензодиазепина (!) состоит в том, что индольный цикл сочленен с 1,3-бензодиазепиновым кольцом по положению 3,2-d что можно рассматривать. как новое сочетание известных типов связей С=С, С-N, N=C, N-С, С-С.
Образование новой системы доказано ходом химических превращений.
Структура соединений общей формулы подтверждена спектральными характеристиками, а также данными элементного анализа. В масс-спектрах указанных соединений наблюдаются пики молекулярных ионов, массовые числа которых отвечают молекулярным весам оснований соответствующих индопо/3,2-d//1,3/áåíçîäèàçåïèíoâ.
Описываемые соединения — индоло
/3,2-d//1,3/áåíçoäèàçåïèíû общей формулы — сочетают в себе фрагменты индола и бензодиазепина, производные которых обладают большим комплексом фармакологических свойств.
Так, например, 1-(H -хлорбензоил) †5-метокси-2-метилиндолил-3-уксусная кислота обладает противовоспалительной активностью, а также используется как противоревматическое средст(3)
1,2-".;иметил-3-карбэтокси-5-оксииндол обладает гипотензивным действием . Различные производные
1,4-бензодиазепина применяют в качестве снотворных и транквилизирующих средств . Принимая во внимание вышеизложенное, можно ожидать, что новые соединения могут представить интерес в качестве потенциальных биологически активных веществ. Кроме того, наличие в молекуле данных соединений двух иминогрупп и активной метильной группы обуславливает использование этих соединений в качестве полупродуктов для синтеза потенциальных биологически активных веществ ряда индоло/3,2-d//1,3/áåíçîдиазепина.
l сн
Известен способ получения соединения формулы Б путем нагревания 2-хпор-3-формилиндола с
М
1н (А) о-фенилендиамином в спиртовой среде согласно нижеследующей схе(2), 803386
О
11
С Нф н+
С1 Hp о
7qH2
Н Н НС1Н,О
Как видно иэ вышеприведенных при- лы I заключающимся в том, что 12меров известные способы не позволя- -ацетиламино-5,6 д идр нд
6- иг ои оло-/1 21 о лы П ют получить соединения — производные -с/хиназолин общей формулы II. индоло/3,2-d//1,3/бензодиазепина об- 15 щей формулы I.
ИНСОСН3
Целью изобретения являются хими- г ческие соединения нового класса, I . Я содержащие новое сочетание известных
1 типов связей, выраженное в сочлене- н, нии по положению 3,2-d индольного н цикла с образующимся в процессе ре- Н акции 1,3-бензодиазепиновым циклом.
Поставленная цель достигается описываемым способом получения гид- где R имеет вышеуказанные значения, 25 рохлоридов производных индоло/3,2- обрабатывают разбавленной 10-153-ной
-d//1,3/áåíýîäèàçåïèíà общей форму- соляной кислотой при кипячении.
Схема предлагаемого способа
Н3
-HC1
Н2О
Н 1 н (Ш
СН3 сн, ! 1
СН СН НСНЗ
Н
I
CHs гидроиндоло/1,2-с/хинаэолины (Т?) также будут легко гидролизоваться под действием разбавленной соляной
Ожидалось, что используемые в способе, согласно изобретению, в качестве исходных соединений — 5 6-диПроцесс предпочтительно проводят в среде растворителя. В качестве раст- 40 ворителя обычно используют низший спирт, например этанол, простой эфир, предпочтительно диоксан.
Следует отметить, что образование 5 индоло/3,2-d//1,3/áåíçîäèàçåïèíîâ. (I) из 12-ацетиламино-5,6-дигидроин-. доло/1,2-с/хннаэолинов в заявляемых условиях неочевидно. В литературе имеются данные о том, что при обработке производных тетрагидропиримидо/3,4-а/индолов разбавленной соляной кислотой легко идет размыкание пиримидинового цикла с образованием аминоалкильных производных индола согласно нижеследующей схеме (4):
803386. текание реакции, в свою .очередь, также неожиданно, так как в литературе имеются сведения о неудачной попытке циклизации 2-амино-N-бензоил-4,5-диметоксифенетиламина в бензодиазепиновый цикл при нагревании до о
200 С, а также при кипячении в ксилоле в присутствии кислотного ката10 лизатора (5):
Сн30 снбо
Н
М-С-СбИ5 ян, снзо Ф
СН3О
Cog
Нижеследующие примеры иллюстрируют новый способ получения новых соединений общей формулы 1.
Пример 1. Гидрохлорид
„1(3)Н-2,6-диметил-8Н-индоло/3,2-d/
/1,3/бензодиазепина.
К суспензии 0,6г (0,002 моль)
2,6-диметил-12-ацетиламино-5,6-дигидроиндоло/1,2-с/хиназолина в 9мл диоксана добавляют 4 мл 10%-ной соляной кислоты и кипятят 1 ч. Затем реакционный раствор упаривают досуха.
Остаток кристаллизуют иэ спирта.
Получают 0,3 r (51%) гидрохлорида
1(3)Н-2;6-диметил-8Н-индоло/3,2-d/.
/1,3/бензодиаэепина, т.пл. свыше
330 С разложением (из спирта).
Найдено, %: С 68,80, Н 5,35;
N 14,00; Cl 11,90.
C1Т 6 3
Вычислено, % С 68.,57; H 5,42;
N 14,11; С1 11,91.
Уф-спектр, Я„„, н.м, (lg Е )! 40
228(4,46), 280(4,52), 290(4,50) плечо, 315 (4, 12) плечо.
ПМР-спектр, 5, м.д.: 2,21 ш.с.СН >, 2,27 — с.СН щ, 6,567,30-м. Cg,,g,g -Н,С „„-.Н,7,4-м.С1д -Н.
В условиях, аналогичных вышеуказанным, но с проведением процесса в среде этилового спирта, выход целевого продукта составляет 37%, а без использования растворителя 10%. 50
Смешанная проба соединения, полученного в этих условиях, с продуктом (1), полученным в среде диоксана, не показывает депрессии температуры плавления.
Пример 2. Гидрохлорид 1(3)Н-2-метил-8Н-индоло/3,2-d//1,3/áåíçoдиаэепина. кислоты с образованием вышеуказанных 2-(о-аминоарил)-3-ацетиламиноиндолов общей формулы (В). Однако в описываемых условиях реакция не останавливается на стадии образования соединений (В), а моментально протекает дальше с замыканием бензодиазепинового .цикла и с образованием соединений общей формулы I. Такое проИз 0,6 r (0,002 моль) 6-метил-12-ацетил-5,6-дигидроиндоло/1,2-с/"хиназолина в условиях примера 1 получают 0,2 г (34%) гидрохлорида 1(3)Н-2-мецил-8Н-индоло/3,2-d//1,3/бенэодиазепина, т.пл. 310 С с разложением (из спирта).
Найдено, %: С 67,62; Н 4,87, N 14 66; Cl 12,57.
С, Н,ь N Cl
Вычислено, %: С 67,72; Н 4,97;
N 14,81; Cl 12,50.
УФ-спектр, Л мокс, н. м. (lg с):
228(4,38), 272(4,45)плечо, 278(4,46), 310(4,08) плечо.
IIMP-спектр,о, м.д.: 2,23 с. СНз д1, 6, 6-7, 3-м. С -H,Сэ. « -H, 7,5-м.С„д -Н.
II р и M e р 3. Гидрохлорид 1(3)Н-2-метил-6-хлор-8Н-индоло/3,2-d/
/1,3/-бензодиазепина.
К суспенэии 0,8 r (0,00246 моль)
2-хлор-б-метил-12-ацетиламино-5,6--дигидроиндоло/1,2-с/хиназолина в
12 мл диоксана добавляют 6 мл 10%-ной соляной кислоты и кипятят 1 ч. Смесь охлаждают, выпавший осадок отфильтровывают, промывают спиртом, эфиром.
Получают 0,58 г (74%) гидрохлорида 1(3)Н-2-метил-6-хлор-8Н-индоло/3,2-d//1,3/áåíçîäèàçåïèía, т.пл. свыше 330 С (с разложением).
Найдено, %: С 60,26; Н 4,19;
N 13, 14; Cl 21 86. ь Н„з ИзCl
Вычислено, %: С 60,39; Н 4,12;
И 13,21; Cl 22,29.
УФ-спектр,itмо„<, н.м. (lg с ):
231(4,46), 270(4,41)плечо, 291(4,51), 322(4,05)плечо.
803386
П р л м е р 4. Гидрохлорид 1(3)Н-2-метил-6-метокси-8Н-индоло/3,2-с1//1,3/бензодиазепина.
Из 0,64 r (0,002 моль) 2-метокси-б-метил-12-ацетиламино-5,6-дигидроиндоло/1,2-с/биназолина в условиях примера 3 (смесь кипятят в течение
2 ч)получают 0,25 r (407) гидрохлорида 1(3)Н-2-метил-6-метокси-8Н-индоло/3,2-d/./1,3/áåíçoäèàçåïèíà.
Найдено,X: С 65,27; Н 5, 14;
N 13,34; Cl 11,11.
С17 Н4 Nçосl ° Вычислено,7: С 65,07; Н 5,14;
N 13,39; Cl 11,30.
УФ-спектр, A „, н.м. (18 K 1
228 (4,41), 268(4,35)плечо,298(4,51), 320(4,08)плечо.
IIMP-спектр, &, м.д.: 2,30—
5 с. CHq(), 3, 75 — с. OCHp(a), 7, 35—
7,77-м.С, д Н«Се q -Я 7,8-м.C„> -Н.
Описываемйй способ позволяет получать новые соединения общей формулы l являющиеся производными новой
1О гетероциклической системы индоло, /3,2-d//1,3/áåíçoäèàçåïèíà и представляющие интерес в качестве потенциальных биологически активных соединений или полупродуктов для синте15 за последних.
Заказ 8137/4 Тираж 383 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д.4/5
Филиал ППП "Патент", r.Óæãîðîä, ул.Проектная,.4
Составитель Составитель С.Хлебников
Редактор П.Горькова Техред И.Асталош Корректор F,.pîøêo