Производные 5,6-дигидроиндоло (1,2- @ )хиназолина в качестве полупродуктов для синтеза производных 1(3) @ -2- метил-8 @ -индоло (3,2- @ ) (1,3) бензодиазепина и способ их получения
Иллюстрации
Показать всеРеферат
1.Производные 5,6-дигидроиндоло-
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
„.Я0„„8161 3 6 сю С 07 Р 487 04
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
И ABTOPCHOMY СВИДЕТЕЛЬСТВУ сн> (I)
Я н
Н 1
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
rlO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 2853116/23-С4 (22) 30.10.79 (46) 30.12.85. Бюл. Ф 48. (71) Всесоюзный научно-исследовательский химико-фармацевтический институт им. С.Орджоникидзе (72) А. Н.Гринев и С,Ю.Рябова (53) 547.856.1.07(088.8) (56) Авторское свидетельство СССР
У 514836, кл. С 07 3 487/04, 26.11.74.
N.Umino "Sodium acyloxyboronidri de as new reducing agents" Tetrah.
Lett", 1976, 10, 763 с.
I.Bergman,R. Carlsson, В.Sjoberg
"The Reaction of lndole and the
Indole Grignard Reagent with Phos. gene.", J. Hetегоcycl. Chem., 1977, 14(7), 1123-1134 с. (54) 5,6-ДИГИДРОИНД0ЛО(1,2,-с)ХИНАЗОЛИНА В КАЧЕСТВЕ ПОЛУПРОДУКТОВ ДЛЯ СИНТЕЗА ПРОИЗВОДНЫХ
1(3)Н-2 †МЕТ-8Н-ИНДОЛО(3,2 †)(1,3)—
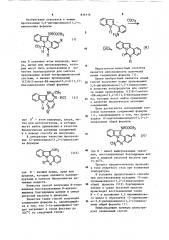
БЕНЗОДИАЗЕПИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ. (57) 1.Производные 5,6-дигидроиндоло(1,2-с)хиназолина общей формулы где R — атом водорода, хлора, метил или метоксигруппу в качестве полупродуктов для синтеза производных
1(3)Н-2-метил-8Н-индоло(3,2-d)(1,3)бензодиазепина.
2. Способ получения производных
5,6-дигидроиндоло(1,2-с)хиназолина общей формулы где R — атом водорода, хлора, метил или метоксигруппу, о т л и ч а ю— шийся тем, что производное 12-ацетиламиноиндоло(1,2-с)хиназолина общей формулы где R имеет вьппеуказанные значения, восстанавливают боргидридом натрия в ледяной уксусной кислоте при .
15-30 С.
3. Способ по п. 2, о т л и ч а юшийся тем, что процесс проводят при комнатной температуре в токе инертного газа.
816116 сос, 10
Н !
I
35
Я (tv) (III) Изобретение относится к новым производным 5,6-дигидроиндоло(1,2-с, хиназолина формулы где R означает атом водорода, хлора, метил или метоксигруппу, которые могут быть использованы в качестве полупродуктов для синтеза производных новой гетероциклической системы, а именно производных
1(3)Н-2-метил-8Н-индоло(3,2-d)(1,3)— бензодиазепина общей формулы
t где R — атом водорода, хлора, метил или метоксигруппа, и которые могут найти применение-в качестве биологически активных соединений и к новому способу их получения.
В литературе известны производные 12-аминоиндоло(1,2-с)хиназолина формулы где R — низший алкил, арил или аралкил, которые являются полупродуктами в синтезе биологически активных веществ.
Известен способ получения N-этиланилина восстановлением N-ацетилвнилина боргидридом натрия в смеси уксусной кислоты и диоксана.
Известен также способ получения соединения формулы А, заключающийся в том, что 2-(о-аминофенил)-индол нагревают в среде фосгена до
300ОС по следующей схеме:
Недостатком известных способов ,является невозможность получения новых соединений формулы (1).
Целью изобретения является новый
2р способ получения новых производных
5,6-дигидроиндоло(1,2-с)хиназолина в качестве полупродуктов для синтеза новых производных 1(3)Н-2-метил-8Н-индоло(3,2-d)(1,3)бензодиазепи25 на, которые могут найти применение в качестве биологически активных соединений.
Цель достигается описываемым способом получения соединений формулы (I), заключающимся в том, что производное 12-ацетиламиноиндало(1,2-с)— хнназолина общей формулы где R — - имеет вьппеуказанные значения, восстанавливают боргидридом натрия в ледяной уксусной кислоте при
15-30 С.
Процесс предпочтительно проводят
45 в токе инертного газа при комнатной температуре.
В условиях предлагаемого способа при восстановлении исходных 12-ацетиламиноиндоло(1,2-c)хиназолинов
5п общей формулы (III) боргидридом натрия в среде уксусной кислоты происходит восстановление связи
N = С в положении 1,2 пиримидинового .цикла и образуются 12-ацетилами55 но-5,6-дигидроиндоло(1,2-с)хиназолины общей формулы (1).
Нижеследующие примеры иллюстрируют заявляемый способ.
25
50
ПМР-спектр, б, м.д.: 1 35-д (3 = Гц) СН < 1 2,35 — с. СОСН
3 90 — с, ОСН, 5,85 — кв. Сб — Н
3 8161
Пример 1. 6-Метил-12-ацетиламино-5,6-дигидрсундоло(1, 2-) хиназ олин
К суспензии 5,78 г (0,02 моль) б-метил-12-ацетиламиноиндоло(1,2-с)-хиназолина в 420 мл ледяной уксусной кислоты при температуре 15-18 С в токе азота прибавляют при перемешивании порциями 3,78 r (0,.1 моль) боргидрида натрия. Образовавшийся бесцветный прозрачный раствор" перемешивают при той же температуре 5 — 10 мин, за ем выливают в воду (2л). Выпавший осадок отфильтровывают, промывают водой, метанолом и эфиром.
Получают 4,8 г (82,57) 6-метил -12-ацетиламино-5,6-дигидроиндоло(1,2-с)хиназолина, т. пл. 260-262 С (из смеси диметилформамид — вода
1:1).
Найдено, 7: С 74,40, Н 6,00;
N 14,55
С„н„ти О
Вычислено, Ж: С 74, 20; Н 5, 88;
N 14,42
ИК-спектр, см: 3180, 3250 (NH амид, NH имин), 1610 (С=О амид), УФ-спектр, Л щ н.м. (8 Е ) 237 .(4, 69) 305 (4, 13) 324 (4, 01) плечо, 352(4,20).
IIMP-спектр, б, м.д.: 1,44-д (3 = 6 Гц) СН ы »27-с. СООН, 6,14-кв Сб-Н, 6,66-8,06-м. ароматические протоны 9,58-с. NH амидн.
Пример 2. 2-метокси-6-метил-12-ацетиламино-5,6-дигидроиндоло(1,2 — с)хиназолин.
Из 2-метокси-6-метил-12-ацетиламиноиндоло(1,2-с)хиназолина (3,2 г 0,01 моль) ледяной уксусной
1 кислоты (210 мл) и боргидрида нат,рия (1,9 г 0,05 моль) в аналогичных упримеру 1 условиях получают 2,7 г (84X) 22-метокси-6-метил-12-ацетиламино-5,6-дигидроиндоло(1,2-с)хи45 назолина, т. пл. 235-237 С (из меганола).
Найдено, 7.: С 71,38, Н 5,97;
N 12,94
Сц H„g N О
Вычислено, 7: С 7 1, 06; H 5, 96;
N 13,06 °
ИК-спектр, у, см " 3285, 3320 (NH амид, NH имин), 1640 (С=О амид) °
16 4
6,60 — 7,70 м.ароматические прото- ны, 9,30 — с. ИН амидн.
Пример 3. 2-Хлор-6-метил-12-ацетиламино-5,6-дигидроиндоло(1,2-с)хиназолин.
Растворяют при нагревании (100110 С) 1, 1 r (0,0034 моль) 2-хлор -б-метил-12-ацетиламиноиндоло(1,2— с)хиназолина в 300 мл ледяной ук-, сусной кислоты. Раствор охлаждают (28-30 С) и в токе азота при перемешивании прибавляют порциями
0,64 r (0,017 моль) боргидрида натрия. Перемешивание продолжают еще 30 мин при той.же температуре.
Смесь выливают в воду (1,5 л).
Выпавший при этом осадок отфильтровывают и промывают водой, метанолом, эфиром.
Получают 0,87 г (79X) 2-хлор-6-метил-12-ацетиламино-5,6-дигидроиндоло(1,2-с)хйназолина, т. пл. 263264 С (из смеси диметилформамидвода 2: 1).
Найдено, Ж: С 66,40; Н 4,79;
N 12,61; Cl 10,61
Вычислено, 7: С 66,36; Н 4,95;
N 12,90; С1 10,88
ИК-спектр, 1, см : 3270, 3360 (NH амид, NH имин), 1600 (С=О амид).
УФ-спектр, Я мож, н ° м ° (9 E )
239 (4,68) 309 (4,32) 328 (4,95) плечо, 365 (4,32) °
ПМР-спектр, б, м.д.: 1,28-д (3 = 6 Гц) СН,< > 2,2-с.СООН
5 93-кв. С -Н 9,58-с. NH амид. 6,73"
7,87-м. ароматические протоны.
Пример 4. 2,6-диметил-12-ацетиламино-5,6-дигидроиндоло(1,2-с)хиназолин.
Растворяют при нагревании (100—
110 С) 2,8 г (0,0076 моль) 2,6-диметил-12-ацетиламиноиндоло(1,2-с)хи назолина в 600 мл ледяной уксусной о кислоты. Раствор охлаждают (20-25 С) и в токе азота при перемешивании добавляют порциями 1,5 г (0,0396 моль) боргидрида натрия. Образовавшийся бесцветный прозрачный раствор перемешивают при той же температуре (20-25 С) 30 мин, затем выпивают в воду (2л) и подщелачивают до рН 8-9.
Выпавший осадок отфильтровывают, промывают водой, метанолом и эфиром.
Получают 2,8 г (99X) 2,6-диметил-12-ацетиламино-5,6-дигидроиндолоСоставитель И.Герасимов
Редактор О.Юркова Техред С.Мигунова Корректор Л.Патай
Тираж 383 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Заказ 8137/4
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 у 8161 (1,2-с)хиназолина, т. пл. 240-242 С (из метанола) .
Найдено, Ж: С 74,60 Н 6,40, Н 13,69
С1ф Ц НэО 5
Вычислено, Х: С 74,73, Н 6,27
N 13,76
ИК-спектр, ), см :.3240, 3420 (ЯН амид, ИН имин) 1670 (С О амид) .
16 ь
УФ-спектр смак м (4Е )
238 (4,65) 307 (4,13) 325 (4,00) плечо, 355 (4, 13) .
ПМР-спектр, б. м.д. 1, 3-д (3
= 6 Гц) CH„„15-с. СОСН, 2,27-с.
СН,< > 5,90-кв. С -Н, 6,60-7,70 м. ароматические протоны, 9,38-с.
NH амид.