Способ изготовления камеры длякультивирования клеток
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистичесних
Ресиублик
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИ ЕТЕЛЬСТВУ () 821484 (61) Дополнительное к авт. свмд-ву (22) Заявлено 0404.78 (21) 2599541/28-13 с присоединением заявки Йо
Р11 М. Кл.з
С 12 К 1/00
Государственный комитет
СССР ио делам изобретений и открытий (23) Приоритет
Опубликовано 150481, Бюллетень No 14 (53) УДК 616-093. 57(..683 (088. 8) Дата опубликования описания 1504В1 (72) Авторы изобретения
И.O. Билько, В.Г. Войцеховский, В.В. Гашинский и Н.М. Клишина
Киевский ордена Трудового Красного Знамени медицинский институт им. акад. A.A. Богомольца и Киейгкий научно-исследовательский институт гема (71) Заявители и переливания крови (54) СПОСОБ ИЗГОТОВЛЕНИЯ КАМЕРЫ
ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК
Изобретение относится к микробиологическим и гематологическим видам исследований, связанных с выращиванием клеток in vitro u in. vivo, и может быть исследовано в микробиологических, гематологических, иммунологических и других исследованиях при создании камер для закономерностей роста и развития клеток (микро,организмов, тканевых клеток) и определения влияния на них различных факторов.
Наиболее близким к изобретению по технической сущности является способ изготовления камеры для культивиро- 15 вания клеток, заключающийся в том, что формируют стенки и днище с образованием полости для взвеси клеток, закрывают крышкой и герметизируют.
Стенки камеры по известному спо- 20 собу изготавливают иэ пластмассовых колец, а крышку изготавливают из миллипоровых фильтров путем нанесения на фильтр насечек, стерилизации и вырезания затем кружков. Полученные кружки тщательно приклеивают к кольцам клеем, полученным путем растворения фильтров в ацетоне так, чтобы матовая сторона их была обращена к клеткам (она считается менее ток- t 30 сичной) . Затем камеры s разобранном виде помещают в чашки Петри и стерилиэуют под лучами бактерицидной лампы. В последующем кольца с фильтрами помещают на увлажненные средой
199 стерильные марлевые салфетки. В кольца вносят среду 199 для проверки качества фильтра и герметичности камеры. В стерильных условиях на фильтры в кольца помещают исследуемую суспензию клеток.,Ожидают, пока культуральная среда просочится через фильтры и на них останутся только клетки. Потом накладывают кольца друг на друга (меньшее в большее), придавливают сверху лопаткой для сопоставления и герметиэируют, проклеивая щель между ними клеем. Полученные таким образом камеры имплантируют в организм животного (1).
К недостаткам известного способа относятся сложность и трудоемкость изготовления большого количества камер, -а также то, что полученные камеры, хотя и позволяют выращивать клетки iin vivo u in vi«>i однако они выполнены из оптически непрозрачных материалов, что не позволяет осуществлять наблюдение эа одними и теми же отдельными клетками в
821484 динамике их роста и развития непосредственнО в камере; для изучения исследуемых клеток камера, в которой они выращивались, должна быть демонтирована, клетки извлечены и перенесены на предметное стекло, что нарушает первоначальное взаимораспо)ложение клеток, их форму и размеры.
Часть клеток может разрушаться. Камера .не позволяет осуществлять непосредственное наблюдение эа ростом, размножением и дифференцировкой исследуемых клеток под контролем микроскопа в состоянии их развития. Камера имеет жесткую структуру, что отрицательно влияет на организм животного при имплантации. Методика не позволяет получать одновременно необходимое количество камер, так как каждая из них готовится .отдельно.
Цель изобретения — упрощение, удешевление способа и возможность иссле- 20 дования клеток в камере на разных этапах их развития.
Для достижения этой цели стенки . днища и крышку выполняют иэ полиакриламидного геля, при этом стенки и 25 днище формируют, заливая рабочий раствор в пространство между двумя параллельными пластинами, верхняя из которых имеет выступы для образования полостей в нижней пластине,. полимеризуют смесь до образования геля и снимают верхнюю пластину, а герметизацию камеры проводят путем наложения сверху листового материала с образованием зазора между ним и кРышкой, заливают рабочий раствор и полимеризуют до образования геля, снимают листовой материал и выштамповывают камеру.
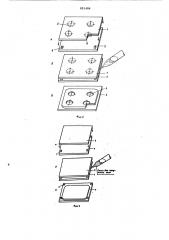
На фиг.1 изображена камера для культивирования клеток, общий вид; 40 на фиг.2 — формирование полосы для размещек.1я клеток; на фиг.3 — приготовление плоской гелевой пластины; на фиг.4 — введение в полости суспенэии клеток и накладывание крышек) на 45 фиг.5 — герметизация камер путем закрепления крышек в гелевой массе; на фиг.6 — вырезание камер.
Камера готовится следующим образом. 50
Берут четыре плексигласовые пластины 1 — 4. На поверхность пластины
1 в шахматном порядке на расстоянии примерно 15- -20 мм приклеивают водост ой к им клеем предварит ель но вырезанные из пластика или медицинской резины плоские кружки 5 диаметром
6 мм и толщиной 1-2 мм (фиг.2а).
Пластины стерилизуют кипячением.
Пластину 1 накладывают на прямоугольные плексигласовые подставки 6 толщиной 2-3 мм, расположенные по бокам пластины 2 таким образом, что-„ бы плоскость с приклеенными кружками 5 пластины 1 была обращена к пластине 2 (фиг.2а,б). Пластину 3 65 накладывают на прямоугольные плексигласовые подставки 7 толщиной 1-2 мм, расположенные по бокам пластины 4 (фиг.За,б) . Профильтрованные через бактериальные фильтры рабочие раст- . воры для получения полиакриламидного геля смешивают (стерильно) и заливают в пространство между пластинами 1 и 2 (фиг.2б) и 3 и 4 (фиг,Зб).
При этом капиллярные силы удерживают жидкость между пластинами, смесь растворов полимеризуют через 1520 мин (в зависимости от режима полимеризаций) . После этого пластйны
1 и 2 снимают с подставок. На пластине 2 остается гелевая пластина с полостями 8 (фиг.2в}, а на пластине 4 плоская гелевая пластина (фиг.Зв).
Из плоской гелевой пластины сверлами для пробок вырезают кружки, выполняющие функцию крышек 9 диаметр которых на 2-3 мм больше диаметра полостей 8. В полости 8 вносят исследуемые клетки (фиг.4а). Сверху полости 8 покрывают крышками 9.
При исследовании в камере неприкрепляющих клеток (например, подвижных микроорганизмов) последние прижимают ко дну луночки гелевым кружком, диаметр которого соответствует диаметру луночки. При этом камера будет без внутренней -полости.
Герметизацию камеры осуществляют следующим образом.
По бокам плексигласовой пластины
2 устанавливают подставки 10 таких размеров, что после положения на них . листового материала или пластины 3 образуется зазор в 1-2 ьм между этим материалом (пластиной) и крышкой 9. В образовавшееся пространство заливают смесь рабочих растворов, которая, полимеризуясь, соединяет пластины между собой (фиг.5б) . Листовой материал (плексйгласовую пластину 3) снимают с подставок 10.
Сверлами для пробок диаметром 1215 мм вырезают камеры.
Изготовленные камеры отмывают в физиологическом растворе NaCI растворе Хенкса, среде 199 в зависимости от того, какие клетки подлежат исследованию. В дальнейшем камеры имплантируют в организм:животного или помещают в питательную среду при культивировании in vitro.
Методика предусматривает изготовление одновременно камеры различных размеров и в необходимом количестве в зависимости от целей исследования, Камеры,изготовленные.по предлагаемому способу иэ полиакриламидного геля, обеспечивают возможность изучения одних и тех же отдельных кле" ток в динамике их роста и развития. ,Цля этого. клетки подвергают микроско» пированию непосредственно в камере.
Для облегчения нахождения клеток в камеру совместно с клетками при их
821484 посеве можно вводить специальные маркеры (частицы активированного угля, убитые дрожжевые клетки и др.) .
Через необходимое время камеры извлекают из организма или питательной среды, Под микроскопом находят ту же группу клеток и подвергают исследованию. При необходимости пастеровской пипеткой клетки могут быть извлечены иэ камеры. Камеру можно.пов0 торно имплантировать в организм или помещать в питательную среду.
Изготовление камер из полиакриламидного геля обеспечивает оптическую прозрачность, которая позволяет проводить наблюдения исследуеьих клеток световой микроскопией в динами- 15 ке их роста и размножения. Камеры эластичны, хорошо переносятся животными и обладают способностью конфигурировать в полостях при имплантации в организм даже при одновремен- Щ ной имплантации одному животному
2-3 камер. основными преимуществами изготовленных камер данным способом являются оптическая прозрачность, эластичность, биологическая инертность используемого для изготовления камер материала. Способ их изготовления более прост, доступен и позволяет одновременно получать необходимое количество камер.
Формула изобретения
Способ изготовления камеры для культивирования клеток, заключающийся в том, что формируют стенки и днище с образованием полости, закрывают крышкой и : герметизируют, о т л и ч а ю шийся тем, что, с це-лью упрощения, удешевления способа и возможности исследования клеток в камеру на разных этапах их развития, стенки, днище и крышку выполняют из полиакриламидйого геля, при этом стенки и днище формируют, заливают рабочий раствор в пространство между двумя параллельными пластинами, верхняя иэ которых имеет выступы для образования полостей в нижней пластине, полимеризуют смесь до об разования геля и снимают верхнюю пластину, а герметизацию камеры проводят путем наложения, сверху листового материала с образованием зазора между ним и крышкой, заливают рабочий раствор и полимериэуют до образования геля, снимают листовой материал и выштамповывают камеру.
Источники информации, принятые во внимание при экспертизе
1. Евгеньева Г.П. Иежклеточные взаимодействия и их роль в эволюции. М., Наука, 1976, с.31-37.
821484
Составитель И. Шабалина
Техред A.Áàáèíåö : Корректор С. Шекмар
Редактор Т, Парфенова
Тираж 528
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Подписное
Заказ 1718/40
ЮЮЮЮЮЮ
Филиал ППП Патент, r. Ужгород, ул. Проектная, 4