Способ получения -метиловых сложныхэфиров гидантоина
Иллюстрации
Показать всеРеферат
О П И С А Н И Е
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Союз Советских
Социалистических
Республик
<„ЙОООЗ (61) Дополнительмыи к патемту— (22) Заявлемо 190678 (21) 2628302/23-04 (23) Приоритет — (32) 20. 06. 77 (зцм, к .з
С 07 0 233/72/
A 01 М 43/42
Государственный комйтет
СССР ао деяам изобретений и открытий (33) Япония (31) 73721/77
Опубликовано 230781,Бюллетень HP 27
Дата опубликования описания,25 0781 (5З) УДК 547. 783,. .07 (088.8) (72) Авторы мэобретеиия
Иностранцы
Нобусиге Итая и Масатика Хирано (Япония) Иностранная фирма
"Сумитомо Кемикал Компани, Лимите (Япония) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ М-МЕТИЛОВЫХ СЛОЖНЫХ ЭФИРОВ
ГИДАНТОИНА
;к н" («М N-СН -0- С-Я 1 х
R-$+ СН А р
Х вЂ” з
Изобретение относится к способу получения М-метиловых сложных эфиров гидантоина формулы где один иэ радикалов Х и У является карбонильной группой, а другой является метиленом, этилиденом или пропилиденом, R является низшим алкилом, низшим алкенилом, или низшим алкинилом, имеющими до 3 атомов углерода, R> является группой, представленной формулой и CH> CH>
1 си
С-G R (") / R MAH с /
4 с I сн сн
R - атом водорода или метильная группа, если R является атомом водорода, то R является метоксииминометилом или 2,2-двузамещенный винил, в котором заместители могут быть выбраны из группы, включающей метил, винил, хлор, фтор и бром, или оба заместителя могут образовать тетра" метиленовую цепь," если R является метильной группой, то R тоже метильная группа, R6 — метил, метоксигруппа, фтор, хлор, бром или 3,4-метнлендиоксигруппа и и равно 1 или
2, которые могут быть использованы в качестве инсектицидов и акарицидов.
Известен способ получения сложных эфиров взаимодействием спиртов с карбоновыми кислотами или их производными $1j .
Цель изобретения — синтез новых соединений, обладающих ценными свойствами и позволяющих их использовать.в сельском хозяйстве.
Поставленная цель достигается тем, что согласно способу получения М-ме2О тыловых сложных эфиров гидантоина формулы I, спирт или его галогенид формулы где и, Х и У имеют значения, определенные выл, à A представляет собой гидроксильную группу или атом
850003 галогена, такого как хлор, или бром, с карбоновой кислотой формулы !
Ъ, С-Сн — с-Он
Р
С сн cí ис, cH>
3, У ! ч ион CH
5" с-с" Он
0 в которых R,R>,R и и имеют определенные выше значения,или с ее реакционноспособным производным.Реакционноспособное производное карбоновой .кислоты означает галоидангидриды (смешанные) ангидриды кислот, соли щелочных металлов и органические третичные основные соли. Если исполь- 20 зуют спирт формулы II (T,å. в данном случае А представляет собой гидроксильную группу) и карбоновую кислоту формулы III или IV; то реакцию преимущественно проводят в присутст- р5 вии дегидратирующего агента такого, как дициклогексилкарбодиимид, в соответствующем растворителе таком, как бензол, толуол, диэтиловый эфир при температуре от 10оС до точки кипения используемого растворителя, и реакц .я протекает в течение времени от 30 минут до одного дня. Если используют спирт формулы II (т;е. A представляет в данном случае гидроксильную группу) и галоидангидрид, 35 предпочтительно хлорид или бромид формулы Ill или IV, то реакцию проводят преимущественно в подходящем растворителе таком, как бензол, толуол, диэтиловый эфир при температуре от 0 С до точки кипения используемоо
ro акцептора, например органического третичного амина, т.е. пиридина или триэтиламина. Реакция завершается вскоре после смешения реагентов. 45
Если используется (смешанный) ангидрид кислоты вместо галоидангидрида, то реакцию проводят таким же способом, за исключением того, что реакция протекает более медленно и при 5О повышенных температурах.
Если используют галоидное производное спирта формулы II (т.е. в данном случае А представляет собой хлор или бром), то карбоновая кислота фор- 5 мулы !II или (Ч используется в виде
55 соли щелочного металла или органической третичной основной соли или они могут быть добавлены в реакционную систему вместе с соответствующим основанием. 60
Спирт формулы II (т.е. при A в значении гидроксила) легко получают реакцией соответствующего гидантоина с формальдегидом или его эквивалентами (т.е. параформальдегидом). 65
Галоидзамещенные соединения спиртов формулы II (т.е. в которой А является атомом галогена такого, как хлор или бром) легко получают реакцией спирта. формулы !! с галогенизирующим агентом (т.е. с хлорокисью фосфора, треххлористым фосфором, трехбромистым фосфором, -хлористоводородной кислотой, бромистоводородной кислотой, хлористым тионилом). г
Пример 1. 8,4 r 1-пропаргил-3-гидантоинилметилового спирта растворяют в смеси 26 мл бензола и
6 r пиридина и к полученному раствору при перемешивании по каплям добавляют раствор 12,0 г хлорангидрида
46 -цис-транс-2,2-диметил-3-(2,2-дихлорвинил)-циклопропанкарбоновой кислоты в 36 мл бензола. Реакционную смесь оставляют на ночь и добавляют небольшое количество воды для растворения выпавшего в осадок хлоргидрата пиридина, а полученные соли отделяют друг от друга. Органический слой последовательно промывают 5Ъ-ной водной хлористоводородной кислотой, водным раствором углекислого натрия и насыщенным водным раствором хлористого натрия и затем сушат над безводным сульфатом натрия. Раствор бензола концентрируют и очищают хроматографией на силикагеле. Выход 16,7 r (93, 0Ъ ), п " 6 1, 5341.
Найдено %: С 50,41, Н 4,32, И 7,62.
Вычислено,Ъ: С 50,15, Н 4,4, Н 7,80.
" Р и м е Р 2. 8,4 г 1-пропаргил-— щантоинил !етил
9,0 r d,9 -транс-2,2-диметил-3-(2-метилбутадиенил)-циклопропанкарбоновой кислоты растворяют в 52 мл бензола и в раствор добавляют при перемешивании 16,5 г дициклогексилкарбодиимида и смесь оставляют на ночь.
На следующий день реакционный раствор нагревают при температуре обратного холодильника в течение 2 ч и охлаждают. Выпавшую в осадок дициклогексилмочевину удаляют фильтрацией, а растворитель концентрируют. Последующую обработку проводят по примеру 1.
Выход 11,1 (67,3%) о 1,5373.
Найдено,Ъ: С 65,19, Н 6,78, Вычислено,Ъ: С 65,43, Н 6,71, и 8,48.
Пример 3. 8 5 г 1-аллил-3-гидентоинилметилового спирта растворяют в смеси 26 мл толуола и 6 г пиридина, в раствор добавляют 20,4 г а!-(4-хлорфенил)иэовалерианового ангидрида с последующим нагреванием при температуре обратного холодильника в течение 3 ч. После охлаждения полученный раствор толуола экстрагируют 5%-ной гидроокисью натрия для удаления карбоновой кислоты, образовавшейся в качестве побочного продук850003 та, с последующей промывкой насыщен. ным водным раствором хлористого натрия. Раствор толуола концентрируют и остальные операции проводят аналогично примеру 1. Выход 13,0 (71,0%), п 1,5357.
Найдено,%: С 58,92, Н 5,77, N 7,49.
Вычислено,%: С 59,26, Н 5,80, N 7,68.
Пример 4. 9,3 г 1-пропаргил-3-гидантоинилметилхлорида и 11,7 r
48 -транс-2,2-диметил-З-циклопентилиденметилциклопропанкарбоновой кислоты растворяют в 63 мл ацетона и к нему добавляют раствор 8,1 r триметиламина в 63 мл ацетона по каплям. 15
Реакционную смесь постепенно нагревают до температуры обратного холодильника и нагревание продолжают при этой температуре в течение 2 ч. После охлаждения солянокислый триэтил- 20 амин удаляют фильтрацией, к фильтрату добавляют воду и бензол, которые перемешивают встряхиванием, и разделяют на два слоя. Органический слой последовательно промывают 5%-ным водным раствором гидроокиси натрия и насыщенным водным раствором хлористого натрия и растворитель концентрируют. Последующие операции выполняют аналогично примеру 1. Выход
° 10,7 г -(62,1%), пЖб 1,5172.
Найдено,%: С 66,30, Н 7,08, К 8,39.
Вычислено,%: С 66,26, Н 7,02, и 8,13.
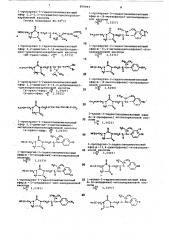
Получают следующие соединения
K=G CH -N Н«СН-0—
2 2 нс .с
2 ф
Сн с-Сн — Сн-сн=c. с сн
НъС Сн
1-пропаргил-3-гидантоннилметиловый эфир хризантемовой кислоты (4-транс-эфир: n " 1 5185)
I, С щ-СН О C«CH-CH-СН С
" 2! И r д, Сф — С д Ф Сй СНЪ 0 о
L!
С,СК
НС С-СН -t4 й-Сн О-С-СН Сн-СН С
Ф Сн C,Н
Ъ Ъ
О о !!
С гсе
НСЬС CH -t4 H-CH 0 — G-CH CH CH G
2! 2 К сг iC6, н2С G
Сн С
2 Снъ Снъо
1-пропаргил-3-гидантионилметил-2,2-диметил-3-(2,2-дихлорвинил)-циклопропанкарбоксилат (4Е -цис-транс-эфир: пп 1,5341) (0!-транс-эфир: п2 5 1,5328) 1-аллил-З-гидантоинилметил-2, 2-диметил-3- (2 2-дихлорвинил) -циклопропанкарбоксйлат (d8 -цис-транс-эфир: и> 1 5303) 1-пропил-3-гидантоинилметил-2,2-диметил-3-(2,2-дихлорвинил)-циклопропанкарбоксилат (dK -цис-транс-эфир: и" 1,5288) 3.„ ц Сн д, я ы-СНр-С-См-См-см С, С вЂ” СЙ2 сн
3-пропаргил-1-гидантоинилметиловый эфир 2,2-диметил-3-(2,2-дихлорвинил)-циклопропанкарбоновой кислоты (Ю -цис-транс-эфир: п 0 1,5365) и CÅ
НССНС И и СНОС СН CH-CH С !,", се ..С вЂ” СН2
0 СН
3-аллил-1-гидантоинилметиловый эфир
2,2-диметил-3-(2,2-дихлорвинил)—
-циклопропанкарбоновой кислоты (43 -цис-транс-эфир: п ъ 1 5290)
О
)!
С rF нас-CH -к N-Сн о-C-Сн Сн-Снхс
С
Н2СС
Ф Сн С
Ъ МЪ
1-пропаргил-3-гидантоинилметиловый эфир 2,2-диметнл-3-(2,2-дифторметил)—
-циклопропанкарбоновой кислоты (46-транс-эфир: п о 1,4925) 1-пропаргил-3-гидантоинилметиловый эфир 2,2-диметил-3-циклопентилиденметилциклопропанкарбоновой кислоты (4% -транс-эфир: п 1,5172) О е
CH-CH CH -N N СН20 С-CH-CH-CH=C! (" се о с
СН вЂ” C r x Ъ
С Ъ
341%С-СН -и м-Сн D -G-CH — Сн-С! Сй
0,с — С 0 KF С„
850003
d0
С вЂ” с 2
ОФ
1-пропаргил-3-гидантоинилметиловый эфир 2,2-3,3-тетраметил-циклопропанкарбоновой кислоты (точка плавления 86-93 С) о н йС%Ф Ей - С и-сн о-с-Сй - Си-С=С ! И -С Сй
У . нс 6 о щъ \ HqC C« о -пропаргил-3- гидантоннилметиловый эфир 2,2-диметил-3-(2-метнлбутадиенил)-циклопропанкарбоновой кислоты (49-транс-эфир: п2 1 5773)
Р
Сril
Н С-Сн-Сй -«МСй О-С СН-СйСН С о с
1-пропаргил-3-гидантоинилметиловый эфир 2,2-диметил-3-(2,2-.дибромвинил)-циклопропанкарбоновой кислоты (d-транс-эфир: п> 1,5925) (d-цис эфир: п2Е 1,5921) 3
gСаСм-С -«Сй О-С Сй CM Сй Й О СН !
Сй — С
Сйэ Ф
I
1-пропаргил-3-гидантоинилметиловый эфир 2,2-диметил-З-метоксииминометилциклопропанкарбоновой кислоты (d-транс-эфир: и о 1 5175) .р I
3 Н, гсйь сн
l нс с-сн -и н-сн î-с,-сн ce
2i i il нс,— с, 2
1-пропаргил-3-гидантоинилметиловый эфиро -(4-хлорфенил)-изовалериановой . кислоты (nD 5 1, 5 3 77 )
9 ньс rC43 он
НС C-Сн -« «-Сн,О-С,-СН
ll
Н2С С О СЮ
+о
1-пропаргил-3-гидантоинилметиловый эфирЫ -(3-хлорфенил)-изо-валериановой кислоты (n 1,5391) 9 fktarсйь с GH йо«с сн-««сй о-с,-сй (с ъ i i и йс с о
+о
1-пропар гил-3- гидантоин илметиловый эфир с -(4-метилфенил)-изовалериановой кислоты (п2оо 1 5257
5 о сй; . сць о с
/ сн
Сн всн-сн - и -СН.О-С -с,й — 6 и I I и н й,С вЂ” С О
1-пропаргил-3-гидантоинилметиловый эфир 0t -(3,4-метилендиоксифенил)-изовалериановой кислоты (п 5 1 5371)
Ю у йОЬО-Сн «««-См О-0-Сн ОСн ! } ф С о
Фо
1-пропаргил-3-гидантоинилметиловый эфир <6 -(4-метоксифенил)-изовалериановой кислоты (пД 1,5290) о СН Сй
Сн Сй"ОН Н и Cve C,-Сй Ь
1 к йс,— с о о
1-аллил-3-гидантоинилметиловый эфир
dt(4-бромфенил) -изовалериановой кис3S лоты (и 1,5423) о ЪС с, Сйь се
GH
40 I ну,— с о
1-пропаргил-3-гидантоинилметнловый эфир at (3,4-дихлорфенил)-изовалериа4$ новой кислоты (п 1,5403) О йС rCHÚ Сн
1 нсьс-сн-й о и-сн о-с-о м нс — c, о
55 1-аллил-3-гидантоинилметиловый эфир о (4-хлорфенил)-изовалериановой кислоты (и 1,5357) о НЬсi, rC 3
ll сн » j йСС-С -Ь К-СН О-С -CH
850063 се
-смщ-сн-сн-сн = с с са
rw сн с<>
1»скс-с
В таблице приведе«Ы значения Радикалов R, т, у н .в соединении формулы
О щ; -снэон
Х М
1,5230
ИСэССН а сн -CHй о
-С1,5250 нс5с-сн нз
-С1
1,5107 нс с-снО
It
-СН С СН-СНй й
-сн
II
-С1,5102
Н C HACH-CHRй
1,5107
-сн
О
М н®с-сн -сн
СнэССН 1,5092 сн с н.
3.
-С
О
В есю
1,5070
Формула «эобретення
3. - .см;е-С-а,, 0
3-щюпаргил-1-гидантоинилметиловый
° эфир с6-(4-фторфенил)-иэоэалериановой кислоты (нэ е 1, 4478 )
Cll СИ,, . 1-пропаргнл5-метил-3-гидантоинилмб гиловый эфир 2,2 дийетил-2-(2,2дихлорвинил) -циклощюпанкарбоновой
; кислоты ,юсн:ь э сне и ева бо сн СН Си С
3 с иу,с ц . ь
1.Способ получения И-мэтиловых слоиных эфиров гида«тонна формулы где один из радикалов Х и У является карбонилвной группой, а другой — мв тиленовой, этилиденовой или пропилиденовой группой, R„ является ниэщим ез
1-пропаргил-5-метил-3-гндантоннилметиловый эфир хриэантемовой кислоты
1 "пропаргил-5-з тнл-3-гидантоинилметилоиый эфир 2,2-днметил-3- (2, 2. дихлорйинил)-циклопропанкарбоновой кислоты в
1 алкилом, ниэщим алкенилом илн низшим алкинилом, имеющими до 3 атомов углерода, и является группой формул в котоРых й, представляет собой атом водорода илй метилвную группу,,R> является метоксинминометилвной или
2,2-двуэамещенной внннлвной группой, 850003
М - kf -с у к — э
Сна
СН
@-он 25
1 Н
М Р
Составитель Г. Жукова
Редактор С. Патрушева Техред М,Голинка Корректор С. Щомак
Тираж 443 Подписное
ЭНИИПИ Государственного комитета СССР по делам изобретений н .открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Эаказ 6145/83
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 в которой заместИтели могут быть выбраны из группы, включающей метил, винил, фтор, хлор и бром нли оба заместителя могут образовать тетратметиленовую цепь; если R является вютильной группой, то R4 тоже метильная группа, йэ представляет собой метил,метокси, фтор, хлор, бром или
3,4-метилен-диоксягруппу и и равно 1 или 2, отличающийся тем, что спирт нли его галогенид формулы 1! где Н„Х и Y имеют вышеуказанные значения, А является гидроксильной группой или атомом галогена, подвергают взаимодействию с карбоновой кислотой 20 формулы 1 I I илн I V где R>,R<, К5 и и имеют значения, указанные выше, или с ее реакционным производным, с выделением целевого продукта.
2. Способ по п. 1, о т л и ч а юшийся тем, что, когда A является гидроксильной группой, в качестве реакционноспособного производного карбоновой кислоты используют ее галоидангидрид или ангидрид и процесс проводят в среде органического растворителя в присутствии акцептора кис« лоты.
3. Способ по п. 1, о т л и ч а ю шийся тем, что, когда А является гидроксильной группой, взаимодействие соединения формулы II с карбоновой кислотой ведут в среде органического растворителя в присутствии дегидратирующего агента.
4. Способ по п. 1, о т л и ч а юшийся тем, что, когда А является галогеном, в качестве реакционноспособного производного карбоновой кислоты используют ее соль щелочного металла или ее органическую третичную основную соль.
Источники информации, принятые во внимание при экспертизе
1. Каррер П. 5урс органической химии. Л., "Хим. литература", 1960, с. 2б2.