Способ получения производных азетидинона
Иллюстрации
Показать всеРеферат
Союз Созетскыз
Социалистыческиз
1тес ублик
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (1)869558 (61) Дополнительный к патенту (22) 3аявлено 0892.78 (21) 2577000/23-04 (23) Приоритет — (32} 0 8 ° 02 ° 77 (31) 13452/77 (33) Япония
Опубликовамо 3009.81Бюллвтемь HP 36
Дата опубликования описания 300981 (51)м. к„.з
С 07 0 205/08
Государстаенный комнтет
СССР
llo делам нзобретеннй н открытнй (53) VlkK 547.466 ° .2=318(088.8) Иностранцы
Соичиро Юзо, Иицуру Есиока, Терудэи цудзи, и Ват ару Н агат а (Япония) (72) Авторы изобретемия
Икуо Киккава г "л«.. ,,«, «," ;, -, „ ",;., Иностранная фирма
"Сионоги энд Ко, Лгд" (Япония) (71) Заявитель
« (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АЗЕТИДИНОНА
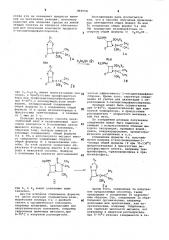
3)CONK 0 CH2R 2
« СБС Л2
НЗ
0 3
ОСИ 21 2
E2eONE
С=С .- Снз
1 СНЗ
СОЕ3
Изобретение относится к способу получения производных азетидинона, используемых в ка-естве промежуточных соединений при синтезе биологически активных соединений.
Известен ряд соединений аэетидинона, имеющих другую структуру и конфигурацию P1$ .
Цель изобретения — получение новых соединений, являющихся промежуточными продуктами для получения биологически активных соединений.
Производные азетидинона представлены формулами где R — фенил, фенилтио или феноксимет ил;
R - винил, этинил, галоидэтинил или остаток формулы-С-Сн>-2, где Y — кислород, метилен или метоксикарбонилметилен, 7 — ацетокси или 1-метилтетразол-5-ил-тно; и фенилметокси, дифенилметокси или третбутилокси.
Предпочтительными соединениями являются d. †(2-оксоазетидин-1-ил)-aL-изопропенилацетат(1а) и aL -(2-оксо-азетидин-1-ил)- (,-изопропилиденацетат(1б), которые оба имеют замещенную амидную группу (й СОНН-) в положении
3 в R конфигурации и замещенную алкоксигруппу (RICH 0-) в положении 4 в R конфи гурации.
Кроме того, любая группа в амидной группе в положении 6 или 7 природных или синтетических пенициллинов или цефалоспоринов может быть представлена в качестве группы R, СО соединений 1а и 1б, и любая ацильная боковая цепочка, используемая в синтезе антибиотиков, также применима в предлагаемом способе. Группа RR широко варьируется в таких пределах, 869558
R C0NH 0СН R
S-СН-С.Сн
О С0 сн
R(r,К и
СН2
СНС С
СОР, ""2CO2ßH <Е) ики
RlC О! !Н
ОСH HR
М-С=С С 3
О СН
СН3
ИЛИ
Р! С
О!, СНЗ
М-С С СН, »«
3 «1! Я
g ggNH
Д
О
ОН, //
N CH-С
СН
C0R
3 когда это не оказывает вредного влияния на протекание реакции, поскольку удаление или введение группы на любой стадии синтеза не является обязательным для получения конечного продукта
1-а к с адет и аце Фала с пари нов . где В, К и R> имеют вышеуказанные эна-yg чения, н присутствии трехфтористого бора или трифторметансульфакислоты при 0-40 С, с последующей, если необходима, изамеризацией соединения общей Формулы 1а н соединение общей формулы I.á в среде метиленхлорида в присутствии триэтиламина в течение от 1 мин да 5 ч.
Согласно известного способа оксазалиновый азот и оксазолиновый кис,лород находятся в 8-положении азетидиновага кольца, т.е. в положении, обратном тому, которое имеется в исходных соединениях общей формулы !! а и Иб, и используется метанол вместо специальна замещенных спиртов 4О общей формулы li! в предлагаемом способе. По этой причине селективно образуется 6-d„-водород вместо 6-J3-водорода в известном способе. Водород в положении бд.является неотъемлемой где и и R имеют указанные выше значейия.
Другое исходное соединение формулы !!б легко получают посредствам взаимодействия изомера !!а с двойной 60 связью и органического основания, например алкиламин, аралкиламин или неорганического основания, например гидроокиси щелочных металлов,при
0-70 С в инертном растворителе.
Поставленная цель достигается тем, что в способе получения производных .азетидинона общих формул Та или !
I6 соединение общих формул II а. или !! б подвергают взаимодействию со спиртом общей формулы 111 RgCHgOH частью эффективного 1-оксадетиацефалоспорина. Кроме того, структура соединения 1б удобна для циклизации с образованием 1-оксадетиацефалоспоринов.
Реакция может быть осуществлена при 0-40 С, предпочтительяо при комнатной температуре, в присутствии растворителя - хлористого метилеиа— или без него.
По завершении реакции полученное соединение может быть выделено и очищено с использованием обычных методов: экстракция, промывка водой, сушка, концентрирование, хроматографическое разделение и т.п.
Соединение формулы Ila получайт путем нагрева б- эпи-пенициллин-1-оксида общей формулы !Ю при 70-130 С предпочтительно в присутствии десульфир.ющего агента, например триарилфосфина, <триалкилфосфина и триалкилфосфита, !! с!
Кроме того, соединение Ia полученное предлагаемым способом, также превращают в соединение I6 аналогичным образом. Так, соединение Та обрабатывают органическим, например алкиламин или аралкил амин, или неорганическим, например гидроокись
> или карбонат щелочного металла, основаниями в инертном растворителе.
При 0-70 C реакция завершается в те869558 чение от 1 мин до 5 ч. Укаэанный раСтворитель представляет собой спирт и другие органические растворители, . пригодные для взаимодействия соединения IIа или Пб с соединением 1tl .
Соединение I6 используют для получения 1-оксадетиацефалоспорннов. А именно, соединение Еб гидратируют, окисляют с отщеплением боковой це почки в положении 1 кольца азетидинона, затем восстанавливают, галогенируют по оксигруппе заместителя в положении 1 и подвергают взаимодействию с трифенилфосфином с образованием соединения: Виттига. Полученное таким образом соединение Виттига цнкли зируют с образованием целевого 1- IS
-оксадетиацефалоспорина.
Предлагаемый способ позволяет получать 1-оксадетиацефалоспорины с большей селективностью и с высоким выходом. 20
Пример 1. Дифенилметил-c(,—
-4 (R)-пропаргилокси-3 (R)-фенилацетамидо-2-оксо-аэетидин-1-ил- -изопропилиденацетат.
К раствору дифенилметил-Ы.-(1R,5S)- yS
-бенэил-(7-оксо-4-окса-2,6-диазабицикло)-3,2,0-(гепт-2-ен-б-ил)-д.-изопропилиденацетата (54 r) в сухом пропаргиловом спирте (50 мл) добавляют эфират трехфтористого бора (2 мп). В процессе прослеживания течения реакции методом тонкослойной хроматографии к смеси добавляют дополни тел ьнсе колич ест во эфират а трехфтористого бора (общее количество
3,5 мп): После исчезновения исходного вещества реакционную смесь выливают в смесь этилацетата (400 мл) и воды (400 мл) с добавлением кусочков льда,перемешивают и нейтрализуют водным раствором бикарбоната натрия 40 (2 г).
Органический слой отделяют и водный слой промывают этилацетатом,. (200 мл). Объединенный органический слой и промывочный этилацетатный 4 раствор высушивают над сульфатом натрия и выпаривают насухо, получают
50,5 r продукта. Последний разделяют на хроматографической колонке с си.лйкагелем, деактивированным 10е воды (500 r) и элюируют смесью бензола и этилацетата (19: 1+4: 1) . Остаток иэ элюата смешивают с эфиром (50 мл) и получают кристаллы в виде осадка.
Кристаллы отделяют фильтрацией и перекристаллизовывают иэ этилацетата, получая заданное соединение (20 r) т.пл. 123,2-124,0 С,Щ 55,7+1,0 (хлороформ, с = 1,007). Строение ,полученного соединения подтверждено методами ИК- и ЯИР-спектроскопии.
Пример 2. а) Дифенил-с{;4(R)†(3-бромпропаргилокси )-3(R)-бензоиле амино-2-оксо-азетидин-1-ил-Ы-иэопропенилацетат.
При нагревании растворяют дифенилметил- -(1R, 55)-3-фенил-7-оксо-4-окса-2,6-диазабицикло-(3,2,0)-гепт-2-ен-б-ил-а .-изопропеннлацетат (136 мг) в З-бромпропаргилово,л спир" те (61 мкл). К раствору добавляют эфират трехфтористого бора (2 мкл).
Смесь перемешивают в течение 45 мив при комнатио температуре и затем выдерживают при ООC в течение двух дней. Применяют методику выделения как в примере 1 и получают нужное. соединение (180 мг).Строение подтверждено методами ИК-.и ЯИР-спектроскопии. б) Дифенилметил-А-4(R)-(3-бромпропаргилокси)-3(R)-бензоиламино-2-оксо-азетидин-1-ил- -изопропилиденацетат.
Указанный выме продукт (180 мг) растворяют в хлористом метилене (0,5 мл) и, кроме того, добавляют триэтиламин (41 мкл). Смесь перемешивают при комнатной температуре в течейие 1 ч. Растворитель удаляют выпариванием с образованием пористого остатка. При перекристаплизации из смеси пентена и эфира получают порошок заданного соединения (160 мг)
Строение подтверждено данными ИКи ЯИР-спектроскопии. Выход 90„8%.
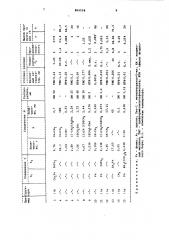
Пример ы 3 — 15. Проводят аналогично примеру 1. Результаты сведены в таблицу. Строение подтверждено данными ИК- и ЯИР-спектроскопии.
869558
I I
1 1
I tttt
1 1
1 о
1 g <<1
1 ©
1 Ц <
< он
IC хх
Р ) с
Ф м
° ь о
1
1 !
1
1
1
1
t
1
1
I !! а о с <Ч Ф Ф
I Ch
<О а-<
° 3 у
I CO
1
1 !»
«
an
ОЪ о о с о
<«ъ м
<Ч Ih о
<<Ъ
In Ф с
< Ъ сч tn
»» Ф о а
<Ч
D c
Ю
<О с
<ЭР
° 4 Ф Сч
Ю
<О с
<Ч
an
<<Ъ
% » ВЫ|! o о м м а
g о вй н
I Х 1 А
1 1 М <<н 1 !
<::цнх
1 1 ttt 1
Х< Эg а, 1
М I 1
1 Н ttt ttt Е
ttI t ОХИ
l «C йхнй
1 I
ICl
In с с о ю
CO с о Ф с
Фч »4
1 1 и й
1 1
<Г\ Я)
<Ч СЧ
1 1 ш о
<Ч
М н
&4 Х ь
<Ч и и
Х н
° и
<О
С«4 с
Ю н н
34 34
О< С \ г» In о о с с о о
IO f
«Ъ < с о о
e u »
fCI Е»
<О ь о с о
Ю о с
fC1 D с с о
Х Е
u u » » г» 4.4 о о с с о о в в ». ч
Ф Р3
<Ч о <ч с с о о в и
Е»
fCI Е»
1 1 с о э
1 8 1
1 ttj
Р! а
1 м»Ф е.4 о с о
Ю м а-4 ГЧ с с
D Ю
<О О
<Ч
»-1»-< с с о о
In »3
° 3 с с м сч
»"< Cf!
ЧЭ <Ч с с о <ч
< о с CO
СЧ т.4 еО х
О
Ю
Ю
<Э
С» rt
z z
<Э О и 1
z о о
CII х о ь
О сС
«4 z и о tl о
О О
О
Ю
Х и 4
СП О
<Э I
«
<.Э D н э
Я»
С4 о ! о . х
О О и 4 с4 т z о о !! « х
О О
1 и О
1 с
1 ю о м ю т» с с с о
<О м an
<"4»У с о а
an м
<ч с с о о
46<
° 4! т и
Ck
iр t
lA <О с
° Ф
<О г4 с с О\ ф\ tn Ф Ch о оЭ с с с-! СЧ
I 1 1 ! 1 t
С«Э
1 ф <К
1 Х
1 Х 1
1 Э I
Й
I ф 1
1 Э 1 о
u <
1 I с 4
Ю
0 1
z и о I с4 с
CIz
<.Э
Ю с»
z !.Э (1 с и
I 1
l с s
1 1
1 I с и
I I
1
I !
I — 1.1:
<< 1 с» и
z 1
»»Ъ
r о а.
1 r с <э
1.1
cL s
1
1 I с
I!
s s
1 1
1
1 Q «1 аа ! н х Q, аэ
М «Ъ Р < а tf! D < ЕЧ М и Е
1 % <»4» < % < %.» Ф<
I I
I 1
11 1 1
1 <Х !» 1
<; и 1 оэо 1
114 Р «< I
< э I
Х 1 I
1 Э 1
Х 1 1
I Ц I
1 Э I IK 1 о I
1 («) 1 1
1 I
I I
< 1 1
1 1 I
1 1 !» I ! 1 1
<; о оэо
1 1 Х Р« tt< I
1 1 1
1 1 1
1 1 1
Г Т I
< 1 I 1 I 1 п< ttt <О ttt t
l l 1 ! 1 I
1 а
Ие
1 C
1 В
ЪН
I ffI
О «с
CtI <
ttf н ао нвн
Э,0 <
Е< а э,г» Ф э! нн ну э а5 ох ххее н KX эно
g 3C
1 I
1 и
Я « ое н
° с ttf х
<«Э ес х ха эно,в <о о
f» ляо
0- нн
859558
Формула изобретения Oefi, 1
„сн, й-CH-С
СОВ СН1
aic0NH
I0 О
ИЛИ
IIgOIIfI
\ оснр, l5 где R
Составитель В. Жестков
Техред С.Мигунова Корректор У. Пономаренко
Редактор В. Петраш
Заказ 8364/88 Тираж 446 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва,X-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
Способ получения производных азетидинона общих формул 1а или 1б
СЙ3
-c, О 30II С И
X3 20 означает феннл, феннлметил или феноксиметил; винил, этинил, галоидэтинил или остаток формулы-С-СИ, -2., где Y означает кислород, метилен и метоксикарбонилметнлен, à 1 - ацетокси или
1-метилтетраэол-5-ил-тиа; фенилметокси, дифенилметокси или третбутилокси, отличающийся тем, что, соединение общих формул 1!а или !1б
31 к
С
l ф
H О ф О
/ у ИЛи
М
О. С С, С ФСН . . СН3
3 I CH3
СО 3 СОВ 3
3 mls где Rq u R3 имеют вышеуказанные значения, подвергают взаимодействию со спиртом общей формулы fll
К СН ОН, где R имеет выаеуказанные значения, в присутствии трехфтористого бора нли трифторметансулъфокислоты при
0-40 С с последующей, если необхоо димо, изомериэацией соединения общей формулы а в соединение общей формулы 1б в среде метнленхлорида s присутствии триэтнламина в течение от
1 мнн до 5 ч.
Источники информации, принятые во внимание Ири экспертизе
1. Corbet t 6. Е. and Stoodgey R.J.
Studies геЬаted to penicl I l fus—
J. СЬеа. Soc. Perkin Tians,. 1974
Рагt I, 9 1, р. 185-188 (прототип).