Способ получения метилового эфира @ -l-аспартил-l- фенилаланина
Иллюстрации
Показать всеРеферат
Союз Советсммх
Соцмалмстмчвснмх
Респубпмн
ОП ИСАНИЕ
ИЗОБРЕТЕН ИЯ
К ПАТЕНТУ в1884564 (61) Дополнительный к патенту(22) Заявлено 26. 12. 77 (21) 2557552/23-04 (51) M. Кл. (23) Приоритет(32) 27. 12 . 76
С 07 С 103/52
Государственный иомитет ссср по делам изобретений и открытий (81) 754297 (33) CUA
Опубликовано 23.11.81.Бюллетень №43
Дата опубликования описания 23.11 ° 81 (53) УДК 547.964. .4.07(088.8) Иностранцы
Джеральд Ли Бахман, Билли Дэл Винярд (США) (72) Авторы изобретения
Иностранная фирма
"Монсанто Компани" (71) Заявитель (США) (54) СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА
Q-L-АСПАРТИЛ-L-ФЕНИЛАЛАНИНА
Изобретение относится к улучшенному способу получения метилового эфира
cL-L-аспартил-L-фенилаланина, который в пищевой промышленности используют в качестве подслащивающего средства.
Известен способ получения метилового эфира d.-L-аспартил-1-фенилала— нина путем этерификации с -L-аспартил-L- фенилаланина безводным метанолом в присутствии хлористого водорода. Дпя выделения и очистки продукт превращают в хлористоводородную соль, Выход продукта, полученного известным способом, составляет 2530/ в пересчете на сЬ -1-аспартил-1-фенилаланин 313.
Однако для осуществления способа требуется абсолютная среда, поскольку присутствие любого количества воды щ во время этерификации приводит к снижению ее выхода за счет деэтерификации. Кроме того, для выделения и очистки целевого продукта, необходима дополнительная стадия — перевод
-аспартил- L-фенилаланина в его хлористоводородную соль.
Цель изобретения — упрощение процесса и повышение выхода целевого продукта.
Поставленная цель достигается тем, что согласно способу получения метилового эфира Ы вЂ” L-аспартил- L-фенилаланина путем этерификации g-L-аспартил-L-фенилаланина системой, содержащей метанол-хлористый водород, с последующим выделением целевого продукта через хлористоводородную соль метилового эфира *- L-аспартил- L-фенилаланина, этерификацию eL -1-аспартил-L-фенилаланина осуществляют при молярном соотношении исходных компонентов d. - -аспартил- -фенилаланин:мета" нол:хлористый водород:вода 1: от 1,7 до 8,8: от 1,9 до 15 6: от 22,4 до
127,8, соответственно, в системе метанол:хлористый водород: вода,содержащей на 100 г системы метанол в количестве от 3,5 до 19,0 r (0,120,59 моль);хлористый водород от 19,3
564
3 884 до 43,Ч г (0,34-0,64 моль);воду от
57,7 до 77,0 г (3,2-4,3 моль) .
При осуществлении этерификации по предлагаемому способу выход метилового эфира d. -L-аспартил-L-фенилаланина повышается до 59
Для выделения и очистки целевой продукт превращают в хлористоводородную соль.
Пример 1. В колбу при охлаждении на водяной бане загружают 140 мл метанола, 420 мл 9 н.хлористоводородной кислоты, к полученному раствору добавляют 113,8 r (0,4 моль) Щ. -левовращающий аспартил-левовращаюшего фенилаланина (98,53-ной степени чистоты).
Вскоре начинается осаждение. Охлаждение убирают, смесь перемешивают в течение 30 мин, при этом температура повышается до 20 С. Полученную о массу снова охлаждают на ледяной бане, перемешивают 1,5 ч и помещают на ночь в холодильник. Затем реакционную массу перемешивают 1 ч на ледяной бане, выпавший осадок (130,5 г мокрого жмыха) отделяют фильтрованием.
Полученный осадок растворяют в
750 мл деионизированной воды при 40РС, РН поддерживают около 4,2 в течение
1,5 ч посредством 36,7 г 503-ной водной гидроокиси натрия. Полученную массу охлаждают до 5 С, выдерживают ее при этой температуре 4 ч. Образовавшийся осадок отделяют фильтрованием, промывают пятью порциями деионизированной воды по 30 мл (5ОС) и сушат. Полученный продукт (51,8 г) представляет собой d -АПМ, выход приблизительно 44 в пересчете на
*-левовращающий аспартил-левовращающий фенилаланин. Анализ-с применением тонкослойной хроматографии и хлористого натрия подтверждает чистоту cL -АПМ выше 95 .
Пример 2. В раствор, содержащий 34,2 мл (0,41 моль) 37 -ной соляной кислоты, 60 мл воды и 40 мл метанола при перемешивании добавляют
110 r (0,357 моль) N-формил-с/-левовращающий аспартил-левовращающего фенилаланина в течение 20 мин, при этом температуру повышают с 40 до
58 С. Полученную массу перемешивают
3 ч при 58-60 С для удаления путем гидролиза формильной группы.
К охлажденной до 25ОС реакционной массе в течение 10 мин добавляют
65,8 мл (0,79 моль) 373-ной хлористо5
1О
2О
25 зо
4О
4 водородной кислоты. Вскоре начинает выпадать осадок. Полученную массу перемешивают 45 ч при комнатной температуре и 1,5 ч при 5оС Твердый осадок отделяют центрифугированием, остаток на фильтре промывают 100 мл, деионизированной воды (5 С). Мокрый жмых (110,2 r) растворяют в 410 жд деионизированной воды (45 С), рМ доводят до 2,5 в течение 10 мин по.средством 80,1 г 4,83-ной водной гидроокиси натрия и 1 ч перемешивают при 40-ОС. Поддерживают, температу- ру 40-42 С в течение 3 ч,добавляют l51,9 г 4,83-ной водной гидроокиси натрия в течение 3 ч, рН при этом поднимается до 4,2.
Смесь перемешивают 1 ч при 0-5ОС, полученные пушистые кристаллы отделяют центрифугированием. Жмых .промывают 200 мл деионизированной воды (5 С) и сушат в течение ночи в вакуумной печи при 55-60 С. Получено ный продукт (58,3 г) представляет собой c(-АРМ, выход 55,53 в пересчете на N-формил-с{;левовращающий аспартил-левовращающий фенилаланин, (с /> . +16,2 /с=4, в 15 н.муравьиной кйслоте) . Анализ с применением тонкослойной хроматографии подтверждает степень чистоты с! -АРМ выше 984,.
Пример 3. По примеру 2, за исключением того, что в реакционную массу после удаления формильной группы и охлаждения до 25О С добавляют 32,5 мл 374-ной хлористоводородной кислоты и 33,3 мл воды, получают * -АРМ с 33 -ным выходом в пересчете на N-формил- g-левовращающий аспартил-левовращающий фенилаланин. (с / + 15,3 /c=4, в 15 н. муравьиной кислоте) .
Пример 4. Попримеру2, за исключением того, что время удаления формильной группы посредством гидролиза сокращают до 1 ч,получают eL -АРМ с é6,24-ным выходом в пересчете на
N-формил- d -левовращающий аспартиллевовращающий фенилаланин, (d. /
+ 15,5 /с=4, в 15 н.муравьиной кислоте).
П ример 5. По примеру 2, за исключением того, что вместо 34,2 мл применяют 38,7 мл 373-ной соляной кислоты, и сокращая объем введенной в раствор кислоты после гидролиза до
61,3 мл, получают о -АРМ с 53,23-ным выходом в пересчете на N-формил- с -левовращающий аспартил-левовращаю-! щий фенилаяанин, (, . /2< + в 15 н.муравьиной кислоте)
Пример 6. Попримеру2, за исключением того, что время выдержки для образования осадка увеличивают до четырех дней, получают d -АРИ с
59,23-ным выходом в пересчете нг
N-формил- а -левовращающий аспартил-левовращающий фенилаланин, (о />
+15,2 /с=4, в 15 н. муравьиной кислоте) °
Пример 7. По примеру 2, за исключением того, что время выдержТаблица 1
Пример, АР, моль 373-ная
Р НС1, мл
Иетанол, Н О, мл
0,018 23,75 2,5
23 75
0,018
11,87 1,25
14,5 10,0
11,87 9
0,090
25,50
884564 6
15,4 /ñ=4, . ки для образования осадка сокращают до одного дня, получают е . -APM с
36,3Ф-ным выходом в пересчете на
М-формил- с -левовращающий аспартиллевовращающий фенилаланин, (< /> +
+15 /с4, в 15 н. муравьиной кислоте).
Пример ы 8-10. В соответствии с матодикой примера 2 aL -APM йо" лучают, используя концентрации aL -L ® -аспартил-L-фенилаланина (АР) и реакционные среды, приведенные в табл.1.
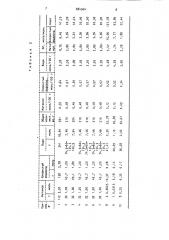
Соотношения компонентов реакционных смесей, описанных в примерах 1-10, приведены в табл. 2.
88ч564
OO - б
М СЧ О СЧ
OO
>»
>»
СЧ
СО л л!
Г л м
OO 00
C»(Сч о о
00 СО л
C4 C»(OO сч л
-з.
СЛ LA
LA (.С1 л
m м
СО О сч (h л
-:й м
LA Ш
LA LA м »" 1 л
М\ LA л о о
1 и и о о сч -Ф
LA М л о о
СЧ
Ш л
СО OO
-.з. л о о
OC OO
-а л о о
СЧ О> (» л
О О о
СО л м
СО
СО О л л О сЧ LA
Ю О
СЧ СЧ
Ю О сч сч О О
-а л л
О м
СЧ О О
СГ (» л
LA СЧ о л л а CV и и
О Мо М
+ л1
МММ CA
° % » л л
- -:т. л н и
o. м о
М1
01 СО О СЧ л о О сч м »
« - Ф л м мс см
° л ф г л
00 сч о (( л о о о о
C»(C»(о о
СЧ СЧ (» м м
- г —.й. л ( л м м ф л м л
OO М м с(1 ч .(LA
СЧ О
О л о м м LA
IN л о о
LA л м
О О
О О о о
O О о о о о сЧ СЧ м сч сч м м сч м З- св О
CQ
СС
О
I Ж
1 1-.Л
1 Л I >У < (; !
О»- П о О(1 > X QI а О>
О О
О (C х ((»
Г 3 1
1 л !»(> 1
1 О. I (- Ц1
> с(. Э О!
1 X: Xt
1 I
1 1! 1 1 I
1 t
I 1 O I
I ((> I O 1
С I »- (О > сс> л
1 I (»
1 I $ I
1 1 L
1 I ( (s > о
1 2 > О 1 (»» С(> ° о О» ! CL> Л > ао> С!
О О О < с» О<
1 М Ф»»
I 1 !
I 1
I Ю I
1 Ц o !
z< (1 (И 1 .Л I
I 1- 1 (» I
e1 O
1 X: >
I 1
I Э I " 1
I (>l J- L I
ego «
<(ООЕО> о уФ!
1 1
1 I
I . I I
I 1 Л I! 1 Ц !
I I X 1
1 1 I а Г 1
1 1
О 1
I СО I (1
1 I 1
I 1
1 I 1
1 !
1 > ---4
1 I I
1 !
1 1 Л>
I 1»!
Х > О!
1 л I Е(Ц . 1
ОО (.Л
zаt а О (О»t
>= О
Х Ф
t I
Р 11
1 (I! л 1
С С <
О > О >
1 Z 1 X 1
1 ((> I
> <- > !
1 Я \»
1 I
1 1 !
> !
> 1 l а а и>з=
> X I
LA Ю Ф
СЧ О1 C»( л о сч
СЧ СЧ
LA Ч. ) --(«(М СЧ
СЧ
О О
Л Со СО л
OO c»(СЧ
o LA Ch
СЧ LA OO
М ГГ\ М
О
МЭ LA М о о о
0 1 СС 01 с(1 -Ф -4 л о о о о -з.
m LA СЧ Сч
-> О -Ф
ОЪ - 1 0 со > л
0О о о л сч со л (М л- %OO Л л» м л м 0
- Ф (Ч
o o
01 О 0 01 л л о о о о
СЧ СЧ С4 СЧ О ъО О Ч:>
С"1 Г 1 Г \ М л л л м м м м
884564
Составитель В. Волкова
Техред Е.Харитончик Корректор Н. Стец
Редактор А. гришкина
Заказ 10271/89 Тираж 446 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Иосква, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент",г. Ужгород, ул. Проектная, 4 Формула изобретения
Способ получения метилового эфира .
d -L-аспартил-L-фенилаланина путем этерификации А -L-аспартил-L-.ôåíèëàëàнина системой, содержащей метанол-хлористый водород, с последующим выделением целевого продукта через хлористоводородную соль метилового эфира d.-L-аспартил-L-фенилаланина, о т л и ч а ю щ и "ся тем,,что, с целью упрощения процесса и повышения выхода целевого продукта, этерификацию
3-L-асйартил-L-фенилаланина осуществляют при молярном соотношении компонентов, oL -L-аспартил-L-фенилаланин: метанол:хлористый водород: вода 1: от
1,7 до 8,8: от 1,9 до l5,6: от 22,4 до 127,8, соответственно, в системе метанол:хлористый водород, вода, содержащей на 100 r системы метанол в количестве от 3,5 до 19,0 г (0,120,59 моль); хлористый водород от
19,3 до 23,4 r ((00,34-0,64 моль); воду
1в от 57,7 до 77 г.(3,2 — 4,3 моль).
Источники информации, принятые во внимание при экспертизе.
1. Патент США 3933781, кл. С 07 С 103/52, 20 ° 01-76