Способ получения полипептидов
Иллюстрации
Показать всеРеферат
ОП ИСАНИЕ
ИЗОБРЕТЕН ИЯ
Я llATEHTV
Союа Советских
Социалистических
Республик (») 884565 (61) Дополнительный к патенту (51) М. Кл.
С 07 С 103/52У
А 61 K 37/02 (22} Заявлено 15. 05. 78 (21) 2616245/23-04
16.05 ° 77;16 06.77 (23) Приоритет — (32) 21. 06, 77; 21. 06 ° 77
6061/77; 7402/77; 23.06.77;14.11.77 (31) 75,6/77; 7577/77; (33)
7513/77; 13862/77
Опубликовано 23.11.81Бюллетень № 43
Государственный комитет
СССР но делам нэаоретеннй н открмтнй (S3) Ь ДК 547. 964. .4.07(088,8) Дата опубликования описания 23.11.81
Иностранцы
Франсуа Кардино, Янош Плесс (Швейцария) (72) Авторы изобретения
Иностранная фирма
"Сандос АГ" (Швейцария) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ
- - н-cQ Ц(1
Изобретение относится к способу получения новых полипептидов - биологически-активных соединений, которые могут найти применение в медицине.
Известны способы получения пептидов путем отщемления защитных групп от соот вет ст аующи х з ащищенных по ами- ногруппе пептидов. Использование известного метода позволяет получить новые пептиды, обладающие интересными фармакодинамическими свойствами jl) .
Цель изобретения - получение новых биологически-активных полипептидов, расширение арсенала средств воздействия на живой организм. 15
Поставленная цель достигается способом получения полипептидов Формулы А-В-Clу-0- K, (g) где А - остаток Формулы
° Р р„
НО СН вЂ” С вЂ” СО—
ЯН7. где В»- водород;
1 водород или вместе с R
- СНл-СН -группа;
2 - водород, алкил (Ст ), алкенил (С ), ци кпопропилметил, циклобутилметил или R> COгде R g - остаток L-аминокислоты, L-аланин, L-глутамин, 1-метионин, L-тироэин, L-триптофил, L-gee aaha s, L-метилтриптофил или Ry- L-метионинсульфоксид, L-метионинсульфон, L-3,4-диоксиФенилаланин, причем свободные аминогруппы могут быть замещены алкилом (С1 <), причем, если В-0-аланин, R не может быть фенилаланином или тирозином, В - О-аланин, О-серин, D-метионин, О-метионинсульфоксид, 0-метионинсульфон, остаток aL"àèèíîмасляной кислоты (А1b);
D - -остаток формулы
884565
3 где Rq- водород, или метил;
Я вЂ” остаток формулы — N — CH — Сн 0Н
R) Rg где R>- водород
Яь- а) -СН СН(СН ) . б) -tH СН SCHg (n т 1,2)
Ч. (0) в) Я„вместе с х — — — СН
СН— Л (в=О или 1)
Ф
° (О) Ь при условии, что В - а) О-аланин, если Z (группа RICO - и/или Я„и R вместе - группа -СН -СН -, прйчем остаток А имеет 0-конфигурацию и/или
СН ОН, — 8 ОН ОН
26
Ь
4 0)Ь б) д-аминомасляная кислота, если
R g и Я вместе - группа - СН -СН и/или 6-СН2-СН -S-СНg (r - 1,2)
1 ф (о)г остатки А и 0 имеют конфигурацию или DL-ряда Я -конфигурацию L,D, или 0L-ряда, если Я „и Я вместе означают группу - СН -CHg-, А также ©
° может иметь 0-конфигурацию, заклю"чающимся в том,что защищенный полипептид с последовательностью аминокислот, отвечающих формуле I,ïoäâåðràþò деблокированию в безводной кислой среде.
Предпочтительным вариантом способа является использование в качестве кислой среды трифторуксусной кислоты в хлористом метилене.
В приводимых ниже примерах применены следующие сокращения:
АiЬ вЂ остат д -аминомасляной кислоты;
Вос - трет.бутилоксикарбонильная группа;
43
ДИФ " диметилформамид;
Dopa - остаток 3,4-диоксифенилалани на;
Leu-ОВ - лейцинольный остаток;
Ией(0)-OE - остаток метионинсульфоксида;
Net(0g),- остаток метионинсульфона;
Net-0 L - метионинольный остаток;
Ие (О) -ОВ - метионинолсульфоксид$5 ный остаток;
NePhp - остаток й-метилфенилаланина;. ф
MeTrp - остаток М- метилтриптофана;
MeTyr - остаток Й-метилтирозина;
0Np — 4-нитрофенокси-группа;
Pro-03 - пролинольный остаток;
ТФУ - трифторуксусная кислота;
ThZ-ОЮ-4--4 - оксиметилтиазолидинильный-3 остаток;
ThZ(O)-O9 - 4-оксиметилтиаэолидинилсульфоксильный-3 остаток.
Если нет дополнительных указаний, все остатки аминокислот, кроме остатка глицина, и все остатки аминоспиртов имеют L-.êîíôèãóðàöèþ. Аминоспирты принадлежат L-ряду в том случае, когда их СН ОН - группа занимает положение альфа - COOH - группы в соответствующей L-аминокислоте.
Пример 1. Н-Tyr-0-Met-GlyNePhe-Net-О1(трифторацетат).
7,5 г Boc-Tyr-D-Met-Gly-MePheMet-01 растворяют при комнатной температуре в 100 мл смеси трифторуксус-. ной кислоты и хлористого метилена, взятых в соотношении 1: 1. Через 5 мин раствор упаривают в вакууме и производят осаждение продукта диэтиловым
}эфиром. Получают указанное соединение, температура разложения которого - 90ОС, (* ) = -4,4 (с = 1,2 в уксусной кислоте, 953-ной).
Примененный в качестве исходного материала Вос-Tyr-0-Net-Glу-MePhe-Met-03 получают следующим сйособом. а) Вос-D-Met-Gly-ОН.
К 37 r Boc-D-Met-.ONp в 150 мл
1,2-диметоксиэтана прибавляют при комнатной температуре раствор 9 г глицина и 4,8 г гидроокиси натрия в 35 мл воды. Через 2 ч реакционную смесь разбавляют 300 мл воды и продукт несколько раз экстрагируют этиловым эфиром уксусной кислоты Водную фазу покрывают этиловым эфиром уксусной кислоты и подкисляют 4 н. раствором серной кислоты. Органическую фазу несколько раз.промывают разбавленным раствором кислого сернокислого калия и водой, после чего отгоняют растворитель в вакууме. Остаток кристаллизуют из смеси этилового эфира уксусной кислоты и петролейного эфира. Температура плавления .продукта
126 C-, (d ) о= + 12oC (с = 1,1 в диметилформамиде). б) Вос-Туr-D-Меt""Glу-OH.
К 4 г Вос-Tyr-Ойр, растворенным в
40 мг диметилформамида, добавляют при комнатной температуре раствор, содержащий в 40 мл диметилформамида
5 8845
3,8 г Н-0-Net-Gly-ОН (трифторацетат), который предварительно получают из
Вос-D-Met-Gly-ОН посредством обработки последнего смесью трифторуксусной кислоты и хлористого метилена, взятых в соотношении 1:1, и 3,3 мл триэтиламина. Через 2 ч раствор упаривают в вакууме, полученный остаток разбавляют 150 мл воды и производят обработку реакционной смеси так, как описано в пункте а. Указанное соединение кристаллизуют из смеси этилового спирта и петролейного эфира. Температура разложения продукта 195 С;(с - )> =
+11,6ц(c = 1,0 в диметилформамиде). с) Boc-HePhe-Het-ОВ.
Раствор 3,1 r Boc-MePhe-ОН в 30мл тетрагидрофурана охлаждают до -20 С при перемешисании добавляют к нему
1,45 мл N-этилморфолина, затем добав- 0 ляют 1,45 мл изобутилового эфира хлормуравьиной кислоты, после чего продолжают перемешивание реакционной смеси в течение 5 мин при -20 С. Затем
0 к реакционной смеси прибавляют охлажденный раствор I,80 г метионинола в
8 мл тетрагидрофурана и реакционную массу выдерживают в течение 2 ч при температуре от -5 до 0 С, после чего перемешивание продолжают в течение ЗО
2 ч при комнатной температуре.. Непосредственно после этого реакционную .массу разбавляют 350 мл этилового эфира уксусной кислоты, раствор несколько раз промывают водой,, 1 н. у лимонной кислоты, 103-ным раствором кислого углекислого калия, 303-ным раствором хлористого натрия. Затеи органическую фазу сушат сернокислым натрием, упаривают раствор, получают 4о
Вос-HePhe-Met-OE в виде аморфного продукта; (* ) = -54 (с = 1,24 в метиловом спирте). б) Н-MePhe-Met-OE (трифторацетат)..
Раствор 4,3 г Вос-HePhe-Met-OE в м
20 мл хлористого метилена, 5 мл СН -S-CH -СН и 0,2 мл HS-СН -СН -ОН смешивают при О С с 40мл 983-ный трифтор-. уксусной кислоты. Реакционную смесь выдерживают в течение 1,5 ч при ком- о натной температуре, затем упаривают в вакууме до 5-10 мл. Продукт дважды переосаждают из смеси диэтилового и петролейного эфиров. Иаслообразный продукт сушат в глубоком вакууме.Получают Н-MePhe-Met-OE (трифторацетат) в виде аморфного продукта; .(с . )1 О
+ 3,2. (с = 0,98 в метиловом спирте) . е) Вос-Туг-D-Me t-G l y-NePhe-Met-О В.
65 &
К 4,7 г Boc-Tyr" D-Met-Gly-OH, 2,7 r l-оксибензотриазола, 4,1 r
Н-МеРйе-Net-Оl (трифторацетат) и
1,1 мл N-метилморфолина в 40 мл диметилформамида прибавляют при 0 С, 2,3 г дициклогексилкарбоди;ч да.Реакционную смесь выдерживают в течение
1 ч при 0 С и в течение 15 ч при комнатной температуре, осадок отфильтровывают, фильтрат упаривают в вакууме, полученный остаток растворяют в этиловом эфире уксусной кислоты и раствор несколько раз промывают разбавленным раствором кислого углекислого калия, соляной кислотой и водой, после чего растворитель отгоняют в вакууме.
Полученный остаток чистят с помощью хроматографии на колонке, заполненной силикагелем, используя для элюирования смесь хлористого метилена и метилового спирта. Получают указанное соединение в виде аморфного продукта; (* ) = - 23,3 (с 1,2 в диметилформамиде), Пример 2. Н-Tyr-0-Мег{О)-Glу-MePhe-Het(О)-ОE (трифторацетвт).
7,9 г Boc-Tyr-0-Met(О)-GlуHePhe-Net(O)-0l растворяют при 22 С в 100 мл смеси трифторуксусной кислоты и хлористого метилена, взятых в соотношении 1:1. Через 5 мин раствор упаривают в вакууме и осаждают указанное соединение диэтиловым эфиром; (д ) > = -3,1 (с = 1 в 953-ной уксусной кислоте).
Примененный в качестве исходного материала Вос-Tyr-0-Met(О) -Glу-MePheИей(О)-01 получают следующим способом.
К раствору 7,5 г Вос-Tyr-D-HetGly-MePhe-Met-O1 в 75 мл уксусной кислоты при 22 С прибавляют 2,0 мл
11 M перекиси водорода. Через 5 мин реакционную смесь вводят при перемешивании в 1,5 л диэтилового эфира и отделяют выделившийся в осадок неочищенный продукт фильтрованием.
Неочищенный продукт чистят с помощью хроматографии на силикагеле, используя для элюирования смесь метилового спирта и хлористого метилена. Указанное в заголовке соединение получают в аморфной форме, причем продукт тотчас подвергают обработке трифторуксусной кислотой °
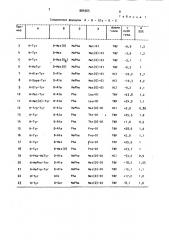
По аналогиии с приведенными примерами, при использовании соответствующих исходных соединений, получают пептиды, укаэанные в табл. 1 и 2.
884565
Т а б л и ц а 1
Соединение формулы А " 8 - Gly - 0 - Е
Пример форма с
-соли АсОН град.
954
0- Me t (0) MePhe
3 H"Tyr
4 Н-Tyr
Н-ту«
ТФУ -6,9 1,2
ТФУ -3,6 1,2
ТФУ -3 1 1
ТФУ -б 5 1
HePhe
0-Me t (Og) HePhe
О-Met(0) MePhe б Н"MeTyr
НС1 -22,2 2,7
7 Н-Ala-Tyr
B Н-Dopa-Tyr
9 Н-Gly-Туг
10 Н-Met-Tyr
0-Аl а
0-Аl а
0-А1а
0-Аl а
MePhe
MePhe
MePhe
Phe
11 Н-Met(0)-Tyr 0-Аlа
Phe
0-А1 а
O-Ala
0-Аl а
HePhe
Phe
Thr-Ol ° ТФУ +25,3 1,0
Phe
ТФУ +1,0 0,5
ТФУ +28,6 1,0
ТФУ +2 9 11
Phe
0- А l a
16
0-А) а
0-Met
MePhe
Phe
ТФУ +25,5
0-Ме t (О) Phe
MePhe
MePhe
MePhe
Н-Phe-МеТуг 0-А1а
Н-MePhe- Ty r 0-А l a
H-МеТгр-Tyr 0-Аl а
20
ТФУ 15, 1
ТФУ +17,2 1, 0
ТФУ -8,1 1,0
Phe
Ai b
Н-Tyr
23 H"Tyr
MePhe
0-Ser
Н-Trp-Tyr
Н-Tyr
Н-Туг
Н-Tyr
Н-Tyr
Н-Tyr
Н-Tyr
Met" 01
Met(0)-Ol
Het(0)-01
Met(0)-0l
Met(O)-0l
Met (0) -О l
Мей (О) -Ol
Leu-0l
Leu-Ol
Met(O)-01
Thr(0)-Ol
Pro-01
Pro-O1
Pro-01
Pro-01
Met(O)"0l
Меt(0)-Ol
Ме (О)"01
Met(O)-01
Met(0)-0i
НС1 -10, 3 2,2
НС1 -9,2 2,1
ТФУ +23,8 1, 2
ТФУ +24 9 1,1
НС1 +5,9 0,85
ТФУ +23,7
НС1 -53,5 0,9
ТФУ -18,2 1,05
884565
10. -1
iz
CO-D-Ala-Gly"MePhe-Met(0)-О1 (Р-форма) Э
Соединение формулы
ЧО г г фо " (+ Pa
1 соли Р
Пример, N а в
АсОН 95й
TII)Y -35, 7
НС1 -18,9
25 сн -с :
0,55
Формула изобретения
1. Способ получения полипептидов формулы 1
R 4- водород;
R — водород или вместе с Я,1-СН)1-СН g группа;
Z - водород, алкил (С g ), алкенил (С ), циклопропилметил, циклобутилметил или RgCO-, где Я - остаток б-аминокис35 лоты: L-аланин, L- глутамин, -метионин, L-тирозин, L-триптофил, -фенилаланин, L ìåтилтрифтопил или Яо,- L-метио40 нинсульфоксид, ).-метионинсульФон, L-3,4-диоксифенилаланин, причем свободные аминогруппы могут быть замещены алкилом (С„ ), причем В - О-аланин, R не может быть фенилалани45 ном или тирозином;
В - D-аланин, D-серин, О-метионин, D-метионинсульфоксид, 0-метио нинсульфон, остаток d -аминомасляной кислоты (AIЬ)
0 - остаток формулы-й-СН вЂ” CO
I д СИ I
55
A-В-Gly-D- a
t где А - остаток формулы
Rg
НО Сн — С вЂ” Co—
NHZ где R4 водород или метил," остаток формулы — 8 — СН вЂ” СЦ ОН l
1, где Яу- водород;
R - а) -СН <- СН
СН б) -CH
I (0) rI в) Rg вместе с R< -МСН5 (Ь Оили 1) (d)6 при условии, что В а) О-Ala, если
Z - группа R3CO- и/или R1 и Я вместе — группа - СНу)-СН, причем А имеет D-конфигурацию и/йли
Е.-.N СН ÎÍ,-N СН ОН(Ь=Оили1)
1Р)е
6) Aib если н и iI вместе - группа -CH -СН - и/или f -CH -СН <>"СН
Я. Хт 5 (OlI" (г 1,2); остатки А и О имеют конфигурацию L или ÎL-ряда; ): -конфигурацию L D или 01.-ряда, если Я и Rg вместе означают -СН -СН -групйу, А также может иметь О-конфигурацию, отличающийся тем,что, замещенный полипептид с пьследоваTeJllH0CTb)O BMNHOKHCJl0T отвечающих формуле I, подвергают деблокированию в безводной кислой среде.
2. Способ по и.1, о т л и ч а юшийся тем, что в качестве безводной кислой среды используют трифторуксусную кислоту в хлористом метилене, Приоритет по признакам;
16.05.77 при А - Я,), R - все указанные значения;
2 -R)CO, где Rg- L-аланин, L-глутамин, L-метионин, L-триптофил, L -фенилаланин;
В - О-метионин, О-метионинсульфоксид, О-метионинсульфон;
О - R -водород, метил;
6 - Ру-водород, R6-СН СН(СН, -CH CH SCHg, где и 1 или 2, (O)n
16.06 ° 77 при A - Р„и Р < — все указанные значения;
Z - Р СО, где Rg - 1-аланин, L- глутамин, L-метионин, L-триптофил, L-фенилаланин, L-метионинсульфоксид, L- ìåòиони нсул ьфон;
В - 0-аланин, 0 - -водород, метил;
Я - Р - водород, Р6-СН СН (СН $, -СН СН -СН, где и 1 или 2. (о)„
20.06.77 при А - Р„,R
В - О-метионин, О-метионинсульфоксид;
0 - R -метил
4.
L-метионин, L-метионинсульфоксид.
21.06.77 при А - R,R2 -все указанные значения;
2 - водород, алкил (С -С -), алкенил (С -Сj), циклопропилметил, циклобутилметил, или группа R>CO, где
Rg-остаток 1-аминокислоты: аланин, 12 глутамин, метионин, триптофил, фенилаланин, метионинсульфоксид, метионинсульфон;
В - 0-алании, О-метионин, О.-ме"
% тионинсульфоксид, О-метионинсульфон;
О - Р, водородб,, метил;
Р - и R6, вместе означают
-N — - Н-, - 1 - Н- (b=O или 1) 2г (0)б
21. 06. 77 при А - Р, R - все указанные значения;
Z - R C0, где R L-аминокислота:, аланин, глутамин, метионин, триптофил, фенилаланин, метионинсульфоксид,метионинсульфон или 3,4-диоксифенилаланин, свободные аминогруппы в остатке R y могут быть замещены алкилом (С, ) .
23.06.77 при A - -Р и Rg вместе
-СН -СН -, A имеет О- конфигурацию; все указанные значения;
В - О-алании, О-метионин, 0-метионинсульфоксид, 0-метионинсульфон;
О - все указанные значения;f, - -все указанные значения.
14.11.77 при А,О,Я. - все указанные значения;
В - О-серии.
Источники информации, принятые во внимание при экспертизе
1. Шредер Э., Любке К. Пептиды, M., "Мир", 1967 ч.1, с. 112.
Составитель В. Волкова
Техред А.Савка Корректор Г. Назарова
Редактор А. Шишкина
Филиал ППП "Патент", г. Ужгород, ул ° Проектная, 4
Заказ 10271/89 Тираж 446 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5