Способ потенциометрического контроля концентрации карбонатных ионов
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистических
Республик
ОПИСАНИЕ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (б1) Дополнительное к авт. свид-ву (22) Заявлено 14. 12. 79 (21) 2853231/22-03 tS1) М. КП.З с присоединением заявки Мо (23) Приоритет
В 03 0 1/00
Государственный комитет
СССР но делам изобретений и открытий
{$3) УДК 622.765.
-.06(088.8) Опубликовано 23.0182. Бюллетень Мо 3
Дата опубликования описания 23. 01. 02
"" -" Ф ;::
В.A. Арсентьев, Б.М. Борисов, Ю.В. Иев ев .ъГ. H. Машевский и Л. Д. Посыпкин 7:- "-., ltd p
Д„:,, Всесоюзный ордена Трудового Красного Знаме "- 4 научно-исследовательский и проектный институт механической обработки полезных ископаемых "Механобр" (72) Авторы изобретения (71) Заявитель (54) СПОСОБ ПОТЕНЦИОМЕТРИЧЕСКОГО КОНТРОЛЯ
КОНЦЕНТРАЦИИ KAPBOHATHbJX ИОНОВ
Изобретение относится к обогащению полезных ископаемых, в частности к контролю концентрации карбонатных ионов в жидкой фазе рудных пульп, и может быть использовано для автоматической дозировки соды.
Известен способ определения концентрации карбонатных ионов, включающий, кондуктометрическое определение концентрации углекислого натрия
Ма С 0 (1)
Недостатком данного способа является низКая его чувствительность.
Способ пригоден при концентрации углекислого натрия в пределах 70120 г/л и используется для контроля качества растворов реагентов. В реальных пульпах концентрация значительно меньше.
О концентрации ионов СО обычно судят по величине щелочности растворов, которую определяют химическим, калориметрическим или потенциометрическим методами.
Известен способ потенциометрического контроля. концентрации карбонатных ионов во флотационной пульпе, включающий измерение рН среды (23.
Способ нашел применение при контроле концентрации соды
Недостатком способа является недостаточная точность определения обусловленная химическими свойствами раствора соды, имеющего предельное значение рН на уровне 10,3-10,5.Поэтому для процессов протекающих при рН больше 10 концентрация водородных ионов (рН) слабо отражает изменения концентрации карбонатных ионов.
Цель изобретения — повышение точности определения концентрации карбонатных ионов.
Поставленная цель достигается тем, что одновременно с измерением рН пульпы измеряют величину электрохимического потенциала минеральным электродом по отношению к водородному электроду сравнения пульпы, а концентрацию карбонатных ионов определяют по формуле г g-1 E o - (Ем + 0 ° 29 рН) 9 " З) 0,015 где (CO > 1 — концентрация карбонат25 ных ионов, г-ион/л;
E,z — электрохимический потенциал минерального электрода, измеренный по отношению к водородному электроду сравнения, В;
899141 где СО -)
25 мин стандартный электродный потенциал реакции
2Ме S+20H +C0>=MeCO>+Me (ОН)1+25+4е. В
Б поверхностной реакции минерального электрода, например пирротинового, наряду с гидроксильным ионом участвует карбонатный ион
2Ме S+20H +CO> МеСО +Ме (OH)+2S+4e, В что обеспечивает дополнительный сдвиг потенциала минерального электрода (15 мВ на порядок изменения концентрации C0 ) E „„,„ = Е„- 0,15 )g (СО j0,029 рЙ.
Таким образом, совместное определение E „ и рН среды дает возможность повысить точность определения карбонатных ионов.
Пример. Была определена концентрация карбонатных ионов в содовых растворах с рН 9,10 и 11, Измерение рН проводилось стандартным методом, одновременно определялся электродный потенциал пирротинового электрода.по отношению к водородиому электроду. Концентрация ионов (Сб ) определялась по предлагаемой формуле.
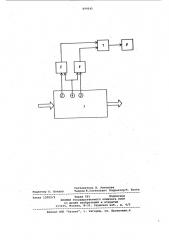
На чертеже приведена схема устройства для реализации способа, Устройство включает объект контроля 1, датчик 2 концентрации водородных ионов (стеклянный электрод), минеральный электрод (пирротиновый) 3, электрод 4 сравнения (водородный), измерители 5 и 6, сумматор 7 и регистратор 8, проградуированный в единицах концентрации ионов.
Определенная концентрация ионоВ (CO< J в растворах с различными зна3 чеииями рН от 9 до 11 соответствовала расчетным значениям.
Преимуществом предлагаемого способа является также то, что он позволяет производить непрерывное .определение концентрации карбонатных ионов и может быть с успехогл использован для автоматического контроля и дозировки расхода соды.
Формула изобретения
Способ потенциометрического контроля концентрации карбонатных ионов во флотационной пульпе, включающий измерение pH G T JI H ч B Io g H йс я тем, что, с целью повышения точности оиределения конМнтрации карбонатиых ионов, одновременно с измерением рН йульпы измеряют величину электрохимического потенциала 5 минеральным электродом по отношению к водородному электроду сравнения, а концентрацию карбонатных ионов определяют по формуле:
2© l9(C0g-f - Ее - (Емин+ 0,29 pH)
3 0,015
- концентрация карбанатных ионов, г-ион/л;
- электрохимический потенциал минерального электрода, измеренный по отношению к водородному электроду сравнения, В;
- стандартный электродный потенциал реакции
2Ие5+2ОН +CO> МеСОЪ+Ме (ОН), +2В+4е, В
33 ИстОчники информации принятые во внимание при экспертизе
1. Зубков Г.A и др. Автоматизация процессов обогащения руд цветных металлов, И., "Недра", 1967,,щ с. 308.
2. Зубков Г.А. и др. Автоматизация процессов обогащения руд цвет.ных металлов. И., "Недра",1967, с. 211 (прототип).
899141
Составитель Л. Антонова
Техред X.Êàñòåëåâè÷ Корректор М. Коста
Редактор A. Шандор
Заказ 12002/9
Тираж 593 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", г. Ужгород, Ул. Проектная,4