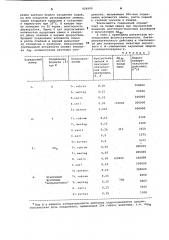
Акриловый или @ -замещенные акриловые эфиры 4- оксиметилкарена-2, обладающие фунгистатической, бактериостатической и гербицидной активностью
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Союз Советских
Социалистическик
Республик
<1>926900 (61) Дополнительное к авт. свид-ву— (22) Заявлено 090780 (21) 2954066/23-04
f$gj+ Кд 3 с присоединением заявки ¹â€”
С 07 С 69/54
AN 37/06
A 61 К 31/22
Государственный комитет
СССР по делам изобретений и открытий (23) Приоритет— (53) УДК 547. 39 26(088.8) Опубликовано 30.1032. .Бюллетень № 40
Дата опубликования описания 30.1082 — —.
Э.Х.Казакова, A.A.Ìóñëèíêèí, Л.Н.Суркова", M.A.Кудркмд, Ж.В.Молодых, И.С.Ираидова и Н.Н.Анисимова
4 -
"I 1 р:
-«Ь,:
Ордена Трудового Красного Знамени инст тут 4ргани еской химии, физической химии им. A.Е.Арбузова Миасского» "- .
Рр. филиала AH СССР (72) Авторы изобретения (71) Заявитель 5 4 ) AKPH JIOBbIA ИЛИ е -ЗАМЕЩЕННЫЕ АКРИЛОВЫЕ ЭФИРЫ
4-ОКСИМЕТИЛКАРЕНА-2, ОБЛАДАЮЩИЕ ФУНГИСТАТИЧЕСКОИ, ЬАКТЕРИОСТАТИЧЕСКОЙ И ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ
g С- С-СК, (И 1
KhC CRR ъде к-и,ск У
Изобретение относится к новым биологически активным химическим соединениям, а именно к акриловому или ос -замещенным акриловым эфирам 4-оксиметилкарена-2 общей формулы
Указанные соединения обладают фунгистатической, бактериостатической и гербицидной активностью и могут быть использованы в медицине и сельском хозяйстве.
Известны соединения, близкие по строению, -циклогексен-3-иловые эфиры акриловой и метакриловой кислот:
° ° °
0Е- СК=СК в Ъ де R-К или СК, (T).
Однако для этих соединений.отсутствуют данные об их биологической активности.
Целью изобретения является созда лие новых соединений, позволяющих расыирить арсенал соединений, обладающих фунгистатической, бактериостатической и гербицидной активностью.
Гоставленная цель достигается созданием соединений формулы(1).
Способ получения соединений формулы (1 ) основан на известйой реакции получения эфиров карбоновых кислот взаимодействием хлорангидрида кислоты и спирта Г2) °
Акриловый и метакриловый эфиры получают взаимодействием хлорангидридов акриловых и метакриловых кислот с 4-оксиметилкареном-2 в присутствии акцептора хлористого водорода, например триэтиламина. В случае с -F-акрилового эфира взаимодействием в аналогичных условиях хлорангидрида oL-Г- p -CI-пропионовой кислоты с 4-оксиметилкареном-2 полу ают сС -F- p --Cl-пропиониловый эфир
4-оксиметилкарена-2, а затем его нагреванием в присутствии дополнительного количества основания получают предлагаемый ol-F-акриловый эфир
4-оксиметилкарена-2.
Акриловый и с -замещенные акриловые эфиры 4-оксиметилкарена-2 представляют собой бесцветные и прозрачные жидкости, смешивающиеся с боль926900 шинством органических растворителей.
При храпении в условиях комнатной температуры они самопроизвольно полимеризуются, вследствие чего необходимо добавить в них соответствующие ингибиторы. 5
Пример 1. Получение акрилового эфира 4-оксиметилкарена-2.
К раствору 12,5 г (0,07 моль) 4-оксиметилкарена-2 и 12,5 r (0,12 моль) триэтиламина в 50 мл сухого диэти-. 10 лового эфира в присутствии 0,1. г ингибитора полимеризации — гидрохинона при температуре 0+5 C и перемешиван«и прибавляют по каплям раствор,i,.> -: г (0,11 моль) хлорангидрида,>:криловой кислоты в 50 мл сухого диэтилового эфира. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Осадок солянокислого основания отфильтровывают и промывают эфиром. Остаток после удаления растворителя из фильтрата подвергают фракционной перегонке в вакууме. Получают 9,5 г (57,43) вещества с т.кип. 95ОC (1,5 мм рт.ст. $
n2о 1, 4875 cl4 О, 9838.
По данным элементного анализа, ИК- и ПМР-спектров вещество представляет собой акриловый эфир 4-оксиметилкарена-2.
Найдено, Ъ: С 76,70; H 9,30. 30
С„,."!2оО 2
Вычислено, В: С,76,36, Н 9,09.
Пример 2. Получение метакрилового эфира 4-оксиметилкарена-2.
К раствору 25 r (0,15 моль) 4-ок- 35 симетилкарена-2 и 25 r (0,24 моль) триэтиламина в 20 мл пентана в присутствии 0,1 г ингибитора полимеризации — гидрохинона при температуре от 0 до+5 С и перемешивании 40 приоавляют по каплям раствор 25 г (0,23 моль) хлорангидрида метакриловой кислоты в 150 мл пентана. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре.-
Осадок солянокислого основания отфильтровывается и промывается пентаном. Остаток после удаления раство рителя из фильтрата подвергается перегонке в вакууме. Получают 24,5 r (69,66%) вещества с т.кип. 65-67оС (0,005 мм рт.ст); п2 1,4830.;
d2a 0,9709.
По.данным элементного анализа, ИК- и ПМР-спектров вещество представляет собой метакриловый эфир 4-оксиметилкарена-2.
Найдено, Ъ: С 76,45, Н 9,52.
С 5"2Р2
Вычис,!ено о С 76 92; Н 9 40.
П р и < е р 3. Получение с/.-фторакрилового эфира 4-оксиметилкарена-2.
К раствору 12 r (0,072 моль)
4-оксиметилкарена-2 и 9,36 г (0,093 моль) триэтиламина в 70 мл пентана при температуре от 0 до +5 С 65 и перемешивании прибавляют по каплям раствор 13,5 г (0,093 моль) хлор- ангидрида.
oL -фтор- р -хлорпропионовой кислоты в 50 мл пентана. Осадок солянокислого основания отфильтровывают и промывают пентаном. Остаток после удаления растворителя из фильтрата подвергают перегонке в вакууме. Получают 10,85 г (54,8Ъ) вещества с т.кип. 112 С (1,5 мм рт.ст), п2о 1,4840; д+ 1,1537
По данным элементного анализа, ИК- и ПМР-спектров вещество представляет собой сС-фтор- Р -хлорпропиониловый эфир 4-оксиметилкарена-2
Найдено, Ъ: С 61,43; Н 7,56.
С 4Н2оО 2Е С Р
Вычислено,Ъ: С 61,20, Н 7,28.
Раствор 8,8 г (0,.032 моль) полученного oL -фтор- р -хлорпропионилового эфира 4-оксиметилкарена-2,6 r !
0,06 моль) триэтиламина и 0,1 r гидрохинона в 50 мл бензола нагревают в течение 12 ч при температуре кипения смеси. Осадок солянокислого основания отфильтровывают и промывают на фильтре бензолом. Остаток после удаления растворителя перегоняют. Получают 7,5 г (98,5Ъ) вещества с т.кип. 75ОС (1,5 мм рт.ст); п 1,4780, d4 1,0513. По данным элементного анализа, ИК- и ПМР-спектров вещество представляет собой
cL-фторакриловый эфир 4-оксиметилкарена-2.
Найдено, Ъ: С 70,76, Н 8,21.
С14Н19О2
Вычислено, Ъ: С 70,88; Н 8,01.
Фунгистатическую активность акрилового и о(.-замещенных акриловых эфиров 4-оксиметилкарена-2 изучают по отношению к грибам-возбудителям дерматомикозов: Trichophyton rubrum, Trichophyton mentagraphytes u Nicrosporum can, s. Культуры грибов засевают на твердую среды Сабуро, содержащую возрастающие дозы соединения. Критерием фунгистатической активности считают минимальную концентрацию соединения, задерживающую рост грибов в течение .30 дней при пышном росте в контроле.
Бактериостагическое действие предлагаемых соединений определяют по общепринятой в микробиологической практике методике разведений. Бактериальная нагрузка в опыте составляла
300000 микробных тел в 1 мл.
Гербицидную активность описываемых соединений изучают на семенах гречихи и ячменя в лабораторных условиях.
Эамещенные акриловые эфиры 4-оксиметилкарена-2 растворяют в ацетоне и наносят на фильтровальную бумагу, помещенную в чашки Петри. После испа926900.динения, вызывающая 50%-ное подавление всхожести семян, роста корней и стеблей гречихи и ячменя.
Токсичность соединений определяют на белых мяшах при пероральном введении ацетоново-масляных растворов с .вычислением ЛД .
B табл.1 приведены результаты исследования фунгистатического, бактериостатического действия и токсичности для теплокровных животных акрило вого и сА -замещенных акриловых зфиров4-оксиметилкарена-2.
Таблица 1 Ш 50 мг/кгбелые мыши
Индекс избирательности действия, В "/A
Соединение . формулы (Т) где й
Фунгистати ческая и бактериостатичес-. кая концентрация, Ъ, A
Микроорганизмы
Порядковый номер
0,10
Tr.rubrum
0;15
Tr. mentag
0,10
М.canis 10000
0 05
0,025
Е. col i
St. aureus
2100
0,15
Tr. rubrum
2100
0 15
0,10
Т г. men.tag
315
3150
П.canis
E.coli
1575
0,2
1575 е
200000
0,2
S t. aureus
0 05
Tr rubrum
Тr. mentag
100000
М. can1s
Е.coli
St.au reus, 4660
Эталонный фунгицид
"хлорацетофос"
0,15
Tr. rubrum
Тг, mentag
М. canis
700
4660
0,15 4660
0,15
0,15
1400
St. aureus
Под В в индексе избирательности действия подразумевается среднетоксическая доза соединения, вызывающая 50Ъ гибель животных, т.е. ЛД50 рения ацетона бумагу увлажняют водой, на ней аккуратно раскладывают семена, чашки закрывают крышками и оставляют в термостате при 25 С. В каждую чашку помещают по. 25 зерен, повторность двухкратная. Через б сут подсчитывают количество проросших семян и измеряют длину стеблей и корней проростков.
Процент подавления всхожести семян и роста стеблей и корней вычисляют по отношению к контролю. Показателем гербицидной активности служит величина >go- концентрация раствора сое0,05
0,05 >10000
0,10
0,10
400000
926900
В табл.2 приведены результаты исследования гербицидной активности, акрилового и о -замещенных акрило-. вых эфиров 4-оксиметилкарвна-2.
Т а б л и ц а 2
50 г
Порядковый номер"
Гречиха
Ячмень
1 всхо- рост рост жесть стебля корня семян рост стебля рост корня всхсжесть семян
0,1
0,1
0 05
0,5 0,05
0,25 0,1
1 . 1
0,05
0 05
0,05
0,5
Номер соединений соответствует таблице 1. н<-о-с-с=ск и
0 3.
БНИИПИ Эаказ 8843/31 Тираж 445 Подписное
Филиал ППП "Патент", r.Óæãoðoä, ул.Проектная,4
Концентрация соединения, вызывающая 50%-ное ингибирование развития растений. В качестве эталона при исследова- 25 эффект на всхожесть семян, рост нии гербицидной активности для срав- стеблей и корней гречихи и ячменя. нения берут известный гербицид 1-ок- Предлагаемые соединения обладают си-2,2,2-трихлорэтиламид 3-хлорпро- фунгистатическим, бактериостатическим пионовой кислоты и гербицидным действием при малой
О. 30 токсичности по отношению к тепло 1СН,,С, кровным животным. Вследствие этого
>> Н-СС1 они могут найти применение в медици-! 3 не и сельском хозяЦстве. Кроме того, 0N кото и исходные продукты для получения в концентРации с Q,025-0,05 уничто 35 заЯвлЯемых соединений ЯвлЯютсЯ досжает сорняки в посевах редиса. тупным сырьем, получаемым в промышКак видно из табл.1, описываемые леином масштабе. соединения обладают фунгистатической Формула изобретения активностью и задерживают рост грибов дер атофитов в концентрации Q,Q5- 4О АкРиловый или -замещ
0,15Ъ, и бактериостатической активриловые эфиры 4-оксиметилкарена-2 ностью и задерживают рост бактерий .общей формулы в концентрации 0,025-0,2Ъ. сн., Индекс избирательности акрилового и d. — çàìåùåííûõ акриловых эфиров 4- ок-4
5 г симетилкарена-2 на примере соединений из табл.1 (1 и 3) составляет по отношению к патогенным грибам И тх ъде З,-К, К,Г более 66660, а к бактериям — более
И
100000. В последнем случае индекс где R-Н, СН F, избирательности превосходит анало-,обладающие фунгистатической, бактериогичный показатель известного фунги- статической и гербицидной активносцидного препарата хлорацетофоса, на- тью . шедшего применение в медицине. Источники информации, Как показывают данные табл.2, принятые во внимание при экспертизе описываемые соединения обладают гер- 1. Авторское свидетельство СССР
55 бицидным действием по отношению как iV 191538, кл. С 07 С 67/17, 1961. к одно-, так и двудольным растениям. 2. Вюлер К., Лирсон Д., ОрганичесСоединения в 0,05-1Ъ-ной концентра- кие синтезы. ч.ll . М., "Иир", 1973, циях оказывают 50Ъ-ный ингибирующий с.288-290.