Способ получения s-алкиловых эфиров фенил- @ - оксиалкилтиофосфиновых кислот
Иллюстрации
Показать всеРеферат
Союз Советския
Социалистических
Республик
O Il N C A H M K Ä,„.öäö()
ИЗОБРЕТЕНИЯ
И АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (6! ) Дополнительное к авт. свид-ву (22) Заявлено 16.07.80 (21) 2956943/23 — 04 с присоединением заявки № (23) Приоритет (51)M. Кл.
С 07 F 9/32
9вударетаиевй кеаиет ььЯР аю авлэм нзабрвтавВ и открмтвй
Опубликовано 07.07.82. Бюллетень № 25 Дата опубликования описания 07.07.82 (53) УДК 547.341. .26 118.07
Н. А. Карданов, Н. П. Провоторова, Н. Н. Годовиков и М. И. Кабачннк (72) Авторы изобретения
Ордена Ленина институт элементоорганических соединений АН: СССР (71) Заявитель (54) СПОСОБ ПОЛУЧВНИЯ S-АЛКИЛОВЬИ ЭФИРОВ
ФЕН ИЛ-O -ОКСИАЛКИЛТИОФОСФИНОВЫХ КИСЛОТ
Изобретение относится к новому способу получения новых соединений — S-алкиловых эфиров фенил-а -оксиалкилтнофосфиновых кислот общей формулы Г ф .,(о„ где и — водород, метил;
R — алкин С -Сз, фенил, трихлорметип;
R и R — вместе — (СН2)„при п=4,5; — алкил Са — Сз
2 которые могут найти применение в качестве биологически активных веществ.
I5
Известен способ получения эфиров алкил-аокситиофосфиновых кислот, образующихся по карбонильной группе альдегидов или кетонов, исходя из неполных эфиров алкилтиофосфинистых кислот, при 50 — 60 С (1).
Однако этим способом нельзя получить
8-алкиловые эфиры тиофосфиновой кислоты, так как тиофосфонистые кислоты с трехкоординационным фосфором, присоединение кото2 рых к карбонильным соединениям могло бы привести к образованию целевых продуктов, неизвестны.
Известно также, что диалкилтиофосфористые кислоты взаимодействуют с хлоралем (2), Однако в этом случае нельзя выделить а — оксиалкильные производные, так как образуются только продукты перегруппировки и дегндрохлорирования, Известен способ взаимодействия хлорангидрида S-алкилфосфоннстой кислоты с карбонильными соединениями при 0 10 С, приводящий к образованию S-алкиловым эфирам ахлоралкилфосфиновых кислот (3) .
Известно взаимодействие хлорангидрида
S-ацетилфосфонистой кислоты с альдегидамн или кетонами в присутствии воды.
Но в этом случае продуктами реакции являются а-меркаптофосфиновые. кислоты (4).
Таким образом, ни одним из известных способов соединения общей формулы получены не были.
Целью изобретения является разработка способа получения соединений общей формулы, мическому сдвигу фосфора в S-алкилдиалкилмонотиофосфинатах (5) . г
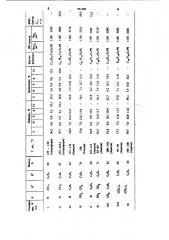
Физико-химические константы и выход ряда соединений представлены в таблице.
Пример 1.Краствору2,04г (0,01 моль) хлорангидрида S-этилфенилтиофосфонистой кислоты в 20 мл абсолютного эфира при перемешивании и охлаждении до
10-15 C из капельной воронки прибавляют по каплям раствор 0,18 г (0,01 моль} ацетона. После прекращения выделения хлористого водорода реакцию заканчивают. Образованийся белый осадок отфильтровывавт, промывают небольшим количеством холодного абсолвтного гексана и перекристаллизовъпивт иэ ацетона .
Получают 1,81 г (74%) $-этилового эфира февил- сг - оксиизопропилтнофосфииовой кисло ты (IV).
Найдено,%: С 536;
Н71; Р126;
С ф Н 7 PS
Вычислено %: С 54,1; Н 7,1; Р 12,7; S 13,1.
Пример 2. K раствору 2,18 г (0,01 моль) хлорангидрида 8-цропилфенилтиофосфонистой кислоты в 20 мл абсолютного эфира при неремеяивании и охлаждении до
10 — 15 C прибавляют но каплям 0,18 r (0,01 моль} воды и 1,0 r бекзальдегида в
Зо 2 мл тетрагидрофурана. После окончания вы3 941380 4 позволяющих использовать их в органическом синтезе,.а также исследовать на биологическую активность.
Поставленная цель достигается тем, что согласно новому способу получения новых
S-алкиловых эфиров фенил-а-оксиалкилтиофосфиновых кислот общей формулы
Д .О
Я 4Г «383
10 я" он где R — водород, метил;
R — алкил Ст — Сз, фенил„трихлорметил;
R и R — вместе -(СН } при @=45;
И Ф > 1
Я . — алкил Сз — Сз хлорангидрид $ — алкилового эфира фенилтиофосфонистой кислоты подвергают взаимодействию с альдегидом или кетоном и водой цри
10 — 15 С в среде органического растворителя, В качестве последнего целесообразно испольха зовать диэтиловый эфир и/или тетрагидрофуран.
Процесс ведут преимущественно при мальцом соотношении исходного хлорангидрида, карбонильного соединения и воды равном 1:1:1.
Реакцию можно представить схемой
1=0+ 1 + Ho. á1
Н1Г «$g 2 Й вЂ” д. ;,, + йй, / О
Н1 «ОИ где R, R, R имеют укаэанные значения.
В случае использования альдегидов, обра. зующих с водой устойчивые гидратные формы типа, например, хлоральгидрат, последние можно непосредственно вводить в реакицю без добавления воды.
Выбор растворителя определяется его способностью растворять исходные продукты и не растворять конечные.
Соединения формулы 1 нредставляют собой белые кристаллические вещества, устойчивые на воздухе, мало растворимые в эфире, гексане, хлороформе, ацетоне, плавящиеся в ии. тервале 84 134 С. Их строение подтверждается данными элементного анализа, ИК- и
ЯМР-спектроскопии, В ИК-спектрах, снятых на приборе ИК вЂ” 20, в таблетках с КВч соединений общей формулы имеются характерные полосы валентных колебаний связи 0H s области 3080 — 3210 см и связи Р— О в области 1120 — 1180 см 1. В спектрах ЯМР 3 Р соединений общей формулы (в бензоле) содержатся синглетные сигналы в области (fp -60 м.д., что соответствует хи35
Найдено, %: С 62,9; Н 6,2; Р 9,9; S 10,5.
С ЬН у ОзР$
Вычислено%: С 62,8; Н 6,2; Р 10,1;8 104.
Пример 3. K раствору 2,18 г (О 01 моль) хлорангидрида 8 — нронилфеиилтиофосфонистой кислоти в 20 мл абсолвгтного эфира прн перемешивании и охлаждении до
10-15 С прибавляют по каплям раствор 1,5 r (0,01 M) хпоральгидрата в 10 мл абсолютного эфира. После прекращения выделедия хлористого водорода реакцию щ1екращают и отфильтровывают кристаллический осадок, промывают абсолютным гексаном и перекристал5П лизовывают из хлороформа..
Получают 3,02 r (87%) $-пропилового эфира фенип (p; p, p - трихлор- а-оксиэтил) тиофосфиновой кислоты(И).
Найдено, %: С 37,7; Н 4,2; P 8,7;
55 $9,1; С1 31,1
С»Н аС1зОяР$
Вычислено, %: С 38,0; Н 4,1; Р 8,9;
$9,2; С1 30,8. деления хлористого водорода реакцию прекращают, отфильтровывают образовавшийся кристаллический продукт,промывают холодным абсолютным гексаном и перекристаллизовывают из ацетона.
Получают 1,83 r (60%) 8- пропилового эфира фенил(фенилоксиметил) тиофосфииовой кислоты (Ю. м ззо о
D о ю
Д 1
D сч
< 1
8 ю те CV
<ч <) ь
Ю °
«ч
D
СЧ
D„
СЧ
Ch
° °
00
CV
rv
Ф 3
Ch ю
СЧ" О ю °
° °
Ф Ъ
° «Ф
IA
О
О
О
СЧ
<»4
Ю м
00!
1 1 Р. ф ф 0 — 1 (I ! I
) Г
1 1
1 — 1 д1
)G
1в1и
1 — 1
46
Ы н ж
4) 9)
v
М ж т
C/l
CL ж () 941380
Составитель М, Казанкова
Техред Т. Фанта
Корректор-В. Бутяга
Редактор М. Недолуженко
Тираж 388
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Заказ 4758/7
Подписное
Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
Формула изобретения
1. Способ получения S -апкиловых эфиров фенил- n - оксиалкилтиофосфиновых кислот общей формулы
/ pi0
RwgÃ,, р2
31 »
ОН где R — водород, метил;
Н вЂ” анкил С, — Сз, фенил, трихлорметил;
Я и Й вЂ” вместе — (СНг)„при n=4,5;
R — алкнл Сг — Сг, г отличающийся тем, что хлорангидрид S-алкилового эфира феннлтиофосфоннстой кислоты подвергают взаимодействию с соответствующим альдегидом или кетоном и водой при 10 — 15 С в среде-органического растворителя.
2. Способ по п. 1, о т л и ч а ю щ и йс я тем, что в качестве органического раство. рителя в процессе используют диэтиловый эфир и/или тетрагидрофуран.
S Источники информации, принятые во внимание нри экспертизе
1. Абрамов В. С. н др, О взаимодействии фосфинистых кислот с альдегидами и кетонами. ХХХ1Х. Зфнры анкил-а -окситиофосфино10 вых кислот. ЖОХ, 39, 1543-44, 1969.
2. Pelchowicz Z. Изучение органических соединений фосфора, Ч. 1И, Диалкилфосфортионты и их реакции с хлоралем.— 1. Chem. Sos., 1961, 241-242.
1а 3. Патент CIQA И 3346669, кл. 260 — 960, опублик. 1967.
4. Авторское свидетельство СССР У 598908, кл. С 07 F 9/30, 1978.
5. Mark Ч. и др. Topics in Phosphous
Chemistry, v. 5, и — У, London, Interseinse, 1967, 4.