Способ получения производных 7-оксо-4-тиа-1-азабицикло(3,2, 0) гептана и его варианты
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистических
Республик
ОП ИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (»>942598 (61) Дополнительный к патенту (22) Заявлено 23. 11. 79 (21} 2847112/23-04 (51 } M КлС 07 0 499/00
//А 61 K 31/43 (23) Приоритет - (32) 24. 11. 78
Гесударетееккый кеиитет (3I) 45966/78 (ВВ} Великобритания . ОпУбликовано 07.07. 82. Бюллетень J%
Дата опубликования описания 07.07. 82.
CCCP
110 левак кзебретеккй и атерыткй (») УДК547.789. ,.61.07(088.8) Иностранцы
Иауризио Фольо, Джованни Франчески, и Федерико Аркамоне (Италия) (72) Авторы изобретения
Иностранная фирма
"Фармиталиа Карло Зрба С.п À." (Италия) (71 ) 3 а я вител ь
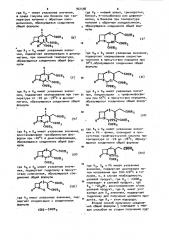
В (54) СПОСОБе ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 7-ОКСО-4-ТИА-l-АЗАБИЦИКЛО(3,2,0)ГЕПТАНА (ЕГО ВАРИАНТЫ) С" Н СООК, сн, N д -СООВ .
Изобретение относится к способу
-получения новых соединений пенициллинового ряда " производных 7-оксо-4- т иа-1-азаби ци кпо(3, 2, О) гепт ана общей формулы где R - атом водорода, алкил с 1-5 атомами углерода, трихлорэтил, бензил, т1-нитробензил или дифенилметил;
R - группа -СН2ОН или -СООКу, где
R - алкил с 1-5 атомами: углерода, которые являются полупродуктами в синтезе веществ с антибактериальной активностью.
Известны 4-окса-аналоги соединений Формулы (I) - -клавулановая кислота: 3-Ч -оксиэтилиден)-7-оксо-4-окса-l-азабицикло(3,2,0)гептан-2-карбоновая кислота или ее N,N-дизамещенные 3-,Р-аминоэтилиден)- или
S-эфиры 3-(Pr-тиоэтилиден)-производные, которые обладают физиологически активными свойствами.
Производные клавулановой кислоты
s получают взаимодействием сложного эфира клавулановой кислоты с соответствующим амином или меркаптаном (1).
Цель изобретения - получение новых соединений, расширяющих арсенал
10 средств воздействия на живой организмм.
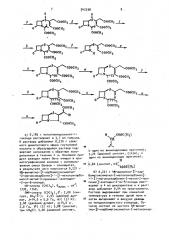
Поставленная цепь достигается тем, что в способе получения соединений формулы 1 соединение общей формулы
15 О
1 где R — алкип с 1-5 атомами углерода, подвергают взаимодействию с алленовым соединением Формулы
5 00С СН С=СН- СООТГ
3 942598 ф где R> - имеет указанные значения, где R3- - низший алкил, трихлорэтил, в среде толуола или бенэола при тем- бензил, й-нитробензил или дифенилпературе кипения с обратным холо- метил, в. бензоле при температуре дильником, образующееся соединение кипения с обратным холодильником, общей формулы образующееся соединение общей форо мулы
4 8 ааов, щ> м
0 а; ®<® iso О 0 0" OOOO@
Z 60оа э
rAe К3 и К4 имеют указанные значения, подвергают изомериэации в дихлор метане, при комнатной температуре, образующееся соединение общей формулы
0 (Ч) ШООВ 5
1 где К3 и К3 имеют указанные значения, подвергают. хлорированию хлористым тионилом в. присутствии пиридина при
10 С,образующееся соединение общей формулы "eooa, о" . -" соов, ВООК
r М+
60023 (y) 2@ ов (Х(} где К> и R4 имеют укаэанные значения подвергают озонированию при тем- 25
Э о пературе от "20 до -78 С в дихлорметане, образующееся соединение общей формулы ! где К и R3- имеют укаэанные эначе"
3 ния, конденсируют с трифенилфосфином при 65 С в присутствии пиридина, образующееся соединение общей формулы
000R
Ь
О "О СООТГ
4ООВ4, зо (.М) о оо 3 (Х(() Соотг где. Rq и К3. имеют укаэанные значения и Ph - фенил, озонируют в присутствии трифторуксусной кислоты при температуре от -20 до -78 С образующееся соединение общей формулы
40 s coon, 1 ((х1н)
"урр боои
f (Чп) а м о о Г - -соотг
Соотг
СООТГ где R> и R имеют указанные значения, подвергают гидролизу в присутствии силикагеля, образующееся соединение общей формулы
Соов, 1 (ч(()
ОФ где R имеет укаэанные значения, подвергают конденсации с соединением формулы
CH0= СООЗ5
1 где R и R имеют укаэанные значения, . восстанавливают трехбромистым фос- фором при "40 С в диметилформамиде, образующееся соединение общей формулы !
45 где К, R u Ph имеют указанные значейия, подвергают циклизации путем нагревания при 100-120 С в толуоле, и, в случае необходимости, целевой продукт, где Ка — -C00R3, переводят в целевой продукт, где
К - -.СН ОН, восстановлением и/или целевой продукт, где R< имеет указанные для R< значения, подвергают гидролизу для получения целевого продукта, где R4 - атом водорода.
Второй способ получения соединений общей формулы 1 совпадает с первым способом по стадии получения сое5 94259 динений формулы Xl с теми вариантами, что соединение формулы YI превращают в соединение формулы УП при . -2046, а соединение формулы X превращают в соединение формулы S
IXl при 10оС, затем образующееся соединение общей формулы Xl озонируют при температуре от -20 до
-78 С, образующееся соединение общей формулы 1о coom
С00а5 где Rc} и R< имеют укаэанные значения, подвергают хлорированию хлористым тионилом в присутствии пиридио на при 0 С и образующееся соединение общей формулы Х IY далее превращают как во втором способе. го
Пятый способ получения соединений общей формулы 1 совпадают с первым способом по стадию получения соединений формулы У, далее образующееся соединение общей формулы Y восстанавливают трехбромистым фосфором
25 о при -20 С в диметилформамиде, образукщееся соединение общей формулы
<ооа, 0 СООК
С00К
L где R> и R4 имеют указанные значения, подвергают озонированию при температуре от -2g до -78 С в дихлорметане. образующееся соединение общей формулы
Соотг (ХЧ11) зо
4о
1, С(}ОСА 0 7 -. COOCHg
С00СН
Э coom, 0ц, С10 (XIV) где Ry u R имеют укаэанные значеHHR кондейсируют с трифенилфосфином при комнатной температуре в присутствии пиридина, образующееся соединение общей формулы Xlll далее пре ,вращают как в первом способе.
Треий способ получения соединений общей формулы I совпадает с вторым способом по стадии получения соединений формуль1 Х, затем образующееся соединение общей формулы Х озонируют при температуре от -20 до
-78 С, образующееся соединение общей формулы - соок, у 0 (Хч)
0 10Н
СОов где R> и R< имеют указанные значения, подвергают хлорированию хлористым тионилом в присутствии пиридина при ОоС и образующееся соединение общей формулы XIV далее превращают как во втором способе.
Четвертый способ получения соединений общей формулы I совпадает с вторым способом по стадию получения соединений формулы VIII, затем образующееся соединение общей формулы
VllI озонируют при температуре от
-20 до -78 С, образующееся соедио нение общей формулы
COORS
О
0 Н
8 6 где В имеет укаэанные значения, подвергают конденсации с соединением общей формулы 1Х в бензоле при температуре кипения с обратным холодильником образующееся соединение общей формулы где В и R4 имеют указанные значения, подвергают гидролизу в присутствии силикагеля и образующееся -соединение общей формулы ХУ1 далее .превращают как в четвертом способе.
Пример 1. Метил (2R, 5R)."
-Е-метоксикарбонилметилен-7-оксо-" -тиа-1-азабицикло(3,2,0)гептан-2-карбоксилат.
Последовательность реакций: .
942598
СООСН Х осн, О
Ф
СООСНт С осн, О
О e006N
Ь О Н
ÑîîÑí
СООСНО Е
0ОС
С (-
СооСп соосн, СооСн, О СОО сооСн, с00
$ ооСн и еооен
Сн, Т
Сооан, м СООС (н )
Юн
45 а) 0,185 r метилпенициллинат-1-оксида растворяют в 3,7 мл толуола.
К раствору добавляют 0,270 r сложного диметилового эфира глутиновой кислоты и образующийся раствор подвергают нагреванию с обратным холодильником в течение 4 ч. Основной продукт реакции может быть очищен в хроматографической колонке с использованием смеси бензол - этилацетат, в результате чего получается 0,221 r
4 >-винилтио- (1-карбометоксиметил-2-метоксикарбонил)-,- (1-метоксикарбонил-2-метил-2-пропенил",-азетидин-2-он-б-оксида.
ИК-спектр (СНС1,,),1}м,„„,, см :
1770, 1740.
ПМР-спектр (CDC1 ), д : 2,00 (синглвт, СН9-С-1; 2,99 (двойной дуплет, J=14,0 и 5,0 Гц, с(.С (3) Н)
3,40 (двойной дуплет, J=14,0 и, 2,0 Гц, 1С (3) Н); 3,88 (синглет, три СН О}; 5,00 (широкий синглет, t у
6 и один из винилиденовых протонов);
5,24 (широкий синглет, C(4)H); и один из винилиденовых протонов);
ы
6,60 (синглет с(}об(н4 б) 0 221 r 4)..гвинилтио" 11-карбометоксиметил-2" метокси карбонил1-1- (1 -метокси карбонил-2-метил-2-пропенил -азетидин-2-он-5-оксида растворяют в 4 мл дихлорметана и к раствору добавляют 0,04 мл триэтиламина.
Раствор выдерживают при комнатной температуре в течение одной ночи и затем выпаривают в вакууме дважды из четыреххлористого углерода. Остаток состоит из чистого 4 -винилтио" fl-карбометоксиметил-2-метоксикар2598 10 шивании вместе с 0,4 r силикагеля.
1 о
15 го г5 зо
35 о
600
5э
9 94 бонил j-1- (1-метоксикарбонил-2-метил-
-1-пропенил)- азет иди н-2-îí- S-оксида и отвечают полному расчетному выходу.
HK-спектр (CHC t ), мокс см: 1775, 1725.
ПМР-спектр (СОС4),8: 2,12 и 2,30 снз два синглета,, =, 3,78 (син сн глет, три С Н О); 5, 11 (ш ирокий син глет
С(4)Н); . 6,64 (синглет =С-H). в) 0,221 г соединения, полученного з 1 б, растворяют в 12 3 мл хлористого о метилена и охлаждают до -78 С ° Поток озона в кислороде пропускают через этот раствор до тех пор, пока он не окрашивается в синий цвет. Образующийся в результате оэонид восстанавливают путем взбалтывания с водным раствором пиросульфита натрия ° Органическую фазу высушивают над безводным Na SO+ и выпаривают в вакууме, в результате чего получают 0,172 г
4 -винилтио- (1-карбометоксиметил-2-метоксикарбонил1- 1-метоксиоксалоил-аэетидин-2-он-5-оксида.
ИК-спектр (СНС13) Ф „ см : 1830, 1720.
ПМР-спектр (CDC1> ), К:
3,70 (синглат, два СН О); 3,88 (синглет, СН О); 5,27 (двойной дуплет, 7=5,5 и 2,5 Гц, С(4)Н);, 6,65 (синглет =С-Н). г) раствор О, l72 г 48-винилтио-11-карбометоксиметил-2-метокси карбонил)-1-метоксиоксалоил-азетидин-2-он-S-оксида в 1,15 мл безводного диметилформамида охлаждают до -20оС и к этому раствору добавляют при одновременном перемешивании 0,07 мл трехбромистого фосфора.
Через 10 мин смесь вливают в этилацетат и дважды промывают водой. Органический слой высушивают безводным сульфатом натрия и выпаривают в вакууме, в результате чего 1получается.
0,126 r 4+винилтио-11-карбометоксиметил-2-метоксикарбонил1-1-метоксиоксалоил-азетидин-2-она.
ЯМР-спектр (СОС1 ): 3,76 О(синглет два СН О); 3,97 д (синглет .СН О);
5,65 0 (двойной дуплет, J=5,5 и
2,5 Гц,
=О" Hl. д) раствор 0,126 г 4Р-винилтио- (1 -карбометоксиметил-2-метоксикарбонил1-1- меток си о ксалоил-а эетиди н-2-она в 4 мл метанола выдерживают в течение ночи при интенсивном перемеПосле отфильтровывания нерастворимого продукта метанольный раствор выпаривают и остаточный продукт выпаривания подвергается разделению в хроматографической колонке с использованием для элюирования смеси бензола и этилацетата, в результате чего получается 0,063 r 4 -винилтио-Г1-карбометоксиметил-2-метоксикарбонил)-аэетидин-2-она.
ИК-спектр (CHCI3 ), 1)„„, см : 1780, 1740, 1715.
ПМР-спектр (CDC13), д
3,70 (синглет, два CH O) 3,83 (синглет -СНд-C=C); 5,11 (широкий синглет; C (4) H); 5, 77 (синглет, -О-Н) е) 0,14 мл метилглиоксилата (свежеприготовленного озонолизом из диметилфумарата) растворяют в 4 мл бенэола и ра ст вор нагревают с обратным холодильником в течение 30 мин в колбе Дина и Старка. После охлажо дения этого раствора до 50 С к нему добавляют 0,063 г соединения, приготовленного в соответствии с
1А, и образующийся раствор снова нагревают с обратным холодильником при температуре кипения в течение 3 ч, После разделения в короткой хроматографической колонке, заполненной силикагелем, с целью очистки продукта от избыточного количества метилглиоксилата, получают 0,134 г 4 3-винилтио-1 1-карбометоксиметил-2-метоксикарбонил)"1-|метоксикарбонил-1-оксиметил)-аэетидин-2-она в виде смеси его диастереоизомеров.
ПМР-спектр (СОС1 ): 3,75, 3,90 и 3,95 д (три синглета, три СН О);
5,38 сГ (синглет, >-СН-0(Н} 5,40 о (широкий синглет, C(4)H); 6,00 д (синглет, С-Н) . ж) К раствору 0,134 r соединения, приготовленного в соответствии с
1 6 в 2 мл безводного тетрагидроо фурана, охлажденному до 0 С, добавляют 0,032 мл пиридина и 0,028 мл хлористого тионила при одновременном перемешивании. Смесь выдерживают при перемешивании в течение 30 мин, нерастворимый продукт (хлоргидрат пиридина) .Отфильтровывают и образу" ющийся раствор выпаривают в вакууме при 30 С. Остаточный продукт выпари1 сооснг
М. 0, C00683
ЙОСА, 0. CoocH3 соосн, г
ОСп соосн
11 94259 вания в количестве 0,121 r представ- ляет собой 4 -винилтио- fl- карбоксиметоксиметил-2-метоксикарбонил1-1-(1-метоксикарбонил-1-хлорметил)-азетидин-2-он в виде смеси его диастереоизомеров.
ИК-спектр (СНС1 ) )мсвс см
1780, 1745,, 1715.
llMP"cïåêTð (C0Clg), К; 3,74, 3,75 и 3,92 (три синглета, три СН О); 10
5,30 (широкий синглет, С(4)Н; 5,91 (синглет, CHCl); 6,10 (синглет, - С-Н2. з) Раствор 0,121 г соединения, приготовленного в соответствии с
lж, в 2,5 мл, тетрагидрофурана и
2,5 мл диоксана с содержанием 0,028 мл пиридина и 0,!80 г трифенилфосфина нагревают при 65 С в течение 4 ч. Образующееся соединение 4 -винилтио- (1-карбометоксиметил-2-метоксикарбонил)-1-$1-метоксикарбонил-1-трифенилфосфоранилиденметил)-азетидин-2"он подвергается очистке при пропускании через силикагель. Выход продукта составляет 0,133 г. Инфракрас25 ный спектр (СНС1 ),9 сг ": 1755 (большой), 1715.
ПМР-спектр (СОС1 ) д:. 3,65 и
3,72 (два синглета, два СН О); 5,45 (широкий синглет, C(4)H); 6Щ8 (синглет, =С-Н1; 7,2-8,0 (мультиплет, 3 C+Q-группы). и} Раствор О, 133 г соединения, приготовленного в соответствии с
1 з в 8 мл дихлорметана охлаждают
35 . при "200С и добавляют 9,5 мл 104-ного раствора трифторуксусной кислоты в дихлорметане. Пропускают в течение 1 мин поток озона в кислороде, 40 раствор обезгаживают азотом и добавляют к нему 0,27 мп триметилфосфита. Образующийся раствор иэбалтывают с насыщенным раствором йаНСО5
О
II
1 г
СООСН, 8 12 и высушивают над безводным сульфатом натрия, в результате чего получается 0,080 г 4 -метоксикарбонилацетилтио-1- (1-метокси карбонил-1-трифенилфосфоранилиденметил) -азетидин-2-она.
ИК-спектр (СНС1 ), Д см 1: 1755 (большой). к) 0,080 r 4 -метоксикарбонилацетилтио-1- 1-метоксикарбонил-1-трифенилфосфоранилиденметил 1-азетидин-2-она, приготовленного в соответствии с 1и, растворяют в 3 мл толуола и нагревают при 120 С в течеО ние 30 мин. Продукт очищают от окисла трифенилфосфина путем пропускания через короткую хроматографическую колонку. Получают 0,036 г смеси целевого продукта и его изомера °
Очистка основного компонента (Е-изомера) осуществляется методом тонкослойной хроматоррафии.
Е-изомер:
ИК-спектр (CHC} ), 1) см : 1792, 1750, 1700, ПМР-спектр (СОС1 ), д : 3,31 (двойной дуплет, 1=16,5 и 4,0 Гцгс4.C(6)H);
3,86 (двойной дуплет, 3 =16,5 и, 2,0 Гц, f}С(6)Н); 3,91 и 3,92 (два синглета, два СН О), 5,53 (двойной дуплет, 1=4,0 и 2,0 Гц, О(5)Н); 5,64 (дуплет,3=1,0 Гц, С(2)Н), 6,29 (дуплет, J=1,0 Гц, =С-Н) .
Масс-спектр: m/е 257, 0355 (М, . рассчитано согласно формуле С 1 „МО-5
257, 0358); m/е 215, 0253 (M-EH CO, рассчитано согласно C H NÎ+S 215, 0252), m/å 156, 0119 М-СН СО-СООСН рассчитано согласно C
Пример 2. Метил "(2В, 5К)-Е-3-метоксикарбонилметилен-7-оксо-4-тиа-1-аэабицикло(3,2,0)гептан"2-карбоксилат.
Схема реакций:
14
942598
СОоСн г
ОСЯ, О
0 Q0 Со ООСНЗ
СООТГ
СООСЕ ж СООСНС Ю
0N Copen% pal CoOeR3
ОООЕа
СОСС 4 е
0" У
СООТГ К у. О ООСИ вЂ” 1 3 .сООСН, ц
Соосн, СООаП>
Н Соойт, СООС(Н)
1 а) 0,350 г метилпенициллинат-1-оксида растворяют в 7 мл толуола. К раствору добавляют 0,573 г сложного диметилового эфира глутиновой кислоты 3о и получаемый раствор подвергают нагреванию с обратным холодильником в течение 4 ч. Основной продукт очищают хроматографически, используя смесь бензола с этилацетатом. В результате получают 0,420 г 4 -винилтио- 11-карбометоксииетил-2-метоксикарбонил)- 1- 1.1-метоксикарбонил-2"
-метил-2-пропенил)-азетидин-2-он-5-оксида. о
ИК-спектр (СНС1 ), М „<„кс см: 1770
-1
1740.
ПМР-спектр (СОС13), О: 2,00 (синглет, СН -С-); 2,93 (двойной дуплет, J=14,0 и 5,0 Гц, d,C(3)H); 3,40 (двойной дуплет, Д =14,0 и 2,0 Гц, С(3)Н); 3,88(синглет, три СН О);. м cooc(n),5,00 (широкий синглет, СЙ
=C1 и один из винилиденовых протонов);
5,24 (широкий синглет, С(4)Н и один из винилиденовых протонов); 6,60 (синглет, Н с
6) 0,,420 г соединения, приготовленного в соот ветст вии с 2а, растворяют в 7,5 мл дихлорметана и добавляют 0,075 мл триэтиламина. Раствор выдерживают при комнатной температуре в течение 8 ч и. затем выпаривают давжды в вакууме из четыреххло" ристого углерода. Остаток включает чистый 4 -винилтио-1 1-карбометоксиметил-2-метоксикарбонилJ-1-11-метоксикарбонил"2-метил-1-пропенил)-азетидин-2-он-боксид с количест" венным выходом.
ИК-спектр (СНС1 ) 1) макс см
1775, 1725.
ПМР-спектр (СОС1 ), d: 2,12 и
-H3
2,30 (два синглета, сн
3,j8 (синглет, три СН О); 5 (широкий синглет, С(4)Н); 6,64 (син-, глет, =С-Н). в} 0,420 r соединения, приготовленного в соответствии с 26, растворяют в 23 4 мл хлористого метилена и охлаждают.до -78 С. Через этот гаствор пробулькивают поток о она в кислороде до появления синей окраски. Получаемый озонид восстанавливают, для чего взбалтывают его с водным раствором пиросульфита натрия.
Органическую фазу высушивают над
15 9425 безводным сульфатом натрия и выпари- вают в вакууме, получая 0,327 г
4 -винилтио-Pl-карбометоксиметил-2-метоксикарбонилj- 1-метоксиоксалоил"азетидин-2-он-5-оксида.
ИК-спектр (СНС1 ), 9 см 1830, 1720.
ПМР-спектр (СОС15 ), д: 3,70 (син" глет, два СН О); 3,86 (синглет, CH 0); 5,27 (двойной дуплет, 5,5 и 10
Гц, С(4)Н); 6,65 (синглет, С" Н); г) Раствор 0,327 г соединения, приготовленного в соответствии с
2в; в 22 мл безводного диметилформамида охлаждают до -20 С и добавляют при перемешивании 0,13 мл трехбромистого фосфора.
Через 10 мин смесь вливают в этилацетат и дважды промывают водой. Органический слой сушат над безводным сульфатом натрия и выпаривают в вакууме, получая 0,240 r
4 -винилтио- 1-карбометоксиметил-2-метоксикарбонил)-l-метоксиоксалоил-азетидин-2-она.
ANP-спектр (СОС1 ), О: 3,76 {синглет, два СН О); 3,97 (синглет, СН О); 5,65 (двойной дуплет, J =5,5 и 2,5 Гц, С(4)Н); 6,20 (синглет, =С-Н). д) Раствор 0,240 r соединения, приготовленного в соответствии с 2 r, в 7,5 мл метанола выдерживают в течение ночи при интенсивном перемеши35 вании вместе с 0,75 г силикагеля.
После отфильтровывания нерастворимого продукта выпаривают метанольный раствор и остаток разделяют на хроматографической колонке с силикагелем, используя в качестве элюирующего раствора смесь бензола и этилацетата. 8 результате получают
0,120 г 4 -винил-тио-11-карбометоксиметил-2-метоксикарбонил)-азетидин45
-2-она.
ИК-спектр (CHCl ), 4 см
-1
1780, 1740, 1715.
ПИР-спектр (СОС1,, К: 3, 70 (син" глет, два СН О); 3,33 (синглет, -СН С=С); 5, 11 (широкий синглет, С(4)Н); 5,77 (синглет, С-Н). е) 0,27 мл метилглиоксилата (свежеприготовленного озонолизом диметилфумарата) растворяют в 7,5 мл бензола и раствор нагревают с обратным холодильником в колбе Дина-Старка в течение 30 мин. После охлаждения раствора до 50 С добавляют 0,120г
98. 16 соединения, приготовленного в соответствии с 2д, и полученный раствор вновь кипятят с обратным холодильником в течение 3 ч. Для очистки продукта от избытка метилглиоксилата его пропускают через короткую хроматографическую колонку с силикагелем и получают 0,255 r 4P-винилтио-н-(1-карбометоксиметил-2-меток«..сикарбонил)-1-(1-метоксикарбонил-1-оксиметил1-азетидин-2-она в виде смеси диастереоизомеров.
ПИР-спектр (СОС1 ),d : 3,75, 3,90 и 3,95 (три синглета, три СН О);
5,38 (синглет, Я-ВЯ.-О(Н) 5,40 (ши1
COO рокий синглет, С(4)Н); 6,00 (синглет =С-Н). ж) К раствору 0,255 г соединения, приготовленного в соответствии с
2е, в 3,8 мл безводного тетрагидрофурана, охлажденному до 0 С, при перемешивании добавляют 0,060 мл пиридина и 0;054 мл тионилхлорида. Смесь перемешивают 30 мин, отфильтровывают нерастворимое вещество (хлоргидрат пиридина и полученный раствор выпаривают в вакууме при 30 С. Остаток представляет собой 0,230 г
4Р-винилтио- 1-карбометоксиметил-2"
-метоксикарбонил1-1- (1-метоксикарбонил- 1-хлорметил1-азетидин-2-она в виде смеси его диастереоизомеров.
ИК-спектр (СНС1 ), 1), см
1780, 1745, 1715.
ПИР-спектр {СОС1 ), д : 3,74, 3,75 и 3,92 (три синглета, три СН О);
5,30 (широкий синглет, C(4)H5; 5,91 (синглет, СНС1); 6,10 (синглет =C-H)
3) Раствор 0,230 г соединения, приготовленного в соответствии с
2ж, в 15 мл дихлорметана охлаждают до -78 С и пробулькивают через него поток кислорода с озоном до окрашивания раствора в синий цвет. Смесь затеи взбалтывают с водным раствором пиросульфита натрия, сушат над безводным сульфатом натрия, выпаривают в вакууме и получают О, 140 г
4 -метоксикарбонилацетилтио-1- 11-метоксикарбонил- 1-хлорметил1-азетидин-2-она.
-1
ИК-спектр (СНС1 ), 9 („с см
1785, 1750.
ПЙР-спектр (СОС1 ), 0 : 3,66 (синСо глет, Сд, 3,85 и 3,92 (два
СО
2598
18 хроматографической колонке от окиси трифенилфосфина и получают 0,036 r . смеси целевого соединения и его Z-иэомера. Очистку основного компонента (Е-иэомера) осуществляют методом тонкослойной. хроматографии. ,г Е-.изомер
ЙК-.спектр (CHC13 ),1) см : 1792, 1750, 1700. о ПМР-спектр (C0C13)(f. 3,31 (двойной дуплет, J =16,5 и 4,0 Гц
LС(6) Н); 3,86 двойной дуплет, J =
=16,5 и 2,0 Гц, PC(6)H); 3,91 и
3,92 (два синглвта, две СНЗС);
5,53 (двойной дуплет, J=4,0. и
2,0 Гц, С(5)Н); 5,64 (дуплет, 3 =
1 0 Гц, С(2)Н); 6,29 (дуплет, J =
=1,0 Гц, =С-Н)..
Haec-спектр: m/е 257, 0355 (Мт, рассчитано для С,НнМО 257, 0358);
m/е 215, 0253 (M-СН СО, рассчитано для QH9N04 215, 0252}; m/е 156, 0119 (М-СНБО-СООСН, рассчитано. для Cg H NOg 1 56, 01 19) .
Пример 3. Метил l(2R, 5R)-Е-3-метоксикарбонилметилен-7-оксо-4-тиа- 1-азабицикло(3,2,0) гептан-2-карбоксилат.
Схема реакций.
О
0 0
1 1 1 а, 0 ссоснс г (««H0
Н СООС0
СООСН К о
1 сооСн, . г 8
О )-О еООСН, О- . О СО
СООСнь coon>..(2
Соосн
ОСн
С00СН и
""-Н-Н С00СН, 0»
О. Н
Соосн
СООСН н к . соосн и сооСн
1 !
® ®" о ÐPh о р" с
eoocH
СооСа
17 94 синглета, два СН О)", 5,75 (широкий синглет, C(4)H); 6,08 (N-СН-И)
1 и) Раствбр 0,140 r соединения, приготовленного в соответствии с 2з в 5,5 мл беэ водного тетра гидрофурана, содержащий 0,025 мл пиридина и 0,167 г трифенилфосфина после осторожного нагревания выдерживают при комнатной температуре в течение
8 ч. После очистки на силикагеле получают 0,080 г 4 -метоксикарбонилацетилтио-1- (1-метоксикарбонил-1-трифенилфосфоранилиденметил)-азеTHAHH=2-OHB
ИК-спектр (СНС13) 0 11 с1кс см
1755 (бол ьшой ) °
ПИР-спектр (СОС1 ),д: 3,60 и
3,74 (два СН О); 5,80 (широкий синглет, С (4) Н); 7, 1-8, 1 (мул ьтиплет, 3 C6Н -группы) . к) 0,080 г 4 -метоксикарбонилацетилтио-1- 1-метоксикарбонил-1-.
-трифенилфосфоранилиденметил)-азетидин-2-она, приготовленного в соответствии с 2и, растворяют в 3 мл толуола и выдерживают при 120 С о
30 мин. Продукт очищают на короткой
С00СН, m » С00СН, ОСн O он
Еоосн, !
9 94 а) 0„350 r метилпенициллинат-1-оксида растворяют в 7 мл толуола. К раствору добавляют 0,513 г сложного диметилового эфира глутиновой кислоты, и получаемый раствор подвергают нагреванию с обратным холодильником в течение 4 ч. Основной продукт очищают хроматографически, используя смесь бенэола C этилацетатом. В результате получают 0,420 r 4p-винилтио- (1-карбометоксиметил-2»метоксикарбонил)-1-$1-метоксикарбонил-2-метил-2-пропенил)-аэетидин-2-он-5-оксида.
ИК-спектр (СНС1 ),9„ «см: 1770, 1740.
ПМР-спектр (CDCly), d: 2,00 (синглет, СН"С-); 2,93 (двойной дуплет, 714,0 и 5,0 Гц, о!.С(3)Н}; 3,40 двойной дуплет, iJ=14,0 и 2,0 Гц, 1С(3)Н); 3,88 (синглет, три СН О);
5,00 (широкий синглет X СООС(Б3)
CK
I г С. и один из винилиденовых протонов), 5,24 (широкий синглет, С(4)Н и один из винилиденовых протонов), .6,60 (синглет, уФ Н
Соое(н,) б) 0,420 r соединения,. приготовленного в соответствии с 3а, растворяют в 7,5 мл дихлорметана и добавляют 0,075 мл триэтиламина. Раствор выдерживают при комнатной температуре в течение 8 ч, и затем выпаривают дважды в вакууме из четыреххло" ристого углерода. Остаток включает чистый 4 -винилтио- 1-карбометокси-. метил-2-метоксикарбонил)-1- 1.1-метоксикарбонип-2-метил-1-пропенил)-азетидин-2-он+оксид с количественным выходом. -1
ИК-спектр (CHCl>},4 „ см: 1775,.
1 725.
ПМР-спектр (СРС1 ), д: 2,12, и нз
2,30 (два синглета,., +3
3,78 (синглвт, три СН О)", 5,11 (широкий синглет, С(4)Н); 6,64 (син.глет, =С-Н) . в) 0,420 г соединения, приготовленного в соответствии с 3б, растворяют в 23,4 мл хлористого метилена
Через lg мин смесь вливают в этилацетат и дважды промывают водой.
Органический слой сушат над безводным сульфатом натрия и выпаривают в вакууме, получая 0,240 r 4 -винилзо тио-11-карбометоксиметил-2-метоксикарбонил)-1-метоксиоксалоил-азетидин-2-она.
ПИР-спектр (СОС1 ), d: 3,76 (синглет, два СН О); 3,97 (синглет, СН О); 5,65 (двойной дуплет, 1=5,5 и 2, 5 Гц, С (4) Н.); 6, 20 (син глет, =С-Н). д) Раствор 0,240 r соединения, приготовленного в соответствии с
Зг, в 7,5 мл метанола выдерживают в течение ночи при интенсивном перемешивании вместе с 0,75 г силикагеля. После отфильтровывания нерастворимого продукта выпаривают метанольный раствор и остаток разделяют на хроматографической колонке с силикагелем, используя в качестве элюирующего раствора смесь бензола и этилацетата. В результате получают
0,120 г 4 -винилтио" 1-карбометоксиметил-2-метоксикарбонил)-азетидин-2-она.
-1
ИК-спектр (CHC I ),Ì „см: 1780, 1740, 1715.
55 ПИР-спектр (CDCly),д : 3,70 (синглет, два СН О ); 3, 83 (синглет, "СН2С=С); 5,11 (широкий синглет, C(4)H); 5>77 (синглет, =C-H).
2598 20 и охлаждают до -78 С. Через этот раствор пробулькивают поток озона в кислороде до появления синей окрас" ки. Получаемый озонид восстанавливаs ют, для чего взбалтывают его с водным раствором пиросульфита натрия.
Органическую фазу высушивают над безводным сульфатом натрия и выпаривают в вакууме, получая 0,327 г 4 -винилтио-(1-карбометоксиметил-2-метоксикарбонил -метоксиоксалоил-азетидин-2-он-5-оксида.
ИК-спектр (СНС1 ),4 „ см : 1830, -1
1720.
ПМР-спектр (СОС 1 ) д: 3,70 (синглет, два СН О); 3,88 (синглет, СНБО); 5,27 (двойной дуплет, 5,5 и
2,5 Гц, С (4) Н) 6,65 (синглет =C-Н) . г) Растрор 0,327 г соединения, м приготовленного в соответствии с
Зв, в 2,2 мл безводного диметилформамида охлаждают до -20 С и добавляют о при перемешивании 0,13 мл трехбромистого фосфора. карбонил)-1-(1-метоксикарбонил- 1-хлорметил) -азетидин-2-она в виде смеси его диастереоизомеров.
ПМР-спектр (СОС1 ), Д : 3,76 (синглет, СО-СН -СООС(Н)); 3,90 и 3,94 (два синглета, две СНБО); 5,60 ю о(н) синглет {, г
Х ЛООС (н-3)
5, 72 (широкий синглет, С (4) H) . и) Раствор 0,140 г соединения, приготовленного в соответствии с
3э, в 5,5 мл безводного тертагидрофурана, содержащий 0,025 мл пири дина и 0.,167 гтрифенилфосфина после осторожного нагревания выдерживают при комнатной температуре в течение
8 ч. После очистки на силикагеле
20 получают 0,080 r 4P-метоксикарбонилацет илтис- t - (1-метоксикарбонил- 1-т рифе нилфосфоранилид енметил)- а зетидин-2-она.
-1
ИК спектр (CHC1 ), ум с c ° 1755 (большой) .
ПМР-спектр (СОС! ), К: 3,60 и 3,74 (два СН О); 5,80 (широкий синглет, С(4)Н); 7,1-8,1 (мультиплет, 3 С,Н - группы ) . к1 0,080 г 4 -метоксикарбонилацетилтио-1- (1-метоксикарбонил-1"
-трифенилфосфоранилиденметил)-азетидин-2-она, приготовленного в соответствии с 3и, растворяют в 3 мл толуола и выдерживают при 120 С 30 мин.
Продукт очищают на короткой хроматографической колонке от окиси трифенилфосфина и получают 0,036 г смеси целевого соединения и его Z.-иэомера. Очистку основного компонента (Е-изомера) осуществляют методом тонкослойной хроматографии.
Е-изомер.
HK-спектр (СНС 1 ), O y см: 1792
1750, 1700.
ПМР-спектр (СОС1 ), д: 3,31 (двой ной дуплет, 5=16,5 и 4,0 Гц, d.c(6)H)
3,86 (двойной дуплет, б =16,5 и 2,0 Гц р С(6)Н); 3,91 и 3,92 (два синглета, два СН О); 5,53 (двойной дуплет, <=4,0 и 2,0 Гц, С(5) Н), 5,64 (дуплет =-1,0 Гц, С(2)Й); 6,29 (дуплет, S=
=1,0 Гц, =С-Н).
Масс-спектр: m/е 257, 0355 (И +, рассчитано для НнйО 257, 0358) „
942598 22 е) 0,27 мл метилглиоксилата (свежепри готовленного озонолизом диметилфумарата) растворяют в 7,5 мл бенэола и раствор нагревают с обратным холодильником в колбе Дина-Старка в течение 30 мин. После охлаждения раствора до 50 С добавляют 0,120 г соединения, приготовленного в соответствии с 3д, и полученный раствор вновь кипятят с обратным холодильником в течение 3 ч. Для очистки продукта от избытка метилглиоксилата его пропускают через короткую хроматографическую колонку с силикагелем и получают 0 255 г 4 -виУ
15 нилтио-(1-карбометоксиметил-2-метоксикарбонил)- 1-(1-метоксикарбонил-1-оксиметил)-азетидин-2-она в виде смеси диастереоизомеров.
ПМР- спект р (С ОС1 ), ": 3, 75, 3,90 и 3,95 (три синглета, три CH O); 5,38 (синглет, У-СН-0(Н) 5у40 (ши
СОО рокий синглет, С(4)Н); 6,00 (синглет =C-Н) . ж1 Раствор 0,255 r соединения приготовленного в соответствии с
Зе, в 17 мл дихлорметана охлаждают до -78 С и пробулькивают через нео
ro поток кислорода с озоном до окрашивания раствора в синий цвет. Смесь затем взбалтывают с водным раствором пиросульфита натрия, сушат над безводным сульфатом натрия, выпаривают в вакууме и получают 0,155 г
4Р-метоксикарбонилацетилтио- 1-(1—
-метоксикарбонил-1-оксиметил)-азетиди н-2-она, ПМР-спектр (СОС1 ),4: 3,76 (синглет, с О-сн -сООс (н >) 3, 90 и 3,94 4о (два синглета, две СН О); 5,60 (синХ О(Н гл 5,72 (широкий синг
Ы СОоС(п.,)
45 глет, С(4)Н). э) К раствору 0,155 г соединения, приготовленного в соответствии с
3ж, в 2,3 мл безводного тетрагидрофурана, охлажденному до 0 С, при пе- . ремешивании добавляют О, 036 мл пиридина и 0,032 мл тионилхпорида. Смесь перемешивают 30 мин, отфильтровывают нерастворимое вещество (хлоргидрат пиридина) и полученный раствор выпаривают в вакууме при 30 С. Остаток представляет собой 0„140 г 4-винилтио- (1-карбометоксиметил-2-метокси0 О 00Щ Х 000Щ. Ф т Cp
C00CEg СООСН
СООСН, 0
СООСН 8 ( оан, СО0СН> (1
С00СН
С00СН5 р н д 1 >0 4 а 1 3 и но 00СНЪ
С00СН
23: 94259
m/e 215, 0253 (И-СЙвСО, рассчитано для CgHyN0y 215у 0252); m/е 156, 0119 (М-CHgCO "СООСНу, рассчитано для
QHgN0g» 156, 0119). а) 1,02 г метилпенициллинат-1-окг о сида"растворяют в 30 мл толуола. К раствору добавляют 1,5 г сложного диметилового эфира глутиновой кислоты и получаемый раствор подвергают нагреванию с обратным холодильником в течение 4 ч. Основной .продукт очищают хроматографически, используя
-смесь бензола с этилацетатом. В результате получают 1„23 г 4Р-винилтио- 11-карбометоксиметил-2-метокси" карбонил)-1- 11-метоксикарбонил-2-метил-2-пропенил)-азетидин-2-îí-S-оксида.
ИК-спектр (СНС1, ), 4„ „ссм : 1770, 1740.
ПМР-спектр (CDC)g ), д: 2,00 (синглет, СН-С-); 2,93 (двойной дуплет
514,0 и 5,0 Гц, ИС(3)Н); 3,40 (двойной дуплет, 514Д и 2,0 Гц, 8 24
Пример 4.Иетил (2R,5R) -Е-3-метоксикарбонилметилен-7-оксо-4-тиа-1-азабицикло(3,2,0)гептан-2-карбоксилат.
Схема реакций:
P С(3)Н); 3,88 (синглет, три СНБО);
5,00 (широкий синглет 3 СООТГ(Н )
СН
=C и.один из винилиденовых протонов);
5,24 (широкий синглет, С(4)Н и один из винилиденовых протонов); 6,60 синглет. -Ц
СООС(Н,) б) 123 r соединения, приготовленного в соответствии с 4а, растворяют в 22 мл дихлорметана и добавляют
0,22 мл триэтиламина. Раствор выдерживают при комнатной температуре в течение 8 ч и затем выпаривают дважды в вакууме из четыреххлористого углерода. Остаток включает чис45
25 94259 тый 4Р-винилтио- 1-карбометоксиметил-
-2-метоксикарбонил)-1-(1-метокси" карбонил-2-метил- 1-пропенил)-азетидин-2-он-5-оксид с количественным выходом. 5
ИК-спектр (CHC13 ),М„,с,„ см: 1775, 1725.
flHP-спектр (CDCl ), d: 2,12 и 2,30
CHAL два синглета, u > 3,78 (син- 1в еН глет, три СН О); 5,11 (широкий син- глет, С(4)Н); 6,64 (синглет, =C-H). в) 1,23 г соединения, приготовлен- ного в соответствии с 4б, растворяют в 68,5 мп хлористого метилена и охлаждают до -78ОС. Через этот раствор пробулькивают поток озона в кислороде до появления синей окраски. Получаемый озонид восстанавливают, для чего взбалтывают его с водным раствором пиросульфита натрия. Органическую фазу высушивают над безводным сульфатом натрия и выпаривают в вакууме, получая 0,96 г 4Р-винилтио-51-карбометоксиметил"2-метоксикарбонил -1-метоксиоксалоил-азетидин-2-он"5-оксида.
ИК-спектр (CHCl ),Ф см : 1830, 1720.
ПМР-спектр (CDCly),д: 3,70 (син" глет, два CH@0); 3,88 (синглет, СН О);
5,27 (двойной дуплет, 5,5 и 2,5 Гц, С(4)Н); 6,65 (синглет, =C-Н).
r) Раствор 0,96 r соединения, приготовленного в соответствии с 4в, в 6 4 мл безводного диметилформамиУ о да охлаждают до -20 С, и добавляют при перемешивании 0,38 мл трехбромис40 того фосфора.
Через 10 мин смесь вливают в этилацетат и дважды промывают водой. Органический слой сушат над безводным сульфатом натрия и выпаривают в вакууме, получая 0,704 r 4 -винилтио-(1-карбометоксиметил-2-метоксикарбонил)- 1-метоксиоксалоил-азетидин. -2-она.
ПИР-спектр (СРС1 ), d; 5,76 (син" глет, два СНЗО}; 3,97 (синглет, CH 0); >О
5,65 (двойной дуплет, 3 =5,5 и 2,5 Гц
C(4)H); 6,20 (синглет, =С-H). д) Раствор 0,704 г соединения, приготовленного в соответствии с 4г в 22 мл метанола выдерживают в те- 55 чение ночи при интенсивном перемеши/ вании вместе с 2,2 г силикагеля.
После отфильтровывания нерастворимо8 26 го продукта выпаривают метанольный раствор и остаток разделяют на хроматографической колонке с силикагелем, используя в качестве элюирующего раствора смесь бензола и этилацетата. В результате получают 0,352r
4j3-винилтио- Г1-карбометоксиметил-2"
-метоксикарбонил)-азетидил-2-она.
ИК-спектр (CHCI ) ф„ „. см : 1780, 1740, 1715.
ПИР-спектр (CDCl,), Д : 3,70 (синглет, два СНЗО); 3,83 (синглет, -СНдС=С); 5,11 {широкий синглет, С(4)Н); 5,77 (синглет, =С-Н). е) Раствор 0,250 г 4 Ь"вИнилтио- f1 — карбометоксиметил-2-метоксикарбонил 1-азетидин-2-она в 42 мл дихлорметана охлаждают при -78 С и поток озона в кислороде пропускают через этот раствор до тех пор, пока он не становится синим. Смесь взбалтывают вместе с водным раствором пиросульфита натрия и высушивают над безводным сульфатом натрия. Получают 0,282 г 4 -метоксикарбонилацетилтио-азетидин-2-она.
ПМР-спектр (CDCl>), Д : 3,76 {синглет, СО-СН -СООС(Н ); 3,81 (синглет, CH 0); 5,35 (широкий синглет, С(4)Н); ж) Раствор 0,634 г свежеприготовленного метилглиоксилата в 42 мл бензола кипятят в колбе Дина и Старка в течение 30 мин. К этому раствору добавляют 0,282 г 4 -метоксикарбонилацетилтио-азетидин-2-она, приготовленного a ñooòâåòñòâèè с 4е, и смесь продолжают нагревать при температуре кипения в течение 3 ч. После разделения я короткой хромато-, графической колонке с целью очистки от избытка метилглиоксилата получают 0,155 г 4Р-метоксикарбонилацетилтио- 1-(1-метоксикарбонил- 1-оксиметил1-азетидин-3.
ПИР-спектр (СОС1 ), d : 3,76 (син" глет, СО-СН -СООС(Н )); 3,90 и 3,94 (два синглета, два СНБО); 5 60 (син"
М 0(Н) гпет ° н СооС(к,)
5, 72 широкий синглет, С (4) Н) .
e } К раствору 0,155 г соединения,. приготовленного в соответствии с
4ж, в 2„3 мл безводного тетрагидрофурана, охлажденному до ОоС, при перемешивании добавлярт 0,036 мл О СООСН,, — Г соосно о + COOClt3 аоосн, ® 3
С Г
О .соосн e S COOCH) н — У сооснз о о сооСн соосн, 3
f Соосн О н и г "Г соосно о
+ Ь о (р " 3 юоосн
27 942598 28
\ пиридина и 0,032 мл тионилхлорида. к1 0,080 г ф-метоксикарбонилСмвсь перемешивают 30 мин, отфиль- ацетилтио" 1- (1-метокси карбонил-1тровывают нерастворимое вещество -трифенилфосфоранилиденметил)- азе(хлоргидрат пиридина) и полученный тидин-2-она, приготовленного в сораствор выпаривают в вакууме при 1 ответствии с 4и, растворяют в 3 мл
30 С. Остаток представляет собой толуола и выдерживают при 120 С
4- винилтио- 9- карбометоксиметил-2- 80 мин. Продукт очищают на короткой
-метоксикарбонил)-.1- 1 "метоксикархроматографической колонке от окиси бонил- l.-хлорметил)-! аэетидин-2-он трифенилфосфина и получают 0,036 r в виде смеси его диастереоиэомеров. to смеси целевого(соединения и его ZПИР-спектр (СОС1у), д : 3,76 (син- изомера. Очистку основного компоненглет, CÎ-CHg"C00C(Hy)); 3,90 и 3,94 та (E-изомера) осуществляют методом (два синглета, две СНБО); 5,60 тонкослойной хроматографии.
0(Н)
7 Е"изомер б 1 ИК-спектр (CHC1 3 о 9мок см: 1792, синглет ф 1750, 1700. ю соотг(н }, r
ПИР-спектр {COC1>) д . 3 31 (двойной дуплет, Z =16,5 и 4,0 Гц, *С{6)Н):
5,72 (широкий синглет, С(4)H). 3,86 {двойной дуплет, S=16,5 и 2 9 Гц, и1 Раствор О, 140 r соединения, го C(6)H); 3,91 и 3,92 (два синглета, приготовленного в соответствии, с :две СН О); 5,53 двойной дуплет, 4э, в 5,5 мл безводного тетрагидро- J=4,0 и 2,0 Гц, C(5)H); 5,64 (дуп- . фурана,, содержащий 0,025 мл пиридина лет, J=1,0 Гц, C(2)H); 6,29 дуплет и 0,167 г трифенилфосфина после осто- =1ОО Гц, =С-H) ° рожного нагревания выдерживают при 25 комнатной температуре в течение 8 ч., Иасс-спектр: m/е 257, 0355 (И+, После очистки на силикагеле получают рассчитано для СоНнМО 257, 0358); (,080 г 4 "метоксикарбонилацетил- m/е 215, 0253 (И-СНзСО, рассчитатио"1- (1-метоксикарбонил-1-трифенил- но для СвНой04 215, 0252); m/е 156, фосфоранилиденметил) "азетидин-2"она. зо 0119 {И-СН СО-СООСНз, рассчитано
ИК-спектр (СНС1. ), 9 дсО сс Р ; 1755 для Н МО 156, 0119). (большой), Пример 5. Иетил (2R, 5R).ПИР-спектр (C0Cl ), д: 3,60 и -3-метоксикарбонилметилен-7-оксо3О74 (два СИ О); 5,80 {широкий син- -4-тиа-l-азабицикло(3,2,0) гептанглет, C(4)H); 7,1-8,1 (мультиплет, 3> -Z-карбоксилат.
3 С6Н -гРуппы). Схема реакций: о — (606СН о, БОСОНО сооснр соосн, l
СООС (н3) 29 9" 259 а) 0,89 г метилпенициллинат-1-оксида растворяют в 18 мл толуола. К раствору добавляют 1,3 г сложного диметилового эфира глутиновой кис-. лоты и получаемый. раствор подвергают Гнагреванию с обратным холодильником в течение 4 ч. Основной продукт очищают хроматографически, используя. смесь бензола с этилацетатом. В результате получают 1,07 г 4 -винил- to тио-(l êàðáîìåòîêñèìåòèë-2-метоксикарбонил3-1-(1-метоксикарбонил-2-пропенил)-азетицин-2-îí-S-оксида.
ИК".спектр (CHCIÇ) мокссм: 1770, ПМР"спектр (CDCIy), d: 2,00 (синглет, СН -С-); 2,93 (двойной дуплет, 5=14,0 и 5,0 Гц, о(.C(3)H); 3,40 (двойной дуплет, 3=14,0 и 2,0 Гц, С(3)Н);
3,88 (си н глет, три CH O); 5,00 (широкий синглетУ ®0С(Н }и один из
1 г
CH
=Сf 25 винилиденовых протонов); 5,24 (широкий синглет, С(4)Н и один из винилиден