Способ получения производных простагландина
Иллюстрации
Показать всеРеферат
ОП ИСАНИЕ
ИЗОБРЕТЕН Ия
Х ПАТЕНТУ
Союз Советскик
Социалистическик
Республик
< >944502 (61) Дополнительный к патенту (22) Заявлено 30. О1. 78 (21) 2719054/23-04 (51).М. Кл.
С 07 С 177/00 (23) Приоритет (З2) 31.01.77 (з1) 9652/78 (ЗЗ) Япония
Опубликовано 15. 07. 82. Бтоллетень М 26 (S3) УДК547. 689 .07(088.8) Дата опубликования описания 15.07. 82
Иностранцы
Сатору Еномото, Киро Асано, Хумио, амура, (Япония) Иностранная фирма
"Куреха Кагаку Когио Кабусики Ка (Япония) (72) Авторы изобретения ака (71) Заявитель (543 СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПРОСТАГЛАНДИНА
-осн с
СН
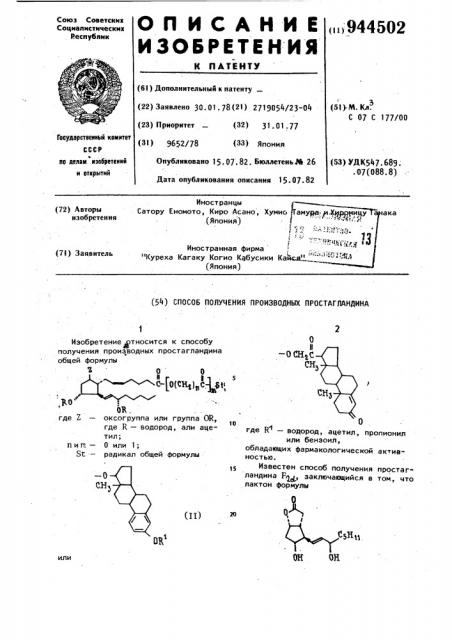
Изобретение относится к способу получения производных простагландина общей формулы
2,30 где Z
0R. оксогруппа или группа OR, где R — водород, али ацетил;
0 или l радикал общей формулы
О пит«вЂ”
Sz— — О
СН
OH ОН или
Гееударствевмый квинтет
СССР во лелем .изобретений и аткрытнй то где В" — водород, ацетил, пропионил .или бензоил, обладающих фармакологическои активностью.
15 Известен способ получения простагландина F заключающийся в том, что лактон формулы з 944502 4 обработкой дигидропираном превращают в бис-тетрагидропираниловый эфир, который восстанавливают диизобутил- . алюминийгидридом в соответствующий лактол и затем подвергают конденсации с реактивом Виттига, полученным из 5-трифенилфосфониопентановой кислоты и димсилнатрия, с последующим гидролизом разбавленной уксусной кислотой (1 1, 1О
Однако отстутствуют сведения о способе получения фармакологически активных простагландинов общей формулы I..
Цель изобретения - расширение ас- 15 сортимента фармакологически активных простагландинов.
Цель достигается тем, что простагландин ПГФ tI< или ПГЕ в виде серебряной соли или соли щелочного металла о со свободными или ацетилированными оксигруппами подвергают взаимодействию с Г„ - или С 1„ -оксигруппой соответствующего стероида в присутствии связывающего агента ol-бромацетилбро-у5 мида или пятибромистого фосфора с последующим, в случае необходимости ацетилированием свободных гидроксильных групп, после чего полученные целевые продукты выделяют.
Процесс проводят в растворителе, предпочтительно апротонном, например в безводном тетрагидрофуране, диметилсульфоксиде, и при температурах, близких к комнатной и ниже.
Для ацетилирования свободных гидроксильных групп в соединении общей формулы I используют уксусный ангидрид, предпочтительно в присутствии пиридина.
Производные простагландина общей формулы I могут найти эффективное применение для преждевременного прерывания беременности, стимулирования родов, улучшения процесса оплодотво45 рения, восстановления нарушений менструального цикла, а также в качестве противозачаточных средств.
Пример l. Получение зкстра1,3,6(10)-триен-3-окси-17-оксикарбонилметил-9+, 11d, 15сЬтриокси-5-(цис)-13(транс)-простадиеноата (ПГФЕ) и соли калия или серебра 9d, 11с, 15cL-триокси-.5-(цис)-13 (транс)-простадиеновой кислоты (ПГФ, ):
Получение соли калия ПГФ 1
1 мл воды добавляют в 0,1053 г (2,97 х 10 моль) ПГФяу, и смесь перемешивают при (+1) — (-2)ОС, при этом в смесь медленно добавляют 1 мл водного раствора, содержащего 0,0205 г едксго кали, образуется прозрачный раствор после перемешивания 1 ч, при этом значение рН раствора 7,5-8,5.
Получение соли серебра ПГФ .
0,05301 r азотнокислого серебра растворяют в небольшом количестве воды и полученный раствор добавляют в водный раствор соли калия ПГФ в темноте. Раствор перемешивают 15 мин, в результате чего соль серебра ПГФg белого цвета выпадает в осадок. После Фильтрации белого осадка, .собранный материал. промывают водой, а затем простым эфиром, после сушки при комнатной температуре при пониженном давлении получают соль серебра белого цвета (0,1.085 г), выход 79,143.
Получение зстра-1,3,5(10)-триен-Зф-ол-179-бромацетата.
10. г эстрадиола растворяют в
400 мл обезвоженного тетрагидрофураяа (ТГФ); а затем в смесь добавляют
8,8,г безводного пиридина и при (-5)(-7)ОС,по каплям добавляют раствор, содержащий 74 г четыреххлористого углерода и 22,5 гс! -бромацетилбромида. Смесь оставляют на ночь, после завершения реакции, осадок отделяют фильтрацией и отгоняют растворитель из фильтрата.
Остаток растворяют в,простом эфире и перекристаллизовывают, получают зстра-1,3,5(10)-триен-3,17ф-дибромацетат. Затем 2 г полученного продукта растворяют в 900 мл метанола и раствор охлаждают до -5ОС, после чего в смесь по каплям добавляют 20 мл водного раствора, содержащего 0,2 r поташа.
Спустя 30 мин, в раствор добавляют
1000 мл воды, полученный осадок отделяют и сушат, получают эстрад,3,5-(10)-триен-3ф-ол-17 -бромацетат.
Реакция соли серебра ПГФ 0 с эстра-1,3,5(10)-триен-3 -ол-17 -бромацетатом.
0,1085 г (2,35 х 10 моль) соли серебра ПГФ я„1 растворяют в 2 мл диметилсульфоксида (ДИСО) в темноте, добавляют 0,1 г эстра-1,3,5(10)-3)3-ол-17 -бромацетата и смесь перемешивают при комнатной температуре в течение
2 дней. Осадок бромида серебра отделяют, а оставшийся раствор превращают в эмульсию в охлажденном состоянии
944502
)., ОЮ сОЩС
М
-o-си со са, !
0Е 6к
46
ОСЮСК) » .4 о енес о
СН
5 при добавлении 20 мл воды..В результате отделения при помощи центрифуги рования получают из эмульсии бледножелтый маслянистый продукт.
Реакционный продукт подвергают хроматографии на 42 г силикагеля
8 смеси растворителей (циклогексан, этилацетат и этанол в пропорции 45:
45:10 по обьему) с целью очистки продукта, получают с выходом 66,95ь простагландин формулы
Пример 2. Получение соединения ПГФ 1 и эстрадиола.
1 г. эстрадиола растворяют в 65 мл
ТГФ, содержащего в 5 r мела и 5 r пятибромистого фосфора, добавляют в течение 30 мин при перемешивании и
„!.0
-4 С, затем смесь перемешивают 30 мин
«ко при -4 С, перемешивание продолжают в течение 20 мин при 0 С и еще 3,5 ч при 20 С. Затеи реакционную смесь вы0 ливают в водный раствор бикарбоната натрия при. ОоС. Продукт экстрагируют при помощи простого эфира и подверга= ют очистке, ацетоном, получают 0,7 г очищенного продукта.
Очищенный продукт взаимодействует с серебряной солью: ПГФ,, полученной в примере 1 и получают соединение формулы. ОК
Пример 3. 3,3 г 11-дезоксикортикостерона в качестве производно« го простагландина растворяют в смеси растворителей, состоящей из 200 мл безводного ТГФ и 10 мл безводного пиридина, в раствор при (-5) — ("7PC по каплям добавляют раствор 0,3 г
<Ьбромацетилбромида в 80 г четыреххлористого углерода. Смесь перемешивают при комнатной температуре в течение одной ночи.
После завершения реакции остаток отФильтровывают, а растворитель отгоняют из фильтрата, остаток перекристаллизовывают из простого эфира. Взаимодействием этого соединения с серебряной солью ПГФ получают соединение формулы
f0
Пример .4. Получение эстраю -1,3,5(10)триер-3-.ацетокси-17-оксикарбонилметил-9с(, 11d, 15сЬтриацетокси-5(цис)-13(транс)-простадиеноата. . Соль калия и соль серебра ПГФ у и эстра-1,3,5(10)-триен-3-ол-17-бром-.
2s ацетат получают аналогично примеру 1.
Реакцию соли серебра ПГФ с эстра-l, . 3 5(10)-триен-3-ол-17-бромацетатом проводят по примеру 1. Смесь 0,029 г соединения ПГФ д„ и эстрадиола растзв воряют в 0,5 мл безводного пиридина, добавляют 0,15 мл уксусного ангидрида и перемешивают при комнатной температуре в течение ночи. После завершения реакции растворитель удаляют при 45 С и пониженном давлении, полу4 0 чают 0,0351 г ацетилированного соедин нения ПГФ»1А и эстрадиола, который представляет собой маслянистый продукт формулы
ОРОСИ)
Пример 5. Получение эстра-1»3»5(10)-триен-3-окси-17-оксикарбо"
,нилметил-9d„ 116; 156-триацетокси-5
: (цис)-13(транс)-простадиеноата.
В 1 мп безводного пиридина растворяют 0,1008 г ПГФ, добавляют 0,3 мл уксусного ангидрида и оставляют на ночь., После завершения реакции пири дин и уксусный ангидрид отгоняют при
40 С при пониженном давлении, а остао
94450?
0
СОСН1СО
0Н
Ф
0Н ОН
Осос н
Пример 7. 21 мг (2,73 х
-5 х 10 моль) вещества, полученного в примере 6, растворяют в 0,5 мл без-. водного пиридина и в смесь добавляют
0,15 мп уксусного ангидрида, смесь охлаждают льдом, выдерживают в течение ночи. После завершения реакции, растворитель отгоняют в вакууме при
400С, а остаток растворяют в смеси растворителей (этилацетат и циклогексан в объемных пропорциях 50:30), по20 лученный раствор пропускают через во, ронку с сипикагелем, получают с выходом 96,311 вещества формулы
OC0aK3 .
0 ;N4 снз
25 ососн, Зо осеем, С ОСН С О снз
4
ОСОСН
4О
П р и и е р 6. 0 l r (2 17 х х 10 моль) соли серебра ПГФ001 растворяют в 1 мл безводного ДМСО и в раствор добавляют. 0,13 г (2,.60 х х 10 моль) 3-6ензоипокси-1,3,5(10) — 45
-триен-!А-монобромацетата, оставляют в темноте при комнатной температуре.
После завершения реакции бромид серебра отделяют, фильтрат охлаждают и смешивают с водой, продукт отделяют 50 в маслянистом виде в нижней части центробежного сепаратора.
Маслянистый продукт сушат в вакууме в эксикаторе, затем растворяют в смеси растворителей (этилацетат, циклогексан и этанол в объемных пропорциях 45:45:10) и раствор пропускают через колонку с силикагелем, получают 0,12 г вещества формулы
ОК, о
СОСН с о
55ОН
ОСОС,Н, 7 ток промывают водой. Полученный маслянистый продукт отделяют. Затем к нему добавляют 2 мл воды и 3 мл этанола, 0,0186 г гидрата окиси калия при охлаждении водой в течение 1 ч, Затем в реакционную смесь добавляют раствор 0,0515 г нитрата серебра в
2 мл воды, реакцию продолжают 1 ч в темноте, получают 0,114 г соли серебра ацетилированного ПГФп,1
В 2 мл ДМСО растворяют 0,11 г соли серебра ацетилированного ПГФ0 1 а затем добавляют 0,1 г эстра-1,3,5 (10)-3-ол-17-бромацетата, оставляют на 48 ч в темноте. После завершения реакции бромид серебра отделяют, фильтрат смешивают с 20 мл холодной воды, полученный маслянистый продукт отделяют при помощи центробежного сепаратора. Продукт подвергают хроматографии на 42 r силикагеля при помощи смеси растворителей (циклогексан, этилацетат и этанол в объемных отношениях 45:45:1О). Очищенный проф дукт представляет собой маслянистую жидкость.
При помощи элементарного анализа и ИК-спектроскопии установлено, что продукт имеет следующую структуру
ОСОС К5 .
Пример 8. 0,1 г (2,17 х х 10" 4 моль) соли серебра ПГф 0 растворяют в 1 мл безводного ДМСО, добавляют 0,1I4 г (2,6 х 10 моль), 3-пропионилокси-1,3,5-(10)-триен-17р-моноацетата, реакция протекает в темноте при комнатной температуре в течение
3 дней. После завершения реакции бромид серебра отделяют, а фильтрат смешивают с водой, продукт отделяют в маслянистом виде при комнатной температуре при помощи центробежного сепа- . ратора.
Маслянистый продукт растворяют s ,смеси растворителей (этилацетат, циклогексан, и этанол в объемных пропорциях 45:45.:10), раствор пропускают через колонку с силикагелем, получают
0,12 г маслянистого продукта формулы
944502 l0 ! Пример 11. 0,1 г ПГЕ соли серебра растворяют в 1 мл безводного
ДМСО и затем добавляют 0,15 г 3-бена илокси-1,3,5(10)-триен-l7p-монобромацетата, реакция протекает в темноте при комнатной температуре в течение
3 дней. После завершения реакции про дукт подвергают очистке, получают
0,12 г бесцветного продукта формулы
1О
Ф ьЦ.
СК о
С 0 CQC ООЪЯ
СК
Ф
O+ . 6E
15
О °
Аналогично примеру / после частичного ацетилирования получают маслянистый продукт формулы
ОСОС, Формула изобретения
Сп бб
oc nonyueHHR производных прос о тагландина общей формулы ?
ОСОСН, 1
0 0 3
СОУС ОЖ,С
СЯ
0 -(о(с, „ ) st г5
ОСОСН) ОСОСН5 где Z
О.
Пример 10. 0,1 г (2,17 х — 4 х 10 моль) соли серебра f!f Å растворяют в 1 мл безводного ДИСО,добавляют
0,13 г З-бензоилокси-1,3,5(10)-триен-17fb-монобромацетата, реакцию проводят в темноте при комнатной температуре в течение 3 дней. После завершения реак ции продукт очищают, получают 0,12 г бесцветного маслянистого продукта формулы пиа—
Sa— или
4О оси е о
Ж) 4.
"Ъ
Ф
0Н
OCOegHy, Аналогично примеру 7 после частичного ацетилирования при комнатной температуре получают маслянистый продукт формулы 50
COaE3С6
55 1СОСК>
ОСЩЕ,.
Пример 9. 0,149 г (2,60 х х 10 4 моль) 11 деоксикортикостерон-21-бромацетата и 0,1 г (2,17 х х 10 моль) соли серебра ПГФ2 взаЫ. имодействуют в 1 мл безводного ДИСО в темноте в течение 3 дней, получают
1,3 r маслянистого продукта формулы оксогруппа или группа (Щ, где R — водород- или ацетил, 0 ипи 1, радикал общей формулы
О где R" — водород, ацетил, пропионил, или бензоил, о т л и ч а ю щ и й. с я тем, что, простагландин ПГфщ,или ПГЕ в виде серебряной соли или соли щелочного металла со свободными или ацетилиро ванными оксигруппами подвергают взаимодействию с С „ - или С .!-оксигруппой соответствующего стероида в присутствий связывающего агента aL-бромацетилбромида,или пятибромистого фосГ
11 944502 фора с последующим в случае необходи.мости, ацетилированием свободных гидроксильных групп, после чего полученные целевые продукты выделяют. 5
12
Источники инФормации, принятые во внимание при экспертизе
1. Corey Б . А ес. ai Synthesis
of Prostag1andin Рщ,and Е (dl).
Л Ап. Chem. Soc . 91, 5675 (1969).
11 i i
1 1
Тираж 445 : Подписное
° ВНИИПИ Государственного комитета СССР
rio делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб, д. 4/5
Заказ 5172/80
Филиал Wll "Патент", г. Ужгород, ул. Проектная, 4
Составитель Т. Левашова
Редактор И. Иитровка Техред И, гладь Корректор E. Ровко