Четвертичные аммониевые производные анилидов аминоуксусной кислоты,обладающие противоаритмической активностью
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
Союз Советских
Социалистических
Республик
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (61) Дополнительное к авт. сеид-ву (22) Заявлено 21 .01. 81(21) 3239010/23-04 (51) М. КЛ. с присоединением заявки №вЂ” (23) ПриоритетС 07 С 103/54
A 61 К 31/195
Государственный комитет
СССР по делам изобретений н открытий (53) УДК547.466 (088. 8) Опубликовано 07.0932. Бюллетень ¹ 33
Дата опубликования описания 19.11.82 и патологии сердечно- сосудистой системы при Кау медицинском и нституте и Мордов ский государственный университет им.Н.П.Огарева (71) Заявители (54) ЧЕТВЕРТИЧНЫЕ AMNOHHEBblE ПРОИЗВОДНЫЕ АН11ЛИДОВ
АМИНОУКСУСНОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ
ПРОТИВОАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ (H5 + ян ян — 4- н,— 5 -c.)t, х
Сн !01 Снз
Мегпи или 8скаин где Х вЂ” Й.,В1.,1, М 60зН, Изобретение относится к новым химическим соединениям, а именно к четвертичным аммониевым производным анилидов аминоуксусной кислоты, которые обладают гротивоаритмической активностью и могут найти применение для фармакологической коррекции сердечных аритмий.
Для предупреждения и устранения экспериментальных сердечных аритмий используют наряду с другими противоаритмическими средствами мембраностабилизирующего действия местные анестетики и их производные — новокаинамид и лидокаин (1). 15
Кроме того, описано и подтверждено клиническими испытаниями противоаритмическое действие местного днестетика-тримекаина (гидрохлорида d
-диэтиламиноацетил-2, 4, 6-триметилани- 20 лина С2,33 формулы
1н Н6
М m(du —
1Н " Н5 . 25
g()
По экспериментальным и клиническим данным тримекаин имеет определенные недостатки — неширокий спектр противоаритмического действия и кратковременность этого эффекта. и
Известны структурные аналоги предлагаемых соединений — четвертичные производные лидокаина, а именно метиллидокаин (4 ), который устраняет экспе-" риментальные желудочковые аритмии, вызванные нарушением кровоснабжения миокарда и интоксикацией сто>офантином.
Он оказывает более продолжительное действие, чем лидокаин и тримекаин, и не проникает через гематоэнцефалический барьер. его формула
Недостатком этих четвертичных производных лидокаина является невысокая противоаритмическая активность.
Целью изобретения является расширение арсенала средств, обладающих противоаритмической активностью и улучшение их свойств.
Предлагаются новые химические соединения — четвертичные аммониевые
956463 П2 6 5
СЦ5 — ЮН вЂ” (— Н2 —
А 2Е4 (ц„11 295
83 (255
МН-С-ЮИ - — С2Н5
Сн о Сн;Юн= н производные анилидов аминоуксусной кислоты об щей формулы где В- — 1н — oí-(M,-(н - М н, обладающие противоаритмической актив-1 ног тью.
Реакционные продукты при помощи известных методов изолируют и кристаллйзуют.
Таким методом могут быть получены различные четвертичные производные аминоацетанилидов.
Пример 1. Синтез N-(2,4,6-триглетилфенилкарфамоилметил)-аллилдиэтиламмония бромистого (Ж-92).
Иэ 4,92 г (0,02 моль) 2,4,6-триметил-N-диэтиламиноацетанилида, 3,46 мл (0,04 моль) бромистого аллила в 10 мл ацетона после нагрева-35 ния в течение 8-9 ч при 90 С, охлаждения и осаждения реакционной массы этилацетатом получено 7,0 r вещества, т.пл. 184-186оC (ацетон-этилацетат,) . 40
Вещество растворяется в воде, этаноле, хлороформе. Выход 94Ъ.
Найдено, Ъ: N Br 21,70.
CqgH2pr и 20
Вычислено, Ъ: N 7,58, Br 21,70; 45
П р и м а р 2. Синтез й-(2,4,6-триметилфенилкарбамоилметил)-пропаргилдиэтиламмония хлористого (Ж-94).
Нз 4,92 г (0,02 моль) 2,4,6-триметил-N-диэтиламиноацетанилида, 2,23 г (0,03 глоль) хлористого пропаргила, 10 мл ацетона после нагревания в течение 10 ч при 90оС выделяют (как описано выше) 6,05 г кристаллического вещества, т.пл. 173174 С (иэ смеси ацетон-этилацетат). .Вещество растворяется в воде, этаноле, ;хлороформе. Выход 93Ъ.
Найдено, Ъ: и 8,7; CI 10,60.
С Н СХЯ 0
Вычислено, о и 8,98, С2 10,98. 60
Пример 3. Синтез М-(2,4,6-триметилфенилкарбамоилметил)-бензилднэтилаглглония хлористого (Ж-101).
Аналогично предыдущему примеру из 4,92 г (0,02 моль) 2,4,б-три- 65
Предлагаемые соединения являются четвертичными производными тримекаина (сгл.табл.1).
В качестве исходного сырья для синтеза новых эффективных противо ритмических агентов применяют тримекаин, поскольку его производство как отечественного мес-.ного анестетика налажено на Анжеросудженском химфармзаводе.
Предлагаемые соединения могут быть получены взаимодействием 2,4,6-триметил-N-диэтиламиноацетанилида(тримекаина) в среде ацетона или этанола с соответствующими алкилирующими агентами, например метил-N-диэтиламиноацетанилида и
6,33 г (0,05 моль) хлористого бензила в 10 мл ацетона после охлаждения и добавления (при хорошем растирании остатка) этилацетата получают
7 г кристаллического порошка, т.пл. 154-155,5 С (иэ ацетона ). Be— щество растворяется в горячей воде, этаноле, хлороформе. Выход 93:.
Найдено, Ъ: N 7,47; Cl 9,45, С Р СЗИ20
Вычислено, Ъ: N 7,44; С1. 9,35.
Пример 4. Синтез N-(2,4,6-триметилфенилкарбамоилметил)-(о .-метоксифенилкарбамоичметил)-диэтиламмония хлористого (Ж-104).
Иэ 4,92 г (0,02 моль) 2,4,б-триметил-N-диэтиламиноацетанилида и 5,08 г (0,03 моль) о-метоксихлорацетанилида аналогично предыдущим примерам получают 6,15 г кристаллического вещества, т.пл. 113-115 С из смеси ацетон-эфир ). Вещество растворяется в воде, хорошо в этаноле, хлороформе.
Выход 70Ъ.
Найдено, Ъ; N 9,, 4,,СЯ 7,7.
С2лНэлС. Х и g0з
Вычислено, Ъ: N 9,61, С2 8,1.
Пример 5. Синтез N- (2,4,6-триметилфенилкарбамоилметил ) — (о-хлорбензил) -диэтиламмония бромистого (Ж-112).
4,92 r (0,02 моль) 2,4,6-триметил-N-диэтиламиноацетанилида, растворенного в ацетоне, или этаноле (1020 мл), нагревают с 6,16 г (0,03 моль) бромистого о-хлорбензила в течение
15 ч при 90 С. Полученная соль выпадает в виде кристаллов уже в реакционной массе. После охлаждения смеси добавляют эфир, осадок отфильтровывают. Получают б г белого кристаллического вещества, т.пл. 170-171,5 С (иэ смеси ацетон-эфир ). Вещество труд956463 мии составляла 0,28 0,01 мг/кг, тримекаин не оказывал защитного противоаритмического действия при аконитиновой аритмии. ЕД для метиллидакаина составляла 8,3+1,0 мг/кг.
Пример 8. Купирующее противоаритмическое действие соединения
Ж-94 при желудочковой аритмии у кошек, вызванной интоксикацией сердечным гликозидом-строфантином.
Опыты поставлены на 7 кошках мас« сой 2-3,5 кг, наркотизированных эта- миналом натрия (35 мг/кг). Внутривенным введением строфантина (8090 мкг/кг ) у животных вызвали стойкую желудочковую экстрасистолию.
Соединение E-94 при внутривенном введении в дозе 1,4 0,3 мг/кг купировало строфантиновую аритмию у кошек и восстанавливало правильный синусовый ритм, тримекаин устранял строфантиновую аритмию только во время внутривенного введения препарата. ЕД для метиллидокаина составляла 4,4 мг/кг.
Пример 9. Купирующее противоаритмическое действие соединения
K-104 при желудочковой тахиаритмии у собак, вызванной перевязкой ветви левои венечной артерии.
Опыты поставлены на 6 собаках.
Через 18-22 ч после перевязки передней ветви левой коронарной артерии у животных развивалась желудочковая политопная тахиаритмия с частотой сердечных сокращений больше 200 в
1 мин. Соединение Ж-104 в накопленной дозе 0,98 мг/кг подавляло эктопическое импульсообразование в желудочках и восстанавливало правильный синусовый ритм, сохранявшийся в течение 4-6 ч. На этой модели желудочковой аритмии тримекаин полностью устранял аритмию лишь в дозе 16 мг/кг, причем противоаритмический эффект сохранялся лишь в течение 10-15 мин и для его поддержания необходимо было капельное введение препарата со скоростью
1 мг/кг мин. Эффективная доза метиллидокаина на такой модели аритмии составляла 4-10 мг/кг.
Сравнительные данные о противоаритмической активности испытуемых веществ на различных экспериментальных моделях аритмий приведены в табл.2 °
Сравнительные данные о длитель- ности противоаритмического эффекта испытуемых веществ приведены в табл.3.
Сравнительные данные о широте терапевтического (противоаритмического) действия испытуемых веществ ,в эксперименте приведены в табл.4. но растворяется в холодной воде, хо-, рошо в этаноле, хлорофрме. Выход
87,7Ъ
Найдено, Ъ: N 6,, 22,,Вг 17,6.
С,„Н,,ВгС1Х О
Вычислено, Ъ: и 6,03, Вг 17,61..
Чистоту и индивидуальность продуктов реакции проверяют тонкослойной хроматографией на пластинках
Si PufoI? UV-254 и на бумаге "Ленинградская В" в системе растворителей: бутанол-этанол-уксусная кислота-вода в соотношении 80:20:10:30, проявление — парами йода.
Проведенные исследования показали, что предлагаемые четвертичные 5 производные тримекаина значительно превосходят тримекаин и метиллидокаин по противоаритмической актив, ности, широте спектра, стабильности и длительности противоаритмическо- 29 го эффекта, что иллюстрируется результатами исследования этих соединений на экспериментальных моделях сердечных аритмий.
П р е р 6. Защитное противоаритмическое действие соединения
Ж-112 при,фибрилляции желудочков у крыс, вызванной интоксикацией хлористым кальцием.
Опыты поставлены на 24 крысах 30 массой 150-200 r, наркотизированных уретаном (0,8 г/кг). Соединение Ж-112 в дозах 0,0007-0,09 мг/кг инъецировали внутривенно за 20 мин до внутривенного введения 10Ъ-ного ,раствора СаСХ>в дозе 2 мл/кг, вызывавшей в контрольных опытах гибель
70Ъ животных от фибрилляции желудочков, Соединение Ж-112 предупреждал хлоркальциевую фибрилляцию желудоч- 4() ков у крыс. ЕД для такого вещества на этой модели аритмии составляла
0,0069 + 0,0009 мг/кг. ЕД go для тримекаина на данной модели фибрилляции желудочков у крыс составляла 4,5+ 45
Ю,4 мг/кг (2,33. ЕД для метиллидокаина 0,02 0,001 мг/кг (4).
Пример 7. Защитное противоаритмическое действие соединения
Ж-92 при аконитиновой аритмии у крыс. 5Q
Опыты поставлены на 29 крысах массой 150-200 г, наркотизированных уретаном. Соединение Ж-92 в дозах 0,13,2 мг/кг инъецировали внутривенно за 20 мин до внутривенного введения нитрата аконитина в дозе 40 мкг/кг, вызывавшей в контрольных опытах аритмию у всех подопытных животных.
Соединение Ж-92 предупреждало аконитиновую аритмию у крыс. ЕД цля такого соединения на этой модели арит
956463
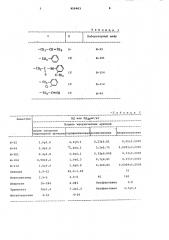
Таблица 1
Лабораторный шифр
-(Н -бН (Ц Sr
Ж-92
-сн, Ж-104
Ж-112
Ж-94 аблица2
ЕД или ЕД,мг/кг
Бешество после окклюзии коронарной артерии строфантинова аконитиновая оркальциевая
0,23+0,01
3,1+0,75
Ою3210г009
0,7+0,01
0,06+0,0009
0,0265+0,0005
0,53+0,0009
0,07+0,0001
0,0069+0,0009
0,4 0,01
160
40.
5-5
3-8
Неэффективен
16-184
16+1,4
4- 10
Неэффективен
4,5+0,4
4-10
Ж-92
Ж-94
Ж-101
Ж-104
Ж-112
Хинидин
Новокаинамид
Лидокаин
Тримекаин
Метиллидокаин
2,910,4
3,0+0,2
О, 4 0, 8
0,98+0,2
1,6+0,4
5, 5-15
Модель желудочковых аритмий
4,2+О;3
"1,4+0,3
1,0+0,1
1,0+0,3
1,4+0,2
49,5-1,66
2, 5-5
6,9т1
7,4+1,3
956463
Таблица 3
Длительность противоаритмического эффекта, мин
Вещество
Модель аритмий после окклюзии трофантиновая аконитиновая коронарной артерии
Более 100
Более 100
Более 100
Более 100
Ж-92
iK-9 4
Ж-10 1
Ж-104
Ж-112
Хинидин
Лидокаин
Тримекаин
Более 120
Более 120
Более 120
Более 120
Более 120
Более 100
До 10
До 10
60-180
Неэффективен
Неэффективен
Метиллидокаин.;Таблица 4
Терапевтическйй индекс ЛД д(ЕД или ЕД
Вещество
Модель аритмий после окклюзии,строфантиновая коронарной артерии
Ж-92
16,0
775
166
30,0
30;4
Ж-94
1604
13,7
71,2
1075 ь
6900
178
57,0
49,1
48,3
69,0
165,5 47,3
41,1.9594
8,4
24,0
2,7
41,3
17,8
Неэффективен 63
Неэффективен 25
27,0
12,5 где
3 СН 6Н=СН, Н =CH> СНу С Н5
Формула изобретения
Четвертичные аммониевые производные анилидов аминоуксусной кислоты общей формулы
Н
+ Сааб
МЯ (Н М ЗН6 Х
Нь Ю >
1! 5
Х -<1,3r обладающие противоаритмической активностью»
Ж-101
Ж-104
Ж-112
Хинидин
Лидокаин
Тримекаин
20-190
20-40
60-300 до 300
100-240
5-30 до 7 до 7
60-180 аконитиновая хлоркальциевая
956463
Составитель T.Чернобровова
Редактор 3. Ьородкина Техред Л. Пекарь Корректор С.Шекмар
Заказ 8842/31 Тираж 445
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, >i - 35, Раушская наб., д.4/5
Подпи с ное
Филиал IIIIil "Патент", r.Óæãîðoä, ул.Проектная, 4
Источники информации, принятые во внимание при экспертизе
Машковский И,Н. Лекарственные средства. N., "Медицина", 1972, T.1, с.333.
2. Генденштейн Э.И., Костин Я.В.
Кардиология, 1976, М 1, с.128-131.
3. Генденштейн Э.И. Костин Я.R.
Фармакология и токсикологии, 1976
Р 4, с.426-428.
4. Kni ffen F.J. Somas F.Å. Nobel-, 5 Allen@ А.S. Succhesi B.R,,"Circulation" l977, 49, ll 2, р. 264-271.