Способ определения интенсивности дыхания микроорганизмов
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистических
Республик
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
<))) 958495 (61) Дополнительное к авт, свид-ву— (22) Заявлено 23.02.81(21) 3247656/28-13 с присоединением заявки № (51) М. Кл.з
C 12 N 1/00
Государственный комитет
СССР ио делам изобретений и открытий (23) Приоритет (53) УДК 576. 8 (088. 8) Опубликовано 150982. Бюллетень,¹ 34
Дата опубликования описания 15.09.82 (72) Авторы изобретения
Н.С. Паников, Т.Ф. Бондаренко и Д.Г. Звягин) В. р(т,"(ор з(т т з
Московский ордена Ленина, ордена Октябрьской и ордена Трудового Красного Знамени государ университет им. М.В. Ломоносова
1 1 HATr(1Tr,а- т 3
Т"Х() - "М Я "
Революцйи тв е н фШЯЯ э Т),)(А (71) Заявитель (54) СПОСОБ ОПРЕДЕЛЕНИЯ ИНТЕНСИВНОСТИ ДЫХАНИЯ
МИКРООРГАНИЗМОВ
Изобретение относится к общей и
)технической микробиологии и может быть использовано для изучения кинетических параметров роста микробных культур, )три контроле процессов ферментации и т.д.
Известен способ определения интенсивности дыхания микроорганизмов амперометрически с использованием электрода Кларка (1).
Недостатком известного способа является то, что он,дает заниженные величины скорости дыхания, так как в процессе отбора пробы и ее переноса в полярографическую ячейку значительная часть субстратов дыхания успевает потребиться.
Наиболее близким к предлагаемому по технической сущности и достигаемому эФфекту является способ определения интенсивности дыхания миКроорганизмов, предусматривающий непрерывное культивирование их в аэробных условиях с последующим расчетом. Согласно этому способу измерение потреб- 25 ления кислорода микроорганизмами производится непосредственно в ферментере путем анализа стационарных концентраций О и СО в составе поступающей и выходящей из ферментера га- 30
:зовой смеси с пооледующим расчетом потребления О или выделения СО по разности (2) .
Данный способ характеризуется необходимостью поддержания скорости подачи воздуха в ферментере на строго определенном уровне, использованием дорогостоящих приборов — газоанализаторов, а также низкой чувствительностью и надежностью определения . скорости потребления кислорода, вследствие чего данный метод поэ воляет получать воспроизводимые результаты лишь при измерении интенсивности дыхания плотных и быстро растущих культур.
Целью изобретения является повышение точности и чувствительности способа.
Поставленная цель достигается тем, что согласно способу определения интенсивности дыхания микроорганизмов, предусматривающему непрерывное культивирование их в аэробных условиях с последующим расчетом, предложено в процессе непрерывного культивирования изолирование микроорганизмов от аэрирующего воздуха, измерение потребления растворенного в культуральной среде кислорода амперометричес958495 где Со и С вЂ” концентрация растэоренного кислорода в подаваемой среде (верхний предел насыщения кислородом н рн данн бй температуре) и микробной культуре соответственно, мкА/л; К,„коэффициент массопереноса кислорода, ч "; х — биомасса микроорганизмов, мг/л; q — удельная скорость потребления кислорода(- - — мкА/ч ° мг. 45
Ое х
Стационарные величины концентрации С могут быть найдены из уравнения (1) при условии dc jc3t = 0
50 культуру через нижнюю часть ферментационного сосуда. Постоянство объема культуры поддерживается за счет удаления избытка микробной суспензии с током воздуха через вертикальную .сливную трубку 2, вмонтированную в пробку из нетоксичной резины 3, срезанную под углом к горизонтальной плоскости. В эту же пробку вмонтиро-. ваны датчик растворенного кислорода
qo x о
"Ьо (2) 60 (3) а, — =-с х
О ки, возобновление подачи воздуха и регистрация возрастания концентрации растворенного кислорода, а при расчете интенсивности дыханий проведение коррекции калибровки датчика растворенного кислорода по формуле о ф Х
О К У где С и С - соответственно концен- 0 о трации растворенного кислорода в подаваемой среде (верхний предел насыщения кислородом при данной температуре) и 15 микробной культуре,мкА/л;
К вЂ” коэффициент массопереноCl са кислорода, ч ";
X — биоМасса микроорганизмов, мг/л;
20 (— удельная скорость потребления кислорода, мкА/ч мг.
Сущность предлагаемого способа заключается в следующем.
Скорость измерения концентрации растворенного кислорода (С) в непрерывной хемостатной культуре микроорганизмов определяется соотношением процессов его транспорта из газовой фазы в жидкую и потребления микробной биомассой в ходе дыхания, ="о" ->) - 0,<, (1) После отключения подачи воздуха в .культиватор массообмен между газом и жидкостью прекращается т.е. Kl. (C - 55
С)=0, и тогда скорость дыхания микробной культуры (q х) количественно
Oll определяется по скорости падения концентрации растворенного кислорода
Возобновление подачи воздуха в культиватор приводит к увеличению с со скоростью; которая может быть рас-65 считана путем интегрирования уравнения (1) при граничных условиях t = О, С = СМ1и
С-с
=-к„,, С-С„„„,„ где С„„„;, — концентрация растворенного кислорода в момент возобновления аэрации .
Уравнение (4) дает возможность графоаналитического определения ко-. эффициента массопереноса К1 в координатах *, : —.— t. В, уравнении (4) вместо величины С правомерно использование любых физических величин, линейно связанных, в том числе величина напряжения растворенного кислорода Q или" электрического тока в полярографическом зонде, используемом для экспериментальйого определения Р
В связи с этим калибровку полярографического зонда оказывается возможным производить непосредственно в ход выращивания культуры, сопоставляя величины силы тока со значением С, рассчитанным по уравнению (2) . Величину С„при этом находят из температурной зависимости растворимости кислорода в воде а Кь и скорость дыхания q x измеряют экспериментально.
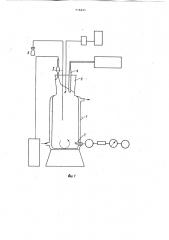
На фиг. 1 схематично изображена установка для культивирования; на фиг. 2 — электрод Кларка; на фиг.3 изменение концентрации кислорода.
Дрожжевую культуру Debariomyces
formicarius ВКМ-У-1555 выращивают при
28О C на синтетической среде следующего состава, г/л; глюкоза 0,2; (ИН4) SO4. 0,4; М Я(1 7Н, О 0,1;СаС1. х2Н О 0,02; КН Р04 0,8; ЗДТА 0,005; биотин 0,00001 смесь микроэлементов.
Я.
Культивирование ведут при скорости разбавления 0=0,069 ч " в установке, изображенной схематично на фиг.1.
Выращивание микробной культуры производят в стеклянном ферментационном сосуде 1 объемом 600 мп с рубашкой для термостатирующей жидкости. Перемешивание культуры осуществляют магнитной мешалкой, подачу среды— перистальтическим насосом. Увлажненный стерильный воздух поступает в
4, пробоотборник 5, используемый также для инокуляции, и толстостенный капилляр для ввода стерильной питательной среды 6. Описанная конструкция ферментационного сосуда позволяет быстро (1-2 с) изолировать культуру от атмосферного воздуха путем прек958495 ращения его подачи (перекрытие входа 7). Барботажный воздух выходит из ферментационного сосуда через отверстие в резиновой пробке с последующим установлением уровня жидкой фазы в пределах сливной трубки 2 (отмечено пунктиром).
Для измерения концентрации (напряжения) растворенного кислорода используют жалоинерционный и выдерживающий стерилизацию автоклавирова- 1() нием модифицированный электрод Кларка, который состоит (фиг. 2) из двух стеклянных деталей — корпуса 8 и стержня 9, несущего платиновый катод 10 в торцовой части, и серебря- 15 ный анод 11 в виде пластины или спи,рально накрученной вокруг стержня проволоки. Стержень 9 пришлифован к нижней части корпуса датчика, что дает воэможность фиксировать катод в Щ строго определенном положении. Между пришлифованными поверхностями оставлен канал 12 (за счет того, что стержень имеет в поперечном сечении форму круга, усеченного по хорде), наличие которого необходимо для продолжительной работы датчика. Нижнее отверстие корпуса 8 закрывают фторопластовой мембраной 13 (F-4, толщина 12 мкм), фиксирует ее кольцом из щ селиконовой резины 14 и эпоксидным клеем 15. Затем в корпус вводят элек-! тролит (lн NaC1) и стержень 9 с электродами, укрепляя последний в верхней части корпуса резиновой прокладкой 16 и парафином. Окончательную сборку датчика (введение электролита и установку электродов) производят после автоклавирования (0,5 атм, 30 мин) корпуса 8 с мембраной 13 в составе полностью собранной установки для непрерывного культивирования микроорганизмов.
После стабилизации культуры (3 сут, после инокуляции) производят измере,ние интенсивности дыхания: прекраща- 4> ют подачу воздуха в ферментатор и
1 регистрируют концентрации растворенного кислорода (фиг. 3), затем возобновляют подачу воздуха и регистрируют возрастание концентрации раство- 50 ренного кислорода. Величину К рассчитывают .по уравнению (3) -13 ч значение и по уравнению (2) оказывается равным 459 мкА О,, и скорость дыхания культуры (no уравнению 3) — 55
344 О
3 час
Предлагаемый способ позволяет повысить надежность и чувствительность определения интенсивности дыхания микроорганизмов более чем в 20100 раз, по сравнению с известным способом, дает хорошо воспроизводимые результаты с относительной ошиб-. кой определения, не превышающей .2%.
Формула изобретения
Способ определения интенсивности дыхания микроорганизмов, предусматривающий непрерывное культивирование их в аэробных условиях с последующим расчетом, отличающийся тем, что, с целью повышения точности и чувствительности способа, в процессе непрерывного культивирования микроорганизмы изолируют от аэрирующе — го воздуха, измеряют потребленче растворенного в культуральной среде кислорода амперометрически, возобновляют подачу воздуха и регистрируют возрастание концентрации растворенного кислорода, ъ при расчете интенсивности дыхания проводят коррекцию калибровки датчика растворенного кислорода по формуле
С
Со
va где С и С вЂ” соответственно концентрации растворенного кислорода в подаваемой среде (верхний предел насыщения кислородом при данной температуре) и микробной культуре,мкЛ/л;
К вЂ” коэффициент массопереноla са кислорода, ч биомасса микроорганизмов, мг/л у
q, — удельная скорость потребления кислорода, мкА/ч. мг °
Источники информации, принятые во внимание при экспертизе
1. Шольц К.Ф., Островский Д.Н.
Ячейка для амперометрического определения кислорода. В сб. Методы современной биохимии, 1975. М., Наука, с. 52-58.
2. Olijve W. Kok l.I. Analysis of
growth of gluconobacter oxydans Ы
glucose containiny теЖа. Arch.Microbiol, 1979, 121,3, р. 283-290.
958495 ,wA
20 юс т жа т
6 лиу
Фиг д
Составитель В. Голимбет
Редактор H. Горват Техред A.Ач Корректор Н. Король
Заказ 6982/36 Тираж 505 Подписное
ВНИИПИ Государственного Комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП Патент, r. Ужгород, ул. Проектная, 4