Способ получения 6-диметоксиметил-3-оксо-2-оксабицикло-(3,3, 0)-окт-7-ена
Иллюстрации
Показать всеРеферат
1. СПОСОБ ПОЛУЧЕНИЯ 6ТрКСИМЕТИЛ-З-ОКСО-2-ОКСАБИЦИКЛО , 1 ( 3,3,0)-ОКТ-7-ЕНА путем взаимодей- , ствия 6-ацетоксифульвена с нитроэтиленом в органическом растворителе в условиях реакции Дильса-Альдера с получением 5-нитро-7-ацетоксиметиленбицикло-
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСНИХ РЕСПУБЛИК (19) (11) >С59 С 07 D 307 77 ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР hO.ÄEËÀÌ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
- ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21 ) 3004628/23-04 (22) 17.11,80 (46) 23.04 ° 83. Бюл, р,15 (72) A. A. AxpeM, H, ф. Бондарь, Е. В. Королева, Т. Н. Омельченко и P. В..Скупская (71) Институт биоорганической химии
AH Белорусской ССР (532 547.728.07(088.8) (56) 1. Выложенная заявка ФРГ
Ю 2623184, кл. С 07 С 79/347, опублик. 1977.
2. М. J,. Croxall etc. "Prepara-:.
tion of Acetals or Ketals from
vinyl-type Esters". J. Am. Chem Soc»
1948, 70, 2805. (54)(57) 1, СПОСОБ ПОЛУЧЕНИЯ 6-ДИИЕТОКСИМЕУИЛ-3-ОКСО-2-ОКСАБИЦИКЛО(3 3 О)-ОКТ-7-EHA путем взаимодействия 6-ацетоксифульвена с нитроэтиленом в органическом растворителе в условиях реакции Дильса-Альдера с получением 5-нитро-7-ацетоксиметиленбицикло-(2,2,1)-гепт-2-ена и с последующей обработкой его в.атмосФере инертного газа, о т л и ч аю шийся тем, что, с целью упрощения процесса, 5-нитро-7-ацетоксиметиленбицикло-(2,2,1)-гепт-2-ен сначала обрабатывают метилатом натрия при 0-(-5) С, а затем хлористым водородом в среде абсолютного метано.
1ла при (-20) - (+50) С.
2. Способ по и. 1, о т л и ч аю шийся тем, что процесс ведут 18 в присутствии катализатора H80 BF
Ф Etj0.
967052 2
"б г НЮ1 еон
СНОАС
СНОАС
Снг=СНЯ02
Д g З4 иР
ОНС .и
i.араон .
Сн(ок),i г нС1 —Πс/(ФОЛС сщюска2
МО 2
М02
Н
1 — М
Изобретение относится к усовершенствованному способу получения
6-диметоксиметил-3-оксо-2-оксабицикло(3,3,0)-окт-7-ена.
Укаэанное соединение является промежуточным в полном синтезе простагландинов (ПГ) - биологически активных природиых соединений.
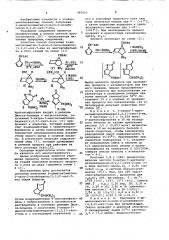
Известен способ получения 6-диметоксиметил-3-оксо-2-окса-бицикло(3,3,0)-окт-7-ена иэ ацетоксифульвена в пять стадий по схеме (1.)г 0 О с с и юг сщс 1, СН(ОЯ) МеОН т
2 В-Ме
Ацетоксифульвен вводят в реакцию
Дильса-Альдера с нитроэтиленом, полученный 5-.нитро-7-ацетоксиметиленбицикло(2,2,1)-гепт-2-ен (II) превращают в альдегид, который подвергают взаимодействию с триметилорто-" формиатом и затем полученный ацеталь подвергают последовательному воздействию едкого натра и соляной кисло-. ты. В результате получают гидроксамовый эфир (у), который превращают
Ь целевой продукт при действии на него раствора NaNOg L13 .
Основным недостатком этого спосс+ ба является его многостадийность °
Целью изобретения является упрощение процесса путем сокращения числа стадий получения целевого продукTà с пяти до двух (сравнить схемы I и II).
Поставленная цель достигается способом получения 6-диметоксиметилЗ-оксо-2-оксабицикло(3,3,0)-окт-7ена общей Формулы
9 (Сн(оСнД, путем взаимодействия 6-ацетоксифульвена с нитроэтиленом в органическом растворителе в условиях реакции Дильса-Альдера с получением 5-нитро-7ацетоксиметиленбицикло-(2,2,1)-гепт2-ена и с последующей обработкой его в атмосфере инертного газа сначала метилатом натрия при 0 — (-5) С, о а затем хлористым водородом в среде абсолютного метанола при (-20) (450)о С. При необходимости процесс проводят в присутствии катализатора
Н80 ВГ5 Ktq 0.
Процесс протекает по схеме (2):
СНОАС
Ф-ОАС
>маоСн, Выход целевого продукта при проведении процесса с катализатором или беэ ,него сравним. Однако продолжительность процесса при использовании катализатора и проведении реакции при о более высокой температуре 50 С составляет 12 ч в отличие от проведения процесса беэ катализатора (24 ч).
Катализатор, получают известным спо30 собом (2) .
П, р и м е р 1. 5-нитро-7-ацетоксиметиленбицикло(2,2,1)-гепт-2-ен.
К раствору 2,5 r (0,018 моль)
6-ацетоксифульвена в 10 мп беэвод35 ного бензола по каплям прибавляют раствор 3,9 г (0,053 моль) нитроэтилена в 10 мл безводного бенэола с. такой скоростью, чтобы температура реакционной смеси поддерживалась в
40 интервале 15-25ОС. Перемешивают при комнатной температуре 3 ч, упаривают реакционную смесь в ваккуме до
1/3 первоначального объема и хроматографируют на силикагеле Л 100/160(0, 45 элюируя смесью бензола с этилацетатом = 9:1.
Получают 1,8 r (48%) хроматографически чистого 5-нитро-7-ацетоксиметиленбицикло(2,2,1)-гепт-2-ена (V) в виде желтого масла, R) = 0,85 (силуфол JV 354 в системе бенэол:этил.ацетат =9:1). Мол. вес 209 (массспектрбметрнчески)с вычислено для
С H< N04 209. ИК-спектр, 1, см
-(, 1758 (C=O), 1537, 1371 (NO9). Спектр
55 ПМР, 0, м.д.: 1,20 дтр, 1Н; 2,20 м
1Н, Р,60 м 1Н, 3,80 м 1Н (циклические протоны); 4,90 м 1Н (CHN02).
2,04 с 3H (CH CO) 6,0 м и 6,42 м
2Й (HC=CH); 6,52 с 1Н (=CH-О).
60 П р и м е p . 2. Получение 6-диметоксиметил-3-оксо-2-оксаби0икло(3,3,0)-окт-7-ен беэ катализатора.
Синтез проводят в инертной атмосфере.
К охлаждаемому льдом (О О) раствору
1 5 r (7,2 ммоль) бициклогептена
967052
Составитель Л. Крисанова
Редактор Е. Зубиетова Техред Т.Маточка Корректор С. Шекмар
Заказ 6735/5 Тираж 416 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035 ° Москва, Ж-35, Раушская наб., д. 4/5
Филиал ППП "Патент", r. Ужгород, ул. Проектная, 4 (V) в 20 мл абсолютного .метанола добавляют по каплям 0,95 г (17,6 ммоль) метилата натрия в 12 мл абсолютного метанола и перемешивают 4 ч при О С.
Полученный раствор прикапывают к
50 мл охлаждаемого (-20 C) 2н. раствора HCl в абсолютном метаноле. Реакционную смесь перемешивают в течение 15 ч при комнатной температуре, нейтрализуют твердым NaHCO9 отфильтровывают, растворитель удаляют в 1О вакууме, остаток хроматографируют на силикагеле Л 100/160$ элюируя продукт смесью хлороформ:гексан = Зг2.
Получают 0,84 г ацеталя (I) (605).
0,75 (пластинки "Силуфол" в си- 15 стеме гексан:CHg Cl ..ацетон = 5:2:1,5).
Мол. вес(масс-спектрометрически) 198.
Вычислено для СЮН 404198. ИК-спектр, р-р в CC24, см г 1112, 1140, 1170, 1195 и 1218 (c o), 1750 (с:-О), 2835 (СН О). Спектр ПМР/р-р в CDCJp/
/3, м.д.: 1,48-2,72 4Н (протоны циклов), 3,34 с 6Н (ОСН ), 3,68 1Н (CHO)
4,2 д 1Н (НС/OMe), 5,8-6,2 м 2Н (НС» CH )„
Пример 3. Получение 6-диметокси-3-оксо-2-оксабицикло-(3,3,0)— окт-7-ен с катализатором. Синтез проводят в инертной атмосфере. К охлаждаемому льдом раствору 0,55 r (2,6 ммоль) 5 -нитро-7-ацетоксиметиленбицикло(ТД, 1 ) гепт — 2-ена (V ) в 13 мл абсолютного метанола по каплям добавляют 0,31 г (5,7 ммоль) метилата На в 5 мл метанола и перемешивают 4 ч при О С. Полученный раствор прикапывают к 20 мл 1,9 н. раствора HCI в абсолютном метаноле при
-20ОС. Реакционную смесь перемешивают 2 ч, затем добавляют катализатор
0,0015 г Hgo в 0,05 мл ВУ Et 0 и смесь перемешивают в течение 6 ч при 50 С. Реакционную смесь .нейтрао лизуют насыщенным раствором NaHCog, экстрагируют хлороформом, экстракт сушат MgS04 растворитель удаляют в вакууме, остаток хроматографируют на силикагеле Л 100/160jtl, элюируя продукт смесью хлороформ:гексан
3:2.
Получают 0,30 г (55%) хроматографически чистого продукта (I) иден тичного по данным тонкослойной хроматографии, ИК-спектроскопии и ПИРспектроскопии с соединением, описанным в примере 2. !