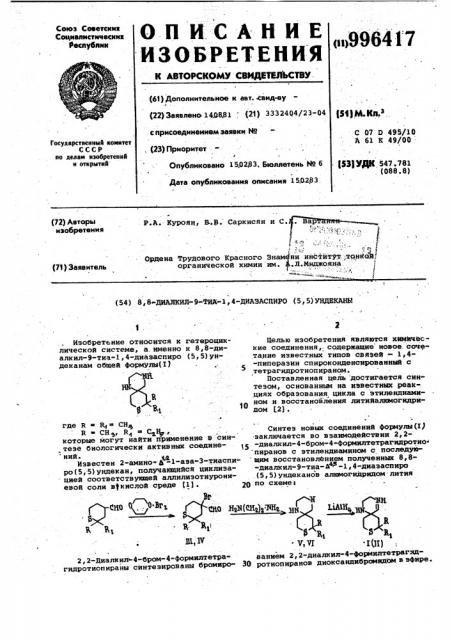
8,8-диалкил-9-тиа-1,4-диазаспиро /5,5/ ундеканы
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Союз Советския
Социалистических
Вес у ро996417 (61) Дополнительное к авт. саид-ву (22) Заявлено 140881 (21) 3332404/23-04
РОУД К з
С 07 D 495/10
А 61 К 49/00 с присоединением заявки Йо
Государствеииый комитет
СССР во делан изобретеиий и открмтий ., (23) Приоритет
Ю
Опубликовано 1502,83, Бюллетень М 6
Дата опубликования описания 150283.
1ЩУДК 547.781 (088. 8) P.A. Куроян, В.В. Саркисян и С.. Вар
Ф
Ордена Трудового Красного Знамени институт-;тонкойl органической химии нм. .Л.Мнджаяна (1 (72) Авторы изобретения (71) Заявитель (54) 8,8 ДИАЛКИЛ-9-ТИд 1, 4-дИЛЗЛСПИрО (5 5) уцдуццщ
Изобретение относится к гетероциклкческой системе, а именно к 8,8-диалкил-9-тка-1 4-диаэаспиро (5, 5) ундеканам общей формулы(1) Ф где Н Н СН
Н Сн Н г р Синтез новык соединений формулы(Х которые могут найтйприменение в син- заключается во взаимодействии 2,2тезе биологически активных соедине- 1g -диалкил-4-бром-4-Формилтетрагидротио пиранов с зтилендиамином с последуюИэвестен 2-амико- g -1-аэа-3-тиаспи- щим восстановлением полученных 8,8М,Ф ро (5, 5) ундекан, получающийся циклкза- -диалккл-9-тиа-Ь -1, 4-диаэаспиро цией соответствующей аллилизотиуронк- (.5,5)у»деканов алюмогкдридом.лития евой соли в1кислой среде (1). 2() по схеме
g-око,. 0 ьа
2,2-Лиалккл-4-бром-4-формилтетрагидротиопираны скнтеэкрованы бромироЗР PRii
Целью изобретения являются химические соединения,. содержащие новое. сочетание известных типов связей — 1 4-пиперазин спнроконденсированный с тетрагидротиопираном.
Поставленная цель достигается синтезом, основанньм на известных реак-, циях образования цикла с .этилендиами10 ном и восстановления лктийалквеогидридом (2) . ик
LiAlMg УП1
R 1.,ЧЕ - (1Ц ванием 2, 2-диалкил-4-формклтетрагидЗО ротиопиранов диоксандкбромкдбм в эФире.
996417
Пример 1. 2,2-Диметил-4-бром-4-формилтетрагидротиопиран (ШГ.
К раствору 6,3 г (0,04 моль) 2,2-диметил-4-формилтетрагидротиопирана в 50 мл абсолютного эфира небольшими . порциями по мере обесцвечивания при- 5 сыпают 12,4 r (0,05 моль) свежеприготовленного и высушенного диоксан-дибромида. Смесь перемешивают в течение
10-15 мин, отдувая выделяющийся бромистый водород током азота. По окон- :)0 чании отделяют эфирный слой, промывают водой до нейтральной реакции и сушат над безводным хлористым кальцием. После отгонки эфира остаток быстро перегоняют в вакууме.
Выход 5,4 г (56,9%), т.кип.. 98100 /4 мм, ц о1, 5410.
2, 2-Димет йл-4-бром-4-формилтетрагидротиопиран можно использовать в следующей стадии и без перегонки в вакууме.
Найдено, %: С 40,421 H 5,65;
S 13,61," Br 33,53
Сц Нлэ БОВ„, Вычислено %! С,40,51 Н 5,52;
S 13,49; ar 33,70,.
ИК-спектр9 „1720 см; 4 27ЦО см".
Аналогично получают 2-метил-2- этил-4-бром-4-формилтетрагидротиопиран (1Y) иэ 6,88 г (0,04 моль) 2-метил-2-.,30
-этил-4-формилтетрагидротиопирана в
50 мл абсолютного эфира и 12,4 r (0,05 моль) свежеприготовленного суxoro диоксан-дибромида, Выход1 5,1 r (50 8%), т.кип. 120-123О/5 мм, у ао l, 5385
Найдено, %: С 4 2.,85; Н 5,94;
8 1286; Вг 31 97, С Н„SOar.
Вычислено, % С 43 04; Н 6,02; 4О
S 12,74) Br 31,82..
ИК-спектр:4 1730 см ; 0 2735 см. -.ОО
Пример 2. 8 8-Диметил-9-тиа Ь -1,4-диазаспиро (5,5)ундекан (М )
В колбу помещают 5 r поташа, 3 мл
45 воды, 20 мл ацетонитрила, 3 г (0,025 моль) 50%-ного раствора этилендиамина и при перемешивании прикапывают раствор 5,7 r (0,024 моль) 2,2-диметил-4-бром-4-формилтетрагидротиопирана (ф) в 15 мл ацетонитрила, поддерживая температуру в интервале
15-20 С. Смесь перемешивают 5-6 ч и оставляют на ночь. Экстрагируют эфиром, сушат над едким кали и после от55 гонки растворителей остаток перегоняют в вакууме. Выход 2,.9 г (60,9%), т.кип. 145-147 /4 мм. При растирании продукт кристаллизуется. Он достаточно чист, но при необходимости его 60 можно перекристаллизовать из гексана, т.пл. 83-84 С.
Найдено, %| С 60.,751.Н 8,96
N 14,21; S 16 Зlf
Сло Н1е N2S ° 65
Вычислено, % г C 60.,56 Н 9,151
N l4,12 S 16,17. +
ИК-спектр! Ос) 1660 см 1у О д 3290 см.
ПМР-спектр б.м.д: 1,21 и 1,5 (8-СН ), С> 1,56 и 1,7 (7-СНд), д) 2,7 (2-СН ), Т; 3,3 (3-СН ), Му 7,23 (5-СН), T.
N = 198 (масс-спектрометрически) .
Аналогично иэ 5 rпоташа,,3 мл во ды, 20 мл ацетонитрила, 3 г (О, 025 моль), 50%-ного раствора этилендиамина и
6 г (0,024 моль) 2-метил-2-этил-4-бром-4-формилтетрагидротиопирана ()7 ) в 15 мл ацетонитрила получают
3,2 г (62,86%) 8-метил-8-зтил-9-тиа- 1461,4-диазаспиро (5,5) ундекана (Уl). T.кип. 150-152 /4 мм, п>1,5470.
Найдено, %: С 62,40; Н 9,58;
N 12,95; S 15,24.
Слл Hn7NLS
Вычислено,%: С 62,21; Н 9,49;
N 13,19 > . 8 15,09. л
ИК-спектр1 1680 см- ; дян 3300 см
ПМР-спектр б.м.д: 1,1 и 1,46 (8СН ),С; 0,9/СН (этил)/T; 2,73 (2-СН ), Т; 3,3 „(3-СН ), N; 7 26 (5-СН), T.
М = 212 (масс-спектрометрически).
Пример 3. 8,8-Диметил-9-тиа-1,4-диазаспиро (5,5) ундекан (E) .
В колбу помещают 60 мл абсолютного эфира и охлаждают ее льдом с солью до -10 С. Исключая доступ влаги, присыпают 1,5 г (0,039 моль) алюмогидрида лития. К полученной суспензии при перемешивании добавляют по каплям раствор 4 r (0,02 моль) 8,8-диметил-9-тиа- Ь4в -1,4-диазаспиро (5,5) ундекана (у) в 10 мл абсолютного тетрагидрофурана так, чтобы температура смеси не превышала 0ОС. Далее реакционную смесь перемешивают при комнатной температуре 5-6 ч и оставляют. на ночь. Затем колбу вновь охлаждают смесью льда с солью и осторожно добавляют б мл воды и 1,5 мл 15%-ного раствора едкого натра. Смесь перемешивают при комнатной температуре 3 ч и отфильтровывают. После отгонки эфира остаток перегоняют в вакууме.
Выход 3„3 г {82,35%) . т.кип. 124125 /3 мм, пр 1,5400, 4 1,0666.
Найдено, %: С 60,05; Н 10,17;
13,75; S 15,86.
c40 HmNCS
Вычислено, %: С 59,95; Н 10.,06
N 13 98 S 16 00
ИК-спектр:0qg. 3290 см л.
ПМР-спектр б.м.д: 1,23 и 1,51 (8-СНэ}, C) 2,46 (5-СН ), С; 2,66(2,3сн ), с.
М = 200 (масс-спектрометрически).
Аналогично иэ 8,49 r (0,04 моль)
8-метил-8-этил-9-тиа- ЬЮ-1,4-диазаспиро (5,5) ундекана (Ч ) и 2 65 г (0,07 моль) алюмогидрида лития в 80 мл абсолютного эфира получают 6,5 г (75,84%) 8-метил-8-этил-9-тиа-1,4- адиазаспиро (5,5) ундекана (П).
996417
Ф ., T.êèï. 140-142 /3 мм. пф 1, 5370, 44 1,0538.
Найдено, 6 С 61,40у Н 10,10)
N 12, 96), S 14,80.
С„„н„,язв.
ВьМислено, Фt С 61, 63) Н 10,34j
N 13 07) S 14,96.
ИК-спектр {1н@ 3295 см- .
ПМР-Спектр б.м;д. 1,1 и 1,46 (8-СН )., Су 2,4 и 2, 56 (5-СН ), ду
2 66 (2-3 сну), су 0,88/снз(зтил)/,т. М 214 (масс-спектрометрически) .
Формула изобретения . 8,8-Диалкил-9-тиа-1,4- дйаэаспиро (5,5) ундеканы; где т R Rq СН9
fl R СНз, Н„С Н
Источники информации, принятые во внимание при экспертизе
1. СоЬеп N., Banner В.,Ь, Синтез
2-амино-5,6-дигидро-4Н-1,3 тиаэинов и родственных соединений кислотно» катализируемой циклиэацией аллилиэотиурониевых солей. J. Hete гос!с i I c Chem. 14, 717. (1977).
2. Авторское свидетельство СССР по заявке:9 32I3247/23-04, 1 кл. С 07 0 491/107, 27.05.
81.
Составитель Л. Никулина
Редактор И. Митровка Техред М.Гергель Корректор С. Шекмар .
Ю»ЮЮЮ»Ф
Тирад 416 Подписное йНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Йосква Ж-35, Раужкая наб., д..4/5
Филиал ППП Патент, r. Уигород, ул. Проектная, 4