Способ получения гликозидов антрациклина
Иллюстрации
Показать всеРеферат
СОЮЭ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИК
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
k ПАТЕНТУ сосн
ОН I II
El О 0Н Ос 3
0Н о .яс1 0) в о он
Со - 4
ОН
3 О ОН
0 3 3 ®О
СО
СР3
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР
ПО ДЕЛАМ ИЭОБРЕТЕНИЙ И ОТНРЫТЬ9,21) 2375576/23-04 (22) 30.06.76 (46) 23.04.83. Бюл. и 15 (72) Федерико Аркамоне, Луиджи Бернарди, Бьянка Пателли и Серджио Пенко (Италия) (71) Сочиета фармасьютичи Италиа (Италия) (53) 547.455.07(088.8) (56) 1.. Патент СССР N 645588, кл. С 07 H 15/24, 1975 (прототип). (54) (57) спосоБ получкния Гликозидов
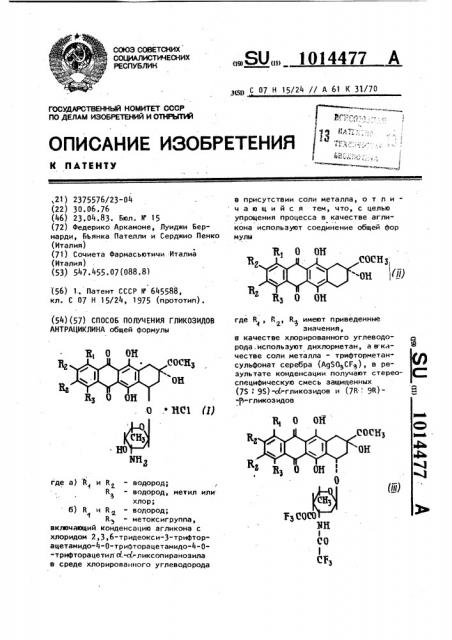
АНТРАЦИКЛИНА общей формулы где а) Ъ„и R - водород;
R - водород, метил или хлор; б) R u R - водород;
R> - метоксигруппа, включающий конденсацию агликона с хлоридом 2,3,6-тридеокси-3-трифторацетамидо-4-0-трифторацетамидо-4-0"
-трифторацетил с .-с ликсопиранозила в среде хлорированного углеводорода
„„SU„„1014477 А
g g С 07 H 15/24 // А 61 K 31/70 в присутствии соли металла, о т л ич а ю шийся тем, что, с целью упрощения процесса в качестве агликона используют соединение общей фор мулы а, о он
lAe R„, R, R имеют приведенные значения, а качестве хлорированного углеводорода. используют дихлорметан, а в-качестве соли металла - трифторметансульфонат серебра (AgSQCF>), в результате конденсации получают стерео- С специфическую смесь защищенных (7Б 9Б)-с(=гликозидов и (7R 9R)" "гликозидоо
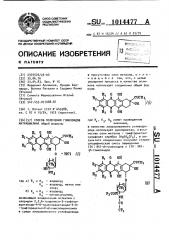
1014477 где R,,R u R имеют указанные значе2. ния, с последующими обработкой указанной . смеси метанолом при 45-55 С за 2535 мин для удаления защищающей 0-трифторацетильной группы в сахарной половине и разделением полученных соответствующих М -трифторацетильных про .изводных общих формул соса>
OH (ф) 3ЕС0СЕу
oeocg
Щ3 . к о он
a, o ок
om, оМ сосн оК
R) О 0Н
ЯН
COQFg
R1 0 0Н
R1 0 OK
Кг осн
0Н
Осн
OH!
0 ОК Ьн где а) R и R>R водород; водород, метил или хлор; водород; метоксигруппа. б) К„и "Я э
I,1 методом хроматографии на колонке си- ликагеля, применяя в качестве элюен:та внача.пе хлороформ, затем смесь хлороформа с ацетоном 95:5 по обьему)
;для получения (7S : 9S) M-гликозидов общей формулы (Ч), которые подвергают мяrкому щелочному гидролизу
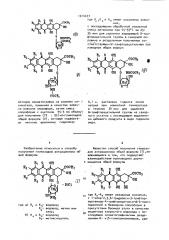
Изобретение относится к способу
I получения гликозидов антрациклина об. щей формулы о он )
Hei сц
НОЮ
О M o ънсост, - "
0,1 н. раствором гидрата окиси натрия при комнатной температуре в течение 30 мин для удаления
Й-трифторацетильной группы из сахарного остатка с последующим выделением целевого продукта в виде гидрохлорида.
Известен способ получения гликозидов антрациклина общей формулы (T),çà:. каючающийся в том, что подвергают взаимодействию производное дауно5 мицинона общей формулы где К!-R> имеют указанные значения, с 1-хлор-2,3,6-тридеокси-3-трифторацетамидо-4-трифторацетокси-с .-Ь-ликсо пиранозой в безводном хлороформе в присутствии бромида ртути в качестве акцептора хлористого водорода с последующим хроматографическим разделением о(- и -гликозиланомеров, уда3 1 014477 лением защитных трифторацетильных ( групп щелочным гидролизом и воделением целевого продукта в свободном виде или в виде хлоргидрата. Полученные соединения, имеющие атрациклиновую конфигурацию (75:9S) или (7R : 9В), являются смесью о -- и Р-аномеров 1 1 ).
Недостатком известного способа является сложность хроматографическо. го разделения,. Кроме тогоуне удает- 10 ся получить единичный чистый оптически-активный продукт..Полученные соединения являются смесью диастерео мерных. соединений.
Цель изобретения - упрощение про- 1З цесса и возможность получения глюкозидных целевых продуктов, агликоны которых имеют (7S : 95) естественную. конфигурацию во время конденса- Я ции, с. применением рацемической сме- 20 си и без предварительного разложения на два энантиомерных агликона исход- R ной рацемической смеси.
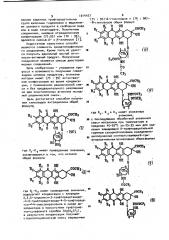
Цель достигается способом получения гликозидов антрациклина общей 2S .формулы
СО<>3
ОН
СН т сосо
СО
1 сг
R O 0H
СОСЫ3
ОМ
meocm осое8, Н3
° ° где R<, R и R> имеют укаэанные значения, 30. с последующими обработкой указанной смеси метанолом при температуре.в пределах 45-55 C за- 25-35 мин для удаления защищающей 0-трифторацетильной группыв сахарнойполовине иразделени.3% емполученных соответствующихй-трифторацетильныхпроиэводных общихформул R О ОН
Е1 0 ОИ
ИС1
coca>„
ы @
ИН
COCA .
В
R О Om
СОСИ, ОК
Ф где R„ -R> имеют приведенные значения, заключающимся в том, что агликон 40 общей формулы где R "R3 имеют приведенные значения, 50 подвергают конденсации с хлоридом
2,3,6-тридеокси-3-трифторацетамидо-4-0-трифторацетамидо-4-0-трифторацетил1 4-ликсопиранозила в среде дихлорметана в присутствии трифторметан-сульфоната серебра (AgSQCFg), в результате конденсации получают стереоспецифическую смесь защищенных
7S: 9 ) -гликозидов и (7R: 9R)5-гликоэидов общих формул в о он
5 10144 методом хроматографии на колонке силикагеля, применяя в качестве элюента вначале хлороформ, затем смесь хлороформа с ацетоном (95:5 по объему) с целью получения (7S : 9S) M-гликози-g
:дов общей формулы (Н),которые подвергают мягкому щелочному гидролизу 0,1 н. раствором гидрата окиси .натрия при комнатной температуре в течение 30 мин для удаления N-трифторацетильной груп- 1Ф пы из сахарного остатка, с последующим выделением целевого продукта в виде гидрохлорида.
Применение трифторметан-сульфоната серебра позволяет обеспечить четко И выраженное разделение окончательных гликозидов, чьи агликоны обладают или (7S : 9S) естественной конфигурацией или (7R : 9Р) неестественной конфи гурацией (соединение (И1 и (П ) ). щ
Данную смесь обрабатывают метанолом в указанных температурном и временном интервалах с последующим разделением полученных соответствующих
Н-трифторацетиянных производных общих формул (V) и (Ч!! методом хроматографии на колонне силикагеля, применяя в качестве элюента вначале хлороформ, затем смесь хлороформа с ацетоном (95:5 по объему) с целью получения (7S : 95)-Ы.-гликозидов общей формулы (Ч1, которые подвергают мягкому щелочному гидролизу 0,1 н. раствором гидрата окиси натрия при комнатной температуре в течение 30 мин.
Пример 1. 4-ДеметоксидауноИ мицин (R, = R = R> = Н) .
77 6 гелевой колонке, элюируя вначале хло роформом, а. затем смесью хлороформа и ацетона 95:5 по объему).
Из первого элюата при кристаллизации из хлороформа получают 0,7 г ф-й-трифторацетил-4-деметоксидауномицина формулы (V) (Ri = Ra = Ry = H); т.пл. 155-158 С; Гоф +196 С =
0,1, диоксан).
;.1атем элюируют. -й-трифторацетил-4-деметокси -7,9-бис-эпидауномицин, который кристаллизуют из смеси тетрагидрофурана и диэтилового эфира.
Получают 0,65 r d.-Ì-трифторацетил-4-деметоксидауномицина, т.пл. 165167 С; (с = -270 (С = 0,1, диоксан)
Полученное вещество формулы (V) раст- воряют в 40 мл 0,1 н. раствора гидроокиси натрия и выдерживают 30 мин при комнатной температуре. При добавлении соляной кислоты устанавливают рН 8 и раствор экстрагируют хлороформом. Остаток, полученный при выпаривании растворителя, перечосят в небольшое количество смеси хлороформа и метанола. К этому раствору добавляют метанольный 0,1 н. раствор
HCl до рН 4,5, а затем диэтиловый эфир в количестве, достаточном для осаждения 0,35 г хлоргидрида 4-деметоксидауномицина, т.пл. 183-185 С; о ай = +210 С =0,1; метанол); выход 253 (на исходный агликон) .
Пример 2. 4-Деметокси-2,3-дииетилдауномицин (6„ = R = Н;
Cfb) .
Способом, описанным в примере 1, но при"применении рацемического
%-деметокси-2,3-диметилдауномицинона формулы{II) (R, = R> = Н; и = СН ) получают о(.-й-трифторацетил-4-деметокси-2,3-диметилдауномицин формулы(И (В.! = R = — Н; R= СНз); т.пл . 233235 С; Д = 180 (С = 0,1; диоксан) и P -N-трифтора цетил-4-деметокси-2,3-диметил-7,9-бис-эпидауномицин Формулы (Vl)(R@ = R H; Rg=. СН ).
К суспензии 1 г рацемического 4-деметоксидауномицина формулы II (R
= R = R > = Н) и 1,2 г хлорида 2,3,6- ао
-тридеокси-3-трифторацетамид-4-0-трифторацетилЫ-Ь -ликсопиранозила в 150 мл дихлорметана в течение 10 мин в темноте при перемешивании и комнатной температуре добавляют l r трифторметансульфоната серебра, растворенного в 20 мл диэтилового эфира. Че" рез 20 мин при еремешивании добавляют избыток насыщенного раствора бикарбоната натрия. Органический слой е отделяют и концентрируют в вакууме.
Остаток переносят в метанол и нагревают 30 мин при 50 С. После выпаривания растворителя получают остаток, который переносят в хлороформ и промывают насыщенным раствором бикарбоната натрия. При выпаривании раст-. ворителя получают остаток, который хроматографируют на короткой силикаСпособом, описанным в примере 1, применяя 4-"N-трифторацетил-4-деметокси-2,3-диметилдауномицин, полученный, как описано в примере 2, получают хлоргидрат 4-деметокси-2,3-диметилдауномицина; т.пл. 190-1920С;
foQ = 180 (С = 0,1; метанол); выход 253 (на исходный агликон).
П р и М е р 3. 4-Деметокси-2,3дихт!ордауномицин (К =.R = Н;
В -С!), 1014477
Способом, описанным в примере 1, применяя рацемический 4-деметокси -2,3-дихлордауномицинон формулы (ll) (R< = Р = Н; R = С1), получают с =.й-трифторацетил-4-деметокси-2,3-ди хлордауномицин формулы (V) (R, =
Rq = Н; R ð = Cl); т.пл. 238-240 С;
ИЯ =+175 С = 0,1; СНС1 и
Р-1)-трифторацетил-4-деметокси-2,3-дихлор-7,9-бис-эпидауномицин фор::мулы (Ч ) (Rq R Н; Rq = Cl).
Способом, описанным в примере 1, но применяяо(-М-трифторацетил-4. -деметокси-2,3-дихлордауномицин, по. лучают хлоргидрат 5,4-деметокси-2,3-дихлордауномицина;(цД = +180 о о (С = 0,1; метанол), выход 204 (на исходный агликон) 8
Пример 4. Дауномицин формулы <Ч1 (В = R<= Н; R -- OCH ).
Способом, описанным в примере 1, но применяя рацемический дауномицинон формулы(II) (Р1 — Рю2 = H;
Q, = ОСН ), получает К.-К-трифторацетилдауномицин формулы
= Q.а = Н; Ry = OCHg); т.пл. 169l71 C. сЦ +220 î 1,С = 0,1; дищ оксан) и A --M-трифторацетил-7,9-бисэпидау номи цин формулы (V1) (g „= R H, К,1 ОСН ) .
Способом, описанным в примере 1,, но применяя cL44-трифторацетилдауно1 мицин, получают хлоргидрат дауномицина, т.пл. 188-189 C;tat)g = 240 (С = 0,1; метанол); выход 253 (на исходный агликон).
Корректор А, Дзятко
Подписное
Составитель Г. Коннова
Редактор: Гд Безвершенко ТехредТ фанта
Заказ 3045/68 Тираж 365
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
11303> Москва )it-35 Раушская наб. д. 4/>
Филиал nllll "Патент", г. Ужгород, ул. Проектная,