Способ получения цефалоспоринов или их солей и его вариант
Иллюстрации
Показать всеРеферат
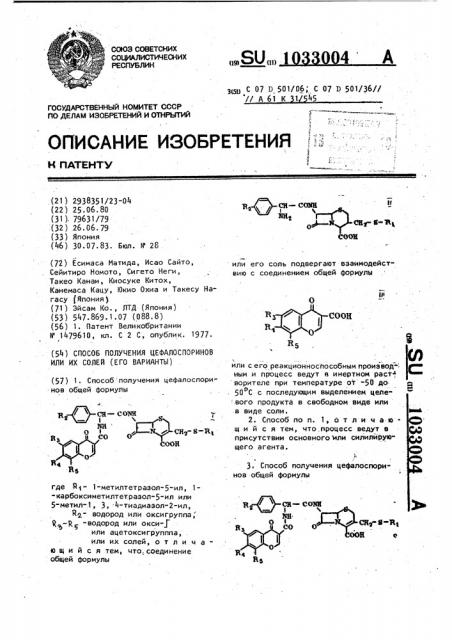
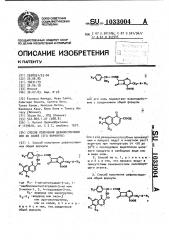
1. Способ получения цефалоспори ИОВ общей формулы CHj-S-Ri ООН где RI- 1-метилтетразол-5-ил, 1-карбоксиметилтетразол-5-ил или 5-метил-1, 3, -тиадиазол-2-ил, RQ.- водород или оксигруппа, ,-R -водород или окси- Г или ацетоксигрупппа, или их солей, отличающийся тем, что.соединение общей формулы СН-COOTУ 1Ш{ ,J-IiL CHr-«-B| соон или его соль подвергают взаимодействию с соединением общей формулы III СООН (Л или с его реакционноспособным производным и процесс ведут в инертном pact- ворителе при температуре от -50 до 50с с последующим выделением цепе вого продукта в свободном виде или в виде соли. 2. Способ по п. 1, 6 т ли ч ающ и и с я тем, что,процесс ведут в 00 ОО присутствии основного ли силилйрующего агента. . , 3. Способ получения цефалоспоринов общей формулы
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИ.Х
РЕСПУБЛИК, SU() ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ПАТЕНТУ (21) 2938351/23-04 (22) 25.06.80 (31). 79631/79 (32) .26.06.79 (33) Япония (46) 30 ° 07.83. Бюл. и 28 пг X ) СИ- СО 1 1
ЗК о
СООИ
СООК
СН- СО1 Н
СН; S-R, Н
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (72} Есимаса Матида, Исао Сайто, Сейитиро Номото, Сигето Неги, Такео Канаи, Киосуке Китах, Канемаса Кацу, Юкио Охиа и Такесу Нагасу (Япония 3 (7l ) Эйсам Ко., ЛТД (Япония) (53) 547.869.1°, 07 (088.8) (56) 1 ° Патент Великобритании
И 1479610, кп. С 2 С, опублик. 1977. (54) СПОСОБ ПОЛУЧЕНИЯ ЦЕФАЛОСПОРИНОВ
ИЛИ ИХ СОЛЕЙ (ЕГО ВАРИАНТЫ} (57) 1. Способ получения цефалоспоринов общей формулы где Й - 1-метилтетразол-5-ил, 1"карбоксиметилтетразол-5-ил или
5-метил-1, 3, 4-тиадиазол-2-ил, Rg - водород или оксигруппа, Я -р, -водород или окси-j или ацетоксигрупппа, или их солей, о т л и ч ае шийся тем, что,,соединение общей формулы ш С 07 D 50l/06; С 07 В 501/36// // А61 К 1 45 или его соль подвергают взаимодейст" вию с соединением общей формулы 5
3 или с его реакционноспособным производ": ф цым и процесс ведут в инертном раст", ворителе при температуре от -50 до.
50 С с последующим выделением целе:.вого продукта в свободном виде или в виде соли, Миий
2. Способ по и. 1, о т л и ч а а . шийся тем, что,процесс ведут в фф присутствии основного или силилирую" щего агента.
И
3. Способ получения цефалоспоринов-общей формулы р, )-gg- erne
О, Сйз 9 ВФ
H e
1033004 или его реакционноспособное производ-" ное подвергают взаимодействию с соединением общей формулы
ВООК
Изобретение относится к способу получения новых цефалоспоринов или их солей и к его варианту, которые обладают антимикробной активностью и могут найти применение в качестве 5 лекарственных средств в медицине.
Известен способ получения биоло" гически активных производных 7- о(-ами" но-сЯй -оксифенил -ацетамидо -3-алканоилоксиметил-3-цефем-Й-карбоновой 10 кислоты ацилированием 7-амино-3-алка ноилоксиметил-3-цефем-4-карбоновой кислоты реакционноспособным производным соответствующей С -амина-И-оксифенилуксусной кислоты. (1) .
Цель изобретения - получение новых антибиотиков цефалоспориновогo ряда, расширяющих арсенал средств воздействия на живой организм.
Поставленная цель достигается 2О способом получения цефалоспоринов общей формулы
СООН
14 ся- сощ
/ 1
25 В или с его Реакционноспособным производным, и:процесс ведут в инертном растворителе при температуре от -50 до
50 С, с последующим выделение целевоЗО го продукта в свободном виде или в виде соли.
Ин
СО О
СНр- 8-Я
СООК ! где Р,.1 — 1-метилтетразол-5-ил, 1-карбоксиметилтетразол-5-ил или 5-метил-1, 3, ч-тиадиазол-2"ил, IRAN - водород или оксигруппа; водород или окси- или ацеЬ токсигруппа, или их солей, о т л и ч а ю щ и и " с я тем, что соединение общей формулы или с его солью и процесс ведут в инертном растворителе при температуре от 30 - 90 С с последующим выделением целевого продукта в свободном виде или в виде соли. ц. Способ по и. 3 отличаюшийся тем. что процесс ведут в присутствии основного или силилирующего агента. где P - 1-метилтетразол-5-ил, 1карбоксиметилтетраэол"5-ил или 5"
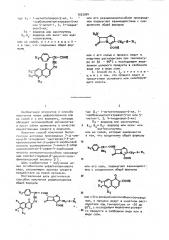
-метил"1 3, 4-тиадиаэол-2-ил, Рд - водород или оксигруппа, 9,g 4и Rg водород или окси- или ацетокси группа, или их солей, который заключается . в том, что соединение общей формулы „Д., . - C95E
QR -1
О
ЩОК или его соль, подвергают взаимодействию с соединением общей формулы
33004 4
3 10
Процесс предпочтительно ведут 8 присутствии основного или силилирующего агента.
Поставленная цель достигается с. также способом получения цефалоспоринов общей формулы или их солей, который заключается в том,,что соединение общей формулы.
И или его реакционноспособное пройзводное, подвергают взаимодействию с соединением общей формулы
О
С 2
ОООН или с его солью, и процесс ведут в инертном растворителе при температуре от 30 до 90 С, с последующим выделением целевого продукта в свободном виде или в виде соли.
Процесс предпочтительно ведут в присутствии основного или силилирующего агента °
В качестве солей получают соли по карбоксигруппе, такие, как натриевая, калиевая или кальциевая, соль дициклогексиламина или прокаина
/ или другая соль, а в случае, когда
Q - оксигруппа, может образоваться соль, например натриевая, и по этой, группе.
Характерными представителями инерт ных растворителей в обоих способах является ацетон, тетрагидрофуран, диметилацетамид, диметилформамид, диоксан, дихлорметан, хлроформ, бензол, толуол, этилацетат или их смеси.
Представителями основных реагентов являются гидроокиси щелочных металлов, как, например, гидроокись натрия или гидроокись калия, кислые карбонаты щелочных металлов, такие как двууглекислый натрий, амины, например, триэтиламин, пиридин, диметиланилин или Й-метилморфолин.
Примерами силилирующих реагентов являются Я,O"бис (триметилсилил) 5
10 !
45 ацетамид, гексаметилдисилазан или
М-триметилсилилацетамид.
Соединения общей формулы 1 проявля" ют высокую противомикробную активность являются эффективными не только против грамположительных бактерий, но также и против грамотрицательных бактерий. В частности соединения отличаются тем, что они обладают эффективностью против таких бактерий как Psendomonas aeruginosa, Serrhtia тпагсевеens, Proteus morganii и т.n., которые вызывают трудноизлечимые инфекции.
Соединения проявляют низкую токсичность при испытании. Например, величины острой токсичности (одля следующих соединений были выше 5 r/êã, натриевая соль 7Pr- 3-2-(6, 7-диоксихромон-3-карбоксамидо) -2гфенилацета мидо/-3-/ 1-метилтетразол-5-ил)-тиометил/-3-цефем-4-карбоновой кислоты, натриевая соль 7 ./3-2-(6, 7"диокси хромон-3-карбоксамидо)-2-(4-оксифен л) ацетамидо/ 3-/(5-метил- 1, 3, 4-тиадиазол-2-.ил)тиометил/-3-цефем-4- ° карбоновой кислоты,и натриевая соль
7Р-/З-2-(6, 7-диацетоксихромон-3карбоксамидо)-2-фенилацетамидо/"3- / (,1-метилтетразол-5-ил тиометил/-3-цефем-4-карбоновой кислоты.
Пример 1 . 7P"/3-2-(6, 7-Диоксихромон-3-карбосамидо)-2-фенилацетамидо/-3-/(1-метилтетразол-5-ил) тиометил/-3-цефем-4-карбоновой кислоты и ее натриевая соль. а) 6, 7-Диоксихромон-3-карбонилхлорид.
Смесь 6, 7-диоксихромон-3-карбоновой кислоты (888 мг, 4 ммоль) и тионилхлорида (25 мл) кипятят с обратным холодильником в течение 1 ч и выпаривают хлористый тионил. После добавления бензола. смесь снова выпаривают досуха, и остаток растирают в порошок с дихлорметаном, получая
° целевое соединение в количестве, 719 мг.
Инфракрасный спектр поглощения (ИК, см ", масло нуйоль): 1780, 1765, 1645, 1625. б) 7 -ф-2-(6, 7-Диоксихромом-3карбосамидо)- 2-фенилацетамидо/-3-/ (1-метилтетразол-5-ил -тиометил/-3-цефем-4-карбоновой кислоты.
N,0-Бис(триметилсилил}ацетамид (420 мкл)добавля дт к перемешиваемой суспензии 7/i.(З -2-амино-2-фенилаце033004 6
Элементный анализ для
С 9 Н К ИаО Я
55 Вычислено,3: С 49,49, N 3,15
Н 9,95
Найдено,3: С 47,11; Н 3,61;
Н 8,80.
5 1 тамидо) -3- (1-метилтетразол-5-ил)тис " метил/-3-цефем-4-карбоновой кислоты (146 м -, 0,316 ммоль/ в зтилацетате (.5,5 мл/ при 0 С, и смесь перемешивают в течение 20 мин . После добавления хлорангидрида.кислоты,, (67,3 мг, 0,283 ммоль), описанного в а/, смесь перемешивают в течение
4 ч при комнатной температуре. Реакционную смесь разбавляют этилацетатом 1,150 мл), промывают водой и затем насыщенным солевым раствором, высушивают сульфатом магния и удаляют растворитель. При растирании остатка с этилацетатом получают целевой продукт (88 мг, 443). Температура плавления 225-245 С (разложение), Элементарный анализ для
С2В % Ь" Ъ=
Вычислеíî,l: С 50,52, Н 3,48;
14„73, Найдено,3: С 47,54, H 3,37, и -12,,0.
ИК (см, нуйол): 1780, 1710, 1665, 1630. Спектр ЯИР (ф, ДИСО- 6): 3,52 (1Н, дуплет,.l - 17» Гц) 3 70 (1Н„,д; 1 = 17 Гц), 3,94 (3H, синглет), 4,20. (1Н, д. I = 13 Гц), 4,. 37 (1Н, д, I = 13 Гц), 5,02 (1H, .д, = 5 Гц), 5,74 (1Н, д„1= 8и. .5 Гц), 5,84 (1Н, д, Р 8 Гц), 7,;00 (1H, с ), 7,2-7,7 (5H, мультиплет), 7,44 (1Н, с), 8 87 (1H, c), 9,52 (1Н, д, т = 8 Гц), 10,40 (1Н, д,3=
=8 Гц), в Натриевая соль описанного в б соединения.
Описанное в б соединение (55 мг, 0,083 ммоль) растворяют в смеси 2 мл ацетона и 1 мл диметиформамида, к которой добавляют 0,5 И раствор натрий-2-этилгексаноата в этилацетате
{ О, 16 мл ) и затем 10 мл смеси этил" ацетата с этиловым эфиром (1:1) . Осадок собирают фильтрацией, промывают смесью этилацетата и этилового эфира (1: 1 ) и высушивают, получая 53 мг целевого соединения (94 ). Темпера" тура плавления около 230С С (разложение).
Злементный анализ для 2gHgq Ь1.тМаО Б, Вычислено,l: С 48,90, Н 3,22
14,26.
Найдено,> С 44 45; Н 3 35
12.60, Ик (см, нуйол): 1765, 1660, -1
1610. ЯИР- спе ктр (Д", ДМСО- 4g) 3,30
50 (1Н, д, Э = 18 Гц), 3 43 (1H, д,:) =
18 Гц), 3,90 (Зн, с), 4,19 (1Н, д, Д = 12 Гц) „4,40 (1H, д,. Э = 12 Гц), 4,88 (1Н, д, 1= 5 Гц), 5,56 (1H, д,,д = 8 Гц, 5 гц),.5,83 (1H. д, g = 8 Гц), 6,88 (1H, c), 7.32 (1Н, с), 9,40 (1Н, д, Э 8 Гц), 10,48 (1Й, д, V=8r ), Пример 2, 7p-й-2-(6, 7-Диоксихромон-3-карбоксамидо)-2-фенил-ацетамидо/-3-/ 5-метил- 1, 3, 4-тиадиазолил-2 тиометил/-3-цефем-4-карбоновой кислоты и ее натриевая соль, а) 7P/3-2-(6, 7.-Диоксихромон-3.-карбоксамидо)-2-фенилацетамидо/-3-) (5-метил-1, 3, 4-тиадиазол/ -2-ил/тиометил/-3-цефем-4-карбоновая кислота.
Согласно способу по примеру 1 К
7Р-(D-2-амино-2-фенилацетамидо)-3-/(5-метил-1, 3, 4-тиадиазол-2-ил ) тиометил/-3-цефем-4-карбоновую кислоту (266 мг, 0,557 ммоль) обрабатывают хлорангидридом кислоты (120 мг.
О, 5 ммол ь (по примеру 1), полу чают
65 мг целевого соединения (44"..).
Температура плавления 215-235 С (разложение) .
Элементный анализ для
Qg Н а> и q 0 y
Вычислено,/: С 51,09," Н 3,40, 11 10, 27
Найдено,З: С 49,14, Н 3,14; и 8ю54
ИК-спектр (см"., нуйол): 1780, 1725, 1660, 16 10- 1630. ЯИР-спектр д,Г, ДИСО-dq); (д, ДИСО" Ctg): 2,69 (3Н, с), 3,48 (lн, д 1 = 18 Гц, 3,71 (1Н, д,q =
18 "ц) э 4ф,17 (1Н,д, Z = 13 Гц), 4,52 (1Н, дт I = 13Гц) 5,04 (1Н, д, Т=
= 5Гц) 5 79 (1Н, д, X = 8 и 5Гц), 5,85 (1Н, д, I = 8Гц), 7,ОО (1Н, с), 7,2-7,6 (бн,м), 7,44 (1Н, с), 8,88 (1H c), 9,52(1H, д, I = 8Гц), 10,40 (1Н, д, T = 8Гц ) . б) Натриевая соль соединения, описанного в а) согласно способу по при-. меру 1, из соединения по примеру в количестве 42 мг, 0,0616 ммоль получают целевое соединение (43 мг, 99 ), Температура плавления около
250 С (разложение).
1033
ИК-спектр (см ", нуйол ): 1760, 1660, 1610.
ЯИР-спектр. (д, ДИИСО-Дб): 2,65 (ЗН с), 3,27 (1Н, д, I = 18 Гц), 3,53 {1H, д, I = 18 Гц), 4,30 (1H д, Х = 12 Гц), 4,50 (1Н, д, Е =, 12 Гц), 4,89 (1Н, д, I = 5 Гц), 5,56 (1Н, д, I = 8 и 5Гц, 5,84 (1Н, д, I = 8 Гц, 6,83 (1H, с), 7,30 (1Н, с), 7,2-7,6 (5Н и ), 8,76 (1Н, с), 10
9,40 (lH, д, I. = 8 Гц), 10,51 (1H, д, I =8 Гц).
П р и м e p 3 . 7 -й-2-(б, 7 Диоксихромон- 3- карбоксамидо) -2- (4- оксифенилацетамидо/-3 -/(1-метилтетразол- >5
- 5-ил тиометил/-3-цефем-4-карбоновая кислота и ее натриевая соль. а) 7Р-fg 2-(6, 7-Диоксихромон-3"карбоксамидо)-2-(4-оксифенил)ацетамидо/ 3-/ 1""метилтетразол-5-ил)тиоме- щ тил/"3-цефем-4/карбоновая кислота.
М,О-Бис(триметилсилил) ацетамид (455 мкл) добавляют к перемешиваемой суспензии 7Р-/3-амино-2-(4-оксифенил-ацетамидо/=3-/(1-метилтетразол-5-ил) 25 тиометил/-3-цефем-4-карбоновой кисло-. ты (140 мг, 0,293 ммоль в этилацета о те (6 мл)при 0 С и продолжают перемешивание в течение 20 мин при 0 С.
После доба влейия 67, 3 . мг (О, 263 ммол ь) 30 хлорангидрида кислоты по примеру 1 смесь перемешивают в течение 2 ч при
0 С. Реакционную смесь разбавляют
150 мл этилацетата, промывают последовательно 0,5 н раствором соляной кислоты (2 раза по 20 мл), водой 35 (4 20 мл) и насыщенным раствором соли (2 20 мл ), сушат сульфатом магния и . выпаривают растворитель. К остатку добавляют ацетон и смесь выдерживают
4Р
40 в течение ночи. Растворитель удаляю:, и остаток растирают в порошок с этиловым эфиром, получая 123 мг целевого соединения (69 ). Температура плавления около 195220О С (разложение) .
Элементный анализ для
С Н2 М„0 0 2
Вычислено, : С 49,33 Н 3, 40;
14,39.
Найдено,3: С 48,41, Н 4,11, 50
12 37
ИК-спектр f,ñì ., нуйал): 1780, 1725, 1660,1610.
Спектр ЯИР (О, ДМСО- 4g): 3,62 55 (2Н, шир.сигнал), 3,93 -(ЗН, с), 4,21 (1Н, д, I = 14 Гц), 4,37 {1Н, д, I =
=14 Гц), 5,02 (1Н, д, I=5 Гц) 004 8 р,64-5,84 (2Н,м ), 6,73 (2Н, д, Х == 8,5 Гц), 6,99 (lH, c), 7,25 (2Н, д, I = 8,5 Гц), 7,43 (1H, с),. 8,86 (1Н, с),937 {1Н, д, Т=8Гц), 9,43 (1Н, шир. с ), 10,1 (1Н, шир. ), 10,25 (1Н, д, I = 8 Гц), 10,7 (1H, шир. ) . б Натриевая соль соединения, описанного в а
Соединение (70 мг, 0,103 ммоль), описанное в а растворяют в смеси аце) тона (3 мл/ и диметилформамида (2 мл).
К этому раствору добавляют 0,5 И раствор натрий-2-этил-гексансата в этилацетате (0,21 мл) и затем смесь этилацетата и этилового эфира (1: 1, 10 мл ). Осадок собирают фильтрацией, промывают .смесью этилацетата и эфира (1:1) и сушат, получая 57 мг целевого соединения (793). Температура плавления 200 С (разложение ).
Элементный анализ для (2 Н2 й- йа0 о а
Вычислено,k: С 47,79, H 3,15> N13,94.
Найдено,З: С 44,52; Н 3,60; М12,62.
ИК-спектр (см, нуйол : 1760, 1660, 1605.
ЯИР-спектр (д, ДИСО- 86: 3,34 (1H, д, I = 18 Гц), 3 57 (1Н. д, = 18 Гц), 3,92 (ЗН, c), 4,23 (1H, д, I = 12 Гц), -4,42 {1H, д, I = 12 Гц), 4,91 (1H, д, I = 5 Гц), 5,59 (1H, дд, Т = 8 и 5 Гц), 5 72 (1H, д, I =
= 8 Гц), 6,73 (2Н, д, I = 8,5 Гц), 6,97 (1Н, с), 7,26 (2H, д, = 8 5 Гц), 7 36 (1Н с) 8 80 (1Н с) 9,32 (1H, д, I = 8 Гц), 10,36 (1Н, д,. = 8 Гц).
P "™ å P " ° 7 -/З-2-(6, 7-Диоксихромон-3 -карбоксамидо -2-(ч-оксифенил) ацетамидо/-3-/ 5-метил-1, 3, 4-ти адиазол-2-ил) тиометил/-3-цефем-4-карбоновая кислоты и ее натриевая соль. а) 7 -/Э-2-(6, 7-Диоксихромон 3
-карбоксамидо -2-(4 оксифенил) ацетамидо/-3-/ 5-метил-1, 3, 4-тиадиазол-2-ил)тиометил/-3-цефем-4-карбонова4 кислота.
Согласно способу, описанному в примере 1, 7 -/Э-2-амино-2- 4-окси- фснил)ацетамидо/-3-/ 5-метил-1, 3, 4-тиадиазол-2-ил)тиометил/-3-цефем-4-карбонову кислоту 274 мг, 0,555 ммоль) обрабатывают хлорангидридом кислоты (120 мг, 0,5 ммоль), опН» санным в примере 1, получая целевое
10330Р4 10,: мида кипятят.с обратным холодильнило- ком в течение 1. ч и охлаждают до комнатной температуры. После добавления
w-гексана (300 мл) образовавшийся .. осадок собирают получая целевое соединение (17,6 г .
ИК-спектр (см ", нуйол : 1780, 1755, 1660, 1625. б) 7 -/D-2-" 6, 7-Диацетоксихромон,1О -3-карбоксамидо)-2-фенилацетамидо/-3(1-метилтетразол-5-ил)тиометил/-3-цефем-4-карбоновая кислота.
К перемешиваемой.суспензии 7 - Э-2-амино-2-фенилацетамидо -,3-/ 1-метил1 тетразол-5-ил)тиометил/-3-цефем-4-карбоновой кислоты (516 мг, 1,12 ммоль) в 5 мл этилацетата при
0 С по каплям добавляют 5 мл 1 М раствора Й, 0-бис (триметилсилил) ацетамид в дихломертане. Раствор перемешио вают в течение 20 мин при 0 С и к нему добавляют хлорвнгидрид кислоты (325 мг, 1 ммоль), описанный в g), в дихлорметане (5 мл/. После перемед5 шивания в течение 4 ч при 0 С смесь разбавляют этилацетатом (300 мл), промывают 20 мл воды, 0,5 н раствором соляной кислоты (2 раза по
20 л»л) водой (2 20 мл ) и насыщенным соленым раствором (2 20 мл), высушивают сульфатом магния и выпаривают растворитель. Остаток растирают в порошок с этиловым эфиром, получая целевое соединение (575 мг, 77ь).
Температура плавления около 200440 С (разложение) .
Элементный анализ для
С, Н ., И, 0„„&z
Вычислено,З: С 51,26, H 3,63, .
Я 13,08.
Найдено,z: Г 50 99, H 3 83, М 12,g5.
ИК-спектр (см ", .нуйол : 1780, 1760, .1662,1615.
ЯМР-спектр (d×, ДМСО- dg): 2,35 (3H, с), 2,37(ЗН» с), 3,53 (1Н,д
I = 18 Гц), 3»71 (1Н, д, .I =
= 18 Гц), 3,94 (ÇH, с), .4,22 (1Н, д., I =13,9Гц), 4,37 (1Н, д, I =
= 13 Гц)» .5,03 (1Н, д, I = 5 Гц), 5,77 {1Н, д, 8 Гц. и 5 Гц), 5,84 (1Н, д.. I = 8 Гц), 7,2-7,6 (5Н,м ), 7,88 (1Н, с), 8,08 (1Н, с), 9,04 (1Н, с), 9»76 (1Н, g, I = 8 ГЦ ), 10,13 (1Н, ый анализ для
:..-,--,,Р,.,- i I:, О о 3+
В.-..:-.и(. i,e-...î„б: С 49,92, Н 3,32, М—
10,044. л-,-I tË I -- l-) ;- I,7 35 Н 2 g8 (Q " / о „ - : .
НК-спектр (,см ", нуйол): 1775, 1730, 1710. 1660 1615.
ЯМР-спектр (б, ДМСО-с)ь): 2,70 (3HI с 3,49 (1Н» д» I 18 Гц}
3,7 (1Н» д, I =.18 Гц), 4,.19 (1Й, -3 I LI ), 4, 51 (1H д
Гц ... 5-.,о4 (1н, д, I = 5 Гц), 7,00 (1Н„с), 7,26 (2Н, — Гц), 7,43 (1H, с), 8,87 (1Н; ...,, -"...,38 (1Н, д, I = 8 Гц), б) I- -;р еная соль соединения, опи" санного н а, В соатнетстнии со способом, описанным н примере 16, целевое сое динение 114 мг, 100ф попучают из сонr."..lñ>:öë (110 мг, 0.158 ммоль), олина-: †:cão н ч . Температура плавления около 230 С (разложение). л-ементный анализ для
CA>H2g!1r> л1ОО
Вычислено,i: С 48,3g, Н 3,08,"Я
9,,73, Найдено,3: С 45,59, Н 3,II5, Н о 48
I.!(-c..пек тр см нуйол ): 1 765
1660., 161 5 р)МР" спектр (, 6, ДМСО -дь ): 2,65 (3H, c), 3,30 (1H. д, I = 18 Гц), 3,55 (," Н, д. I = 18 Гц), 4,30 (1H, 12 Гц),,90 (-::.H,ä . I =; Гц), 5,5á (1Н, д, 1 =. 8 Гц и 5 Гц), 5,61 (1H, д, Т = 8 Гц), 671 (2Н, д„т д) I = ",5 Гц), 7,31 (1Н» с), 8„75 (1Н, ) o.,28 (IН, д„1 1=. 8 Гц), 10,35 (1н, д, 1"= 8 Гц), П р и и е р 5. 7P-/D-,2- (6, 7-Диацетоксихромон-3- карбоксамидо) ""2-фенилацетамидо/-3-/ (1-л»етилтетразол-5-ил} тиометил 7-3-цефем-4-карбоновая кислота и ее натриевая соль. а) 6, 7-Диацетоксихромон-3-карбони.пхлорид.
Смесь 6, 7-диацетоксихромон-3-кар боновой кислоты (18,4 г, 60 ммоль), бензола (450 мл), хлористого тионила .8,6 г, 72 ммоль) и 3 мл диметилфор9 сое ll::. : е (143 „мг, 41/ . Темпера-у:,=-,-:.е-:. .ния около 228-260 С (раз
А» 1 = 8 Гц) ° в) Натриевая соль соединения
Согласно Способу, описанному в примере 1 8, целевое соединение оо! 12
5,77 (1H, ñ), I = 51u. ), 5,88 (lH, ф, I = 8Гц ), 7,2-7,6 (5H, м), 7,89 (1H, с), 9,05 (1Н, с}, 9,55 (1H, Q, I =
= 8 Гц ), 10 13 (1Н, У, т = 8 Гц ). б } Натриевая соль соединения, описанного в С!..
Соединение { 208 мг, 0,272 ммоль), описанное eO}, растворяют в смеси ацетона (3 мл) и этилацетата (3 мл).
К этому раствору добавляют 0,55 мл
0,5 М раствора натрий-2-этилгексаноата в этилацетате и затем смесь. этилацетата и этилового эфира (1 1; 10 мл.) . Осадок собирают, промывают смесью этилацетата и этилового эфира(1:1) и высушивают, получая целевое соединение (168., мг, 783). Температу" . ра плавления 190 - 220 C { разложение);
Элементный анализ для
С Н, и йа О,Б
Вычислено,З: С 50,31; Н 3,38;
H 8,89.
Найдено,4: С 48,92, H 3,62, .М 8,68.
ЙК-спектр (см, нуйол: 1780, 1760, 1675, 1665 1600-1630.
ЯМР-спектр {О, ДМСО- д 6 2)34 (3H, с}, 2 35 (ÇH, с), 2 66 (ЗН, с), 3,26 (1H, д, I = 18 Гц), 3,52 (1Н, д, I = 18 Гц), 4,30 (lн, д, I
= 12 Гц), 4,50 (1H, д, I = 12 Гц), ",90 (lн, д I = 5 Гц}, 5,64 (1H, д, I=8и5Гц),587(1Н,д, I=
= 8 Гц), 7,2-7,56 (5Н, .м), 7,85 (1Н, c), 8,05 (1H, c), 9,01 (1Н, с), 9,43 (1й, p, I = 8 Гц), 10,10 (1H, p, I=
= 8 Гц)..11 1033 (355 мг, ббпр} получают из соединения (525 мг, 0,7 ммоль), описанного в О), Температура плавления около
205 С (разложение) .
Элементный анализ для 5
С Н2 М-! Йа Oq< ä
Вычислено,й: С 49,,80, Н 3,40; И
12,71 °
Найдено,Ф: С 46,27; Н 3,45, 1
ИК-спектр (см, нуйол): 1770, 1670, 1620.
Пример 6. 7 -Д)-2-{6,7-Диацетоксихромон -3-карбоксамидо}-2-Фенилацетамидо/-3-/ 5-метил-1, 3, 15
4-тиадиазол-2-ил} тиометил/-3-цефем-4-карбоновая кислота и ее натриевая соль. а} 7Р-Ю-2-(6, 7-Диацетоксихромон-, -3-карбоксамидо}-2-фенилацетамидо/- . 20
"3-/ 5-метил-1, 3, 4-тиадиазол-2-ил) тиометил/-3-цефем-4-карбоновая кислота.
К перемешиваемой суспензии 7 -Ъ2: -амино-2-фенилацетамидо -3-/ 5-метил- 25
3, 4-тиадиазол-2-ил)тиометил/-3-цефем-4-карбоновой кислоты (239 мг, 0,5 ммоль) в этилацетате (5,5 мл ) по каплям добавляют 2,5 мл 1 М раствора Я, 0-бис (триметилсилил)ацетами--3Q. да в дихлорметане. Раствор перемешивают в течение 20 мин при О С и к нему добавляют хлорангидрид кислоты .{243 мг, 0,75 MMQRb), описанный в примере 5-0. После перемешивания в течение 4 ч при, 0 С смесь разбавляют о
150.мл этилацетата, промывают 20 мл воды, 0,5 н. соляной кислотой { 2 раза по 20 мл), водой 2 20 мл) и насыщенным солевым раствором (2 20 мл) 40 растворитель высушивают сульфатом магния и выпаривают. Остаток растирают в порошок с эфиром, получая
253 мг целевого соединения { 66 ).
Температура плавления 166-178 С (разложение) .
Элементный анализ для
С»Н -, я О„,В
Вычислено,3: С 51,76, Н 3,55, и 9,1 5.
Йайдено, ь: С 50,34, H 3,40, и 7,75
ЙК-спектр (см ", нуйол): 1785, 1770, 1725, 1680, 1660, 1615.
ЯИР-.спектр (О, ДИСО- ДЬ}: 2,37 (бН, с ), 2,70 (ЗН, с ), 3,48 (1Н, ., I = 18 7U, ), 3,71 (lн, q, I = 18 Гц ),,17 (1H, Я, I =13 1ц ), 4,53 (1Н, (), Х =- 13 Tu, }, 5,04 (1Н, Я., I = 5 Гц ), I
Пример 7 . 7Р-/Э- 2-t6, 7-Ли" ацетоксихромон-3-карбоксами о) -2-(4-оксифенилацетамидо/-3-(1-метилтетразол=5-ил) тиометил/-3-цефем-4-карбоновая кислота и ее натриевая соль. а) 7Р-/Э-2-16, 7-Диацетоксихромон- .
-3" карбоксамидо) -2-{ 4-оксифенил) ацетамидо/-3-/(- 1 -метилтетразол"5-ил) тиометил/-3-цефем-4-карбоновая кислота.
Согласно способу, описанному в примере 3 g, 7/i./))-2-амино-2-{4-окси" фенил) ацетамидо/-3-/(1-метилтетразол-5-ил)тиометил/-3-цефем-4-карбоновую кислоту (140 мг, 0,293 ммоль ) обрабатывают хлорангидридом кислоты (85,2 мг, 0,263 ммоль), описанным в примере 5-ц, получая 184 мг целевого соединения (913). Температура
13 10 плавкам,. я приблизительно 215-240 С
f, PR3R0:"-, ЕНИЕ) .
Элемент>- ый анализ для
С 2 Н 2 О 1 2 2
Вычислено,1: С 50,19 Н 3 55 ц 12,81„
Найдено,Ф: С 49,92; Н 3,83, 11,88., ИК-сПектр (см-1, нуйол . 17601800, 1720, 1660-1680, 1615., ЯМР-спектр (сГ, ДМСО- (3g ): 2,34 (ЗН, c), 2,35 (ЗН, с), 3 60 (2Н, шир).
392 (ЗН, с ), 4,20 (1Н, д, I = 14 Гц), 4,36 (1H, д, I = 14 Гц), 5,02 (1Н, д, 1= Гц), 564584 (2Н, и), 6,73 (2Н., д, т = 8,5 Гц), 7,26 (2Н, д, Т =- 8,5 Гц), (,87 (1Н, с), 8,05 (1H с }, 9,03 (1H с ), 9,40 (1Н, д, = "- i ц}, 9,45 (1Н, шир. с), 9,99 (П., д, I = 8 Гц). б) Натриевая соль соединения, описанного в с1 .
В соответствии со способом, описанным в примере 3СТ, из 100 мг сое" динения (0,13 ммоль), описанного в и, получают 95 мг (923) целевого соединения. Температура плавления около 210 С (,разложение) .
Элементный анализ для
Съ Р26 1 1 11 12 2
Вычислено,/: С 48,79, Н 3 33
1?,45.
Найдено,3: С 47,15, Н 3,49, 1 11,89
ИК-спектр (см, нуйол): 1785, 1760, 1690, 1670, 1610.
ЯМР-спектр (д, ЛМСО- g: 2,35 (3H, c), 2,36 (ЗН, c), 3,31 (lH д
I = 18 Гц),. 3)55 (1H, д, X = 18 Гц), 3,91 (ЗН, с), 4,21 (1Н, д, I = (1ч д l- — 12 1 ц)
4,90 (1Н, д, I = 5 Гц), 5,57 (1Н, q, .I -= 8 5 Гц), 5,74 (1Й, д, I =
= 8 Гц), 6,73 (2EI, д, I = 8,5 Гц}, 7,26 (2Н, д, I = 8,5 Гц), 7,87 (1H, с), 8,06 (1П,с), 9,03 (1Н, с), 9,32 (1Н, д, I = 8 Гц, 9 98 (1Н, д, I
= 8 Гц).
П р и и е р 8 . 7 -/2-2-(6, 7-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо/-3-/(5-ме" тил-l, 3, 4-тиадиазол-2-ил)тиометил/
/-3-цефем-4-карбоновая кислота и ,ее натриевая соль. а) 7ф, -/D-2-(6, 7-Диацетоксихро- мон-3-карбоксамидо)-?-(4-оксифенил) ацетамидо/ -3-/(5-метил-l, 3, 4-тиадиазол-2-ил) тиометил/-3-цефем-4карбоновая кислота.
33004 14
0-Бис(триметилсилил)ацетамид
1 М раствор в дихлорметане, 2,5 мл) по каплям добавляют к перемешиваемой суспензии 7Р-/3-2-амино-2-(4-оксифенил)ацетамидо/-3-/(5"метил-l, 3, 4-тиадиазолил-2 тиометил/-3-цефем-4-карбоновой кислоты (247 Mr, 0,5 ммоль ) в этилацетате (8 мл ) при
0 С. Рас.твор перемешивают в ечение
О 20 мин при 0 С и к нему добавляют раствор хлорангидрида кислоты (243 мг, 0,75 ммоль, описанного в примере 6 Q . После перемешивания в течение 4 ч и и О C смесь разбавляют.
15 этилацетатом 150 мл), промывают водой (20 MR ) 0 5 н соляной кисло той (2 20 мл), водой (2i20 Mg) и насыщенным солевым раствором
20 мл 2, высушивают сульфатом маг20 ния и растворитель выпаривают. После добавления ацетона к остатку смесь выдерживают в течение 20 ч при комнатной температуре. После удаления ацетона остаток растирают в п рошок"с этиловым эфиром, получая
211 мг целевого соединения (54 .).
Температура плавления 190-205oC (разложение ) .
Элементный анализ для
93 2Л 0-»1 2. 3
Вычислено, r.: С 50,70, Н 3,48;Й
8,96
Найдено,4: С 50,84, Н 3,34; и
7,55.
ИК-спектр (см, нуйол : 1780, 35 1720, 1670, 1615.
ЯМР-спектр (д, ДМСО- Й ): 2,35 (ЗН, с), 2,37 (ÇH, с), 2,69 (ЗН, с), 3,48 (1Н, д, I = 18 Гц), 3,70 (1Н, д. I = 18 Гц) 4, 8 (IH, д. I =40 = 13 Гц), 4,28 (1H, д, I = 13 Гц), 5,03 (1Н, д, 1 = 5 Гц), 5 6-5,9 (2F., и), 6,73 (2H, д, I = 8,5 Гц),. 7,26 (2Н, д, I = 8,5 Гц), 7,87 (1Н, с), 8,06 (1Н, с), 9,03 (1Н, с), 9,40
4s (1H, д, I = 8 Гц), 9 99 (1H д. I=
= 8 Гц). б) натриевая соль соединения, описанного в a)
Согласно методике, описанной в примере 6 б, целевое соединение (140 мг, 88,) получают из соединения (155 мг, 0,198 ммоль), описанного в а. Температура плавления около 250 С (разложение .
Элементный анализ для
С Н 6 Н Я 042
Вычислено,4: С 49,31; Н 3,26; и 8,71.
10330
15 б 7p/Ц-2- (7, 8-диацетоксихро мон-3-карбоксамидо)-2-(фенилацетами- . до/-3-/(5-метил-1, 3, 4-тиадиазолил-.
-2)тиометил/-3-цефем-4-карбоновая кислота. 11, 0-Бис(триметилсилил)ацетамид (1М раствор в дихлорметане, 5 мл) по каплям добавляют к перемешиваемой
4Q суспензии 7 5-(З-2-амино-2-фенил" ацетамидо) -3-/(5-метил-1; 3, 4-. тиадиазол -Z-ил)-тиометил/-3-цефем-4"
-карбоновой кислоты (239 сг ,0,5 ммоль) в зтилацетате (5 мл) при
0 С. Смесь перемешивают в течение
1 ч при 0 С и добавляют к ней хлорайгидрид кислоты (162 мг, 0,5 ммоль), описанный в а. После перемешивания в течение 4 ч при 0"С, раствор разбавляют 150 мл этилацетата, последовательно промывают водой (2 раза по 20 мл), 0,5 н соляной кислотой (2 20 мл ), водой (2 ° 20 мл) и насыщенным солевым .раствором!2 20 мл), 5 высушивают сульфатом магния и растворитель выпаривают досуха, получая желтые кристаллы (190 мг). Часть кристаллов(114 мг,1 очищают методом препаративной тонкослойной хроматоНайдено,4: С 46,82, Н 3,49,"
И 8,06.
ИК-спектр (см, нуйол: 17601785, 1660-1685, 1615.
ЯМР-спектр (К, ДИМСО- Cf(,): 2,35 (ЗН, с), 2,36 (ЗН, с), 2,66 (3Н, с), 3,28 (1Н, д, I = 18 Гц), 3,54 (1Н, д, I =18 гц), 430 (1н, д, I12 Гц), 4»54 (1Н, д, Х = 12Гц ), 4,90 (1Н, д,. I = 5 Гц), >,56 (1Н,д, Е = 8 Гц и 5 Гц), 5;73 (1Н, д, 1 = 8 Гц), 6,71 (2Н, д, I= 8 Гц), 7,24 (2Н, д, I = 8 Гц), 7,85 (1Н, с)» 8,04 (1H, с). 9,01 (1H, с), 9,30, .;,1н,- д, 1 = 8 гц), 9,97 (lH, д, т = "15 = 8 Гц).
П р р м е р 9 7(-7D2(7, 8-Диокс ихромон-3- ка рбоксамидо) -2- (4- окси- фенил ацетамидо/-3-/(1-метилте гразол-5-ил)тиометил/-3-цефем-4-карбоновая кислота. а) 7, 8-Дигидрооксихромон-3-кар.бонилхлорид.
Смесь 7, 8-Дигидроксихромон-3-кар- 25 боновой кислота.(6,6 г, 30 ммоль) и хлористого тионила (25 мл,) кипятят,в течение 1 ч с обратным холодильником, и удаляют хлористый тионил. После добавления бензола к остатку смесь выпаривают досуха, и остаток растирают в порошок с И -гексаном, получая 7,2 г целевого соединения.
ИК-спектр (см ", нуйол/: 1775, 1660, 1620; б) ф-/9-2-(7,8-Диоксихромон-3. .-карбоксамидо) -.2-(4-оксифенил)ацета.мидо/-3-/(1«метилтетразол-5-ил)тиометил/-3-цефем-4-карбоновая кислота.
Согласно способу, описанному s примере 3 а, 7)-/3-2-амино-2-(4-оксифенил) ацетамидо/-3-/(1-метилтетразол
-5-ил)тиометил/-3-цефем-4-карбоновую кислоту f 133- мг, 0,28 ммоль1) обрабатывают с хлорангидридом кислоты (60,1 мг, 0,25 ммоль, описанным в
4 а, получая 37 мг целевого соединения (2q). Температура плавления около
220 С (с разложением).
Элементный анализ для
С Яффу Й Oey .Ь 2
Вычислено,g: С 49,33, H 3,40;
H 14,:39.
Найдено,3: С 48,08, H 3,19
1 9,55ИК-спектр см-", нуйол): 1770, 1660, 1620.
Спектр ЯМР (д, ДМСО-C4) 3,52. (1H, д, I = 18 Гц), 3,71 (1Й, д, I=
04 16
= l8 Гц), 3.93 (Зн, с.), .4,20 (IH, д, I = 13 Гц), 4,35 (1H, д», Х = 13 Гц), 5,02 (1Н, д, I = 5 Гц), 5,6-5,9 (2Н, м)., 6,73 (2H, д, I = 8 Гц), 7,05 (1Н,д, т = 9 Гц), 7,26 (2Н, д, 8 Гц), 7,52 (1Н, д, I = 9 Гц), 8,92 (1Н, с), 9,38 (1Н, д, I = 8 Гц)» 9»44 (1Н шир. с), 9,73 (1H, шир. c), 10,-20 (1H, д, I = 8 Гц), 10,68 (1H, шир. с).
ll р и м е р 10 .. 7P-/Ь-2-(7; 8-Диацетоксихромон-3-карбоксамидо)-2-фенилацетамидо/-3-/(5-метил-1 3
4-тиадиазол-2-ил)тиометил-3-цефем-4-карбоновая кислота. а ) 7, 8-Диэцетоксихромон-3-карбо" нилхлорид.
Смесь 7,8-диацетоксихромон-3-кар" бойовой кислоты (9 5 r, 31 ммоль), тионилхлорида (2,6 мл), диметилфор" мамида (О, l мл) и бензола (300 мл) кипятят в течение 1,5 ч. После добавленйя 2,6 мл тионилхлорида и
0,1 мл диметилформамида смесь кипятят с обратным холодильником еще I ч и выпаривают досуха. Остаток растирают в порошок с И -гексаном, получая 9,3 г
9,3 r целевого соединения.
ИК-спектр (см ", нуйол): 1«80, 1770, 1670,. 1620.
50
17 1033 графин на сипикагеле {проявляющий раствори>ель: хлороформ метанол муравьи.- .ая кислота 90:10:4,,получая
26 мг ц р>евого сс>единения.
Т:-.h,!->ÿp;òóðà плавления 165->70 (5 о а р л,-„р >q > и г ,-> >>еме>,:т!.>ыи анализ для
- > ° .>
Вичислено,i: С 51,76, Н 3,55, Н 9,15, НайдеHo,4: С 50,36, Н, 3;49» и 8,!0.
ИК-спектр (см 1, нуйол/: 1785, 1670» 1630» 1620.
ЯНР-спектр (С1, ДМСО- А ): 2,38 (ЗН, . .. .2,-А (3H,:}, 2„68 {ЗН„с), д, 3 =- B Гц), 4»20 (1H, д, ?
= 13;-„ > ..:, 48 (>Н ц т = >3 f!1), 503 (1.::. д... = " . Гц), 5 76 {1Н, д, и 8 Г!(I „5,84 (1H„д.
= 8 Гц)., (,28-(,48 (5Н, м), 7»57 (1Н» д, == 8,5 Гц) р 8,16 {1Н» д, I = 8»5 Гц), 900 (lн, с), 952 {lH, =.8 Гц
П p !! м е р 11 . 7 -/ О-2- >/7,8-Див цетокс ихромон-3- карбоксамидо," 2(4-оксифенил ацетамидо/-3-/ 1:-метилтетразол-5-ил/тиометил/-3-цефем-4 30
"карбонсвая кислота.
Согласно способу, описанному в примере 3 а, 7P/О-2-амино-2-(4-оксифенил) ацетамидо/-3-/(1-метилтетразо>
-5-ил тиометил/-3-цефем-4-карбоновую кислоту, !33 мгр 0.28 мчол>ь) сбраба-, 35 тывают хлорангидридом кисл>оты
81,2 мг, 0,25 ммоль >р описанным в р поимере 10 а, получал,26 мг цепеного соединения (66Ц. Температура плавления около 180 :".: :»-.-.злэжение). 40
Элементный анализ для
С „Н . !»1-,0 - Б
Вычислено,4: С 50 »19 Н :,55, и 12,81.
Найдено р о, С 48 »24 > Н 3, 53; и 9,9!.
ИК спек р см, нуиол . 1уР>0, 1665,.1610, HNP-спектр (d fJHCO- Ю: 2,38 (ЗН, с), 2,45 (ЗН, с), 3,62 (2Н, шир. ), 3,92 (ЗН, с ), 4,21 (lн, д, = 13 Гц), 4,37 (lН, д, I = 13 Гц), 5,02 (lH, д I = 1 5 Гц), .>,62-5,85 (2Н, м), 6»74 (2Н, д, Т =- 8,5 Гц), 7,27 (2Н, с, т = 8,; Гц), 7,58 (1Н, д, I = 9 Гц, 8,16 (1Н,. Д„1 =9 Гц), 9,01 (1Н, с,, 9,40 (1H, д, I =- 8 Гц) 004 18
9,45 (lн, шир., с), 9,96 (lH, д, ? =
= 8 Гц).
Пример 12 . 7,Я-/))-2-(7,8-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо/-3-/ 5-метил"
-1, 3, 4-тиадиазол-2-ил)тиометнл/"3"цефем-4-карбоновая кислота.
О-Бис(триметилсилил)ацетамид (1 М раствор в дихлорметане, 2 мл) по каплям добавляют к перемешиваемой суспензии 7Ру- Й-2-амино-2-(4-оксифенил) ацетамидо/-3-/ 5-метил-1, . 3, -тиадиазол-2-ил)тиометил/-3-цефем-4-карбоновой кислоты (98,6 мг, 0,2 ммоль/ в 3 мл этилацетата при
0 С. Смесь перемешивают в течение ч при 0 С и добавляют к ней хлорангидрид кислоты.(32,5 мг, 0,2 ммоль) описанный в примере 10 а. После перемешивания в течение 4 ч при 0 С смесь разбавляют 60 мл этилацетата, промывают последовательно водой (20 мл/, 0,5 н. соляной кислотой (2 10 мл ), водой (!О мл } и насыщенным солевым раствором (2 10 мл}, высушивают сульфатом магния и выпаривают рвстворитель. После добавления 10 мл ацетона к остатку смесь выдерживают в течение
11 ч при 20 С. После удаления раствоо рителя остаток растирают в порошок с этиловым эфиром, получая желтые кристаллы (98 мг). Часть этих кристаллов (86 мг) очищают препаративной тонкослойной хроматографией на силикагеле (проявляющий растворитель: хлороформ метанол муравьиная кислота 90:10.4), получая 17 мг целевого соединения. Температура плавления
180-185 С (разложение).
Элементный анализ для -ЯН 7 g qg =>3
Вычислено,й: С 50,70, Н 3,48, 8
8,96.
Найдено,Ф: С 49,67, Н 3,60; и 7,73.
Nl(-спектр (см, нуйол ): 1780, -
1665, 1630, 1615, ЯИР-спектр (Д р ДИСО-д ): 2,38 (3Н, с), 2,44 (ЗН, с), 2,68 (ЗН, с), 3,52 (1H, д„ I = 18 Гц), 3,68 (1H, д, I = 18 Гц), 4,20 (1Н, д, I
= 13 Гц), 4,48 (lн, д, I = 13 Гц), 5,02 (lH, д, I = 4,S Гц), 5,6З (1H, д, I = 8 Гц), 5,76 (lн, д, т = 4,5 и 8 Гц), 6,73 (2Н, д, Т = 8 Гц), 7,25 (2н, д, I = 8 Гц), 7,56 (1н, д, Т = 8,5 Гц), 8,14 (1Н, д, I = 8 5 Гц), 9,00 (1Н, с), 9,39 (1H, д, Э 103 3004 20
=8Г) 44(1 )
I = =8 Гц). ц), 9, (H, c), 9,9з (1Н, д, 0,314 ммоль) обрабатывают тионилхлоРидом (0,1 мл, 1,4 ммоль), получая . Пример 13 . 7,-/0-..2-(7-окг б-.ацетоксихромон-3-карбонилхлорид. хромон-3-карбоксиамидо -2-(4-окси- 0-Б (( ис((триметилсилил) ацет фенил)ацетамидо/-3-/ 1-метилтетразол амид (3 м } Q 6 мл g авляют к перемещивав.-.
-5-ил)тиометил/-3-цефем-4-карбоновая мой суспензии ?PfD-2-анино-(4-оксикислота.
В фенил)ацетамидо/-3-/(1-метилтетразол соответствии с методикой, опи-. -5-ил)тиометил/-3- еф -4- б
-цефем- -карбоновои санной .в примере 5 а., 7-оксихромон- кислоты (150 мг, 0,314 ммоль) в
-3-карбоновую кислоту (206 мг,, 10 аэтилацетате (20 мл). Все количество ммоль ) обрабатывают тионилхлори- хлорангидрида кислоты, добавляют к дом (0,3 мл, 4,1 ммоль ), получая, охлаждаемой льдом смеси и перемеаи-оксихромон-3-карбонилхлорид. вают при комнатной темпе а 0- Бис т им т
g, - Бис(триметилсилил} ацетамид чение ночи. Реакционную смесь паследо. (3 мл) добавляют к перемешиваемой 15 вательно промывают ледяной водой суспензии 7 -/З-2-амйно-2-(4-окси- (15 мл), 0,5 н . соляной кислотой . Фенил)ацетамидо/-3-/(1-метилтетразол- {15 мл) и водой (15 мл}. и высушивают -5-ил) тиометил/-3-цефем-4-карбоновой сульфатом магния. После удаления расткислоты (157 мг, 0,33 ммоль ) в 20 мл ворителя остаток растворяют в 3 мл этилацетата. Все количество хлорангид этилацетата и добавляют к эт
20 а и до авляют к этому растрида кислоты добавляют к охлаждаемой ворн 100 мл этилового эфира. Ос д
Ф мл этилового эфира. садокльдом смеси и перемешивают ее при отфильтровывают, получая целевое комнатной температуре в течение ночи. соединение (17,2 мг, 8 ). ТемператуРеакционную смесь последовательно ра плавления 191-195 С (разложение). промывают ледяной. водой (15 мл ), Элементный анализ для.
0,5 н. соляной кислот ой (15 мл ) и . "-3О Н N О г
С30 1 lо 215 мл воды и высушивают сульфатом . . Вычислено,i: С 50,92," Н 3,56," магния. После удаления растворителя g 13,85. остаток растворяют в 3 мл этилацета- Найдено,й: С 5,66; Н 3,83 та, к которому добавляют 100 мл эти- N 10,01. лового э и ло ого эфира.
30 .
ИК-спектр (см", нуйол): 1780, Осадок отфильтровывают, получая - 1?60, 1690 1660 16?О.
23
1 9 7 з . °
3,7 мг целевого соединения (113 ). ЯМР-спектр (К, ацет -Д ):
Температура плавления 180-18? С (Раз- (3H, с), 3,71 (2H с} ацетон : 2 35
Элемснтный анализ для 35 = 5 Гц) 5 80 (1H
g> Н-, > 5z, 5,88 (1H, д, т = 9 г ), 6,83 (2H, Вычислено,i: С 50,52; Н 3,48; д, I = 10 Гц) 7 42 (2Н
= 10 Гц), 7,1-8,05 (Зн, м), 8;96 . Найдено, Ф: С 44,41, H 3,82, (1H, с }; 8,35 (1H, д, Х = 10 Гц }, ИК-спектр (см, нуйол): 1770, Пример 15 ?ро -/З-2-(. 1690, 1660, 1610.
/3- - -(хромон-3-карбоксамидо)-2-(4-оксифенил)-ацеЯИР-.сгектр (О,. ацетон- д ): 3,72 тамидо/-3-/(1-метилтетразол-5-g ) . с, .9 (3 t, с),, 0 (2H, с), тиометил/-3-цефем-4-карбонов„„" кисло516 (1Н, д, 6 Гц), 5,84 (1Н, д, т = 45 та.
= 9 Гц) 88
), 5, (1Н, д, I = 11 и 6 Гц), а) Хромон-3-карбонилхлори
6,83.(1Н д I =91 74 (1=9 гц) 68(,, = 9 ц), 7, 2 (1Н, д, В соответствии с методикой
ОнилхлОрид. (1Н с) 8 (5-9,18 (3H w) 8 82 санной в примере 5 а, хромон-3- рбдикой, опи . 10,36 (1н, д, I = 10 г (., с), 37 (1H p, I = 10 q) новую кислоту (3 8 г 20 ) бММОЛЬ) О д, I = 10 Гц). 50 Рабатывают тионилхлоридом (1,73 мл), fl р и и е р 1-4. 7/Ъ-/1Ъ-?-(б-дцет- полУчаЯ целевое соединение (3,76 г, оксихромон-3-карбоксамидо )-2-(4-оксифенил)-ацетамидо/-3-/(1-метилтетразол- ИК-спектр (см, "Уйол): 1785
-ил)тиометил/-3 цефем-4 Kàðboíoâàÿ 1650, б кислота. 55
В б ) 7 -/З-? (хромон-3-карбоксамидо) соответствии с методикой, опи- -2-(4-оксифенил)-ацетамидо/-3-(1санной в и име е 5 с " р р 5 а, 6-ацетоксихро- -метилтетразол-5-ил)тиометил/-3мон-3-ка бонов ю ки л р у к слоту (77 мг, -цефем-4-карбоновая кислота..
21 1033
В соответствии с методикой, описанной в примере 3 а, «(-/Э-2-амино"
-2-(4 -оксифенил)ацетамидо/-3-/(1-метилтетразол-5-ил)тиометил/-3-цефем-4-карбоновую кислоту (133 мг, 0,28 ммоль) обрабатывают хлорангидридом кислоты (52,1 мг, 0,25 ммоль) описанным в а, получая 57 мг целево" го соединения (35/). Температура плавления около 170 С {разложение). о
Элементный анализ для
С,ВН,, я, ов 6<
Вычислено, б: С 51,76; " 3 57 !! 15 09 °
Найдено,,/: С 51,69, Н 3 49i ! 1,97., ИК-с-!ектр (см, нуйол): 1780, 1660, 16!О. ям Р-спектр (с! piviCO-Clr>): 3,52 1Н, q., 1 =- 18 Гц), 3,72 (1H, д, 18 l ц), З„о2 (ЗН, с ), 4,21 (1Н, д, 1 =- 13 Гц), 4,36 (1н„д, Z =:
= 13 I Li), 502 (1H д, 1 = 45 Гц), 564--5 84 (2H, м), 673 (2Н, д, 7,41-8.„1 (H, и) „8 21 (1Н, д, Х
= 18 Рц), о,44 (1H, ш,р,, ), 10,08 C 1Н, д т =.8 !ц).
Пример 16 . 7P "/Э-"-(6,730
-Диацетоксихромон-3-карбоксамидо)-2-фенилацетамидо/-3-/(1-метилтетразол-5-vr,)тиометил/-3-цефем-4-карбоновая кислота. а )3-2-(6,7-диацетоксихромон-3"карбоксамидо)-2- фенилуксусная кислота.
Смесь 6,6 г (44 ммоль) р-фенилглицина и 28,4 г гексаметилдисилазана кипятят с обратным холодильником в течение 10 ч при перемсшивании, 40 и растворитель .удаляют. Остаток растворяют в.дихлорметане (120 мл), к нему добавляют Н, >)-диметиланилин (5,3 г )и 6, 7-диацетоксихромон-3-карбонилхлорид (13 0 г, 40 ммоль), описанный в примере 5 а, при 0 С при перемешивании.
Эту смесь перемешивают в течение
10 мин при 0 С и еще дополнительно в течение 3 ч при комнатной темпера" туре, и подкисляют 1 н, соляной кислотой при охлаждении.
Осадок отфильтровывают, последовательно промывают водой и холодным метанолом, и высушивают, получая
13,8 г целевого соединения. Темперао тура плавления 210-212 С.!
004 22
ИК-спектр 1 см ", нуйол : 1770, 1725, 1675, 1615.
ЯИР-спектр, (6 ТИСО-дб); 2.33 (6Н, с), 5,58 (1Н,9, z = 7Га ), 7,34 (5H, с), 7,78 (1H, с), 8,00 (1H, с), 8,98 (1Н, с) б) 7 Ъ-/0-2-(6, 7-Диацетоксихромон-3-карбоксиамидо)-2-фенилацетамидо
/-3-/(1-метилтетразол-5-ил)тиометил
/-3-цефем-4-карбоновой кислоты, И, К-Диметиланилин (0,665 r} добавляют к перемешиваемому раствору соединения (2,19 г, 5 . моль), описанного в а, в смеси 20 мл дихлорметана и 4 мл диметилформамида при 0 С.
Смесь охлаждают до -18 С, и к ней добавляют раствор этилхлорформиата (0,57 г ) в 5 мл дихлорметана. Смесь перемешивают в течение 1 ч, поддерживая температуру между (- 15 ) и (-10 ) С
К этому раствору добавляют смесь 7-амино-3-(1-метилтетразол-5-ил )тиометил/-3-цефем-4-карбоновой кислоты (1,14 г, 5 ммоль ) и т,О-бис(триметилсилил)ацетамида {5 мл ) в 35 мл ацетонитрила при -30ОС. Образовавшийся раствор перемешивают в течение 1 ч при температуре между (-10} и (-5 ) С, еще в течение 1 ч при 0 С, и дополнительно в течение 1 ч при комнатной температуре. Растворитель удаляют, а к остатку добавляют воду (40 мл) и затеи 1 н. соляную; кислоту, чтобы подкислить смесь, Осадок отфильтровывают, промывают водой и высушивают.
Неочищенное твердое вещество очищают методом препаративной .тонкослойной хроматографии на силикагеле (проявляющий растворитель — смесь хлороформ-метанол-муравьиная кислота 95: 5:
:0,5), получая 1,0 г целевого соединения, Это соединение идентично соединению, описанному в примере 5 б, что подтверждено методами ЯМР, ИК и тонкослойной хроматографии.
Следующие соединения синтезированы по методике, аналогичной описанной в примерах 1-16.
Пример 17 . 7P /р-2-(6, 7-Триацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо/-3-/(1-метилтетразол-5-ил)тиометил/-3-цефем-4-карбоновая кислота.
Выход 923. Температура плавления
182-186 С (разложение).
ИК-спектр (см"", нуйол): 1780, 1665, 1610.
ЯМР-спектр (О, ДМСО-dg): 2,35 (ЗН, с), 2,41 (ЗН, с), 2,46 (ЗН, с), 1033004 24
= 8 Гц), 6,11 (1H, с), 6,73 (2H, д, I = 8,5 Гц), 6.99 (lн, c}, 7,24 (2Н, д, I = 8,5 Гц), 8,63 (lн, с}.
Пример 20 . Натриевая соль
5 7 -Ф-2-(6-окси-7-натрийоксихромон-3-карбоксамидо) -2-(4;оксифениг ацетамидо/-3-/(