Способ получения производных цефалоспорина или их фармацевтически приемлемых солей
Иллюстрации
Показать всеРеферат
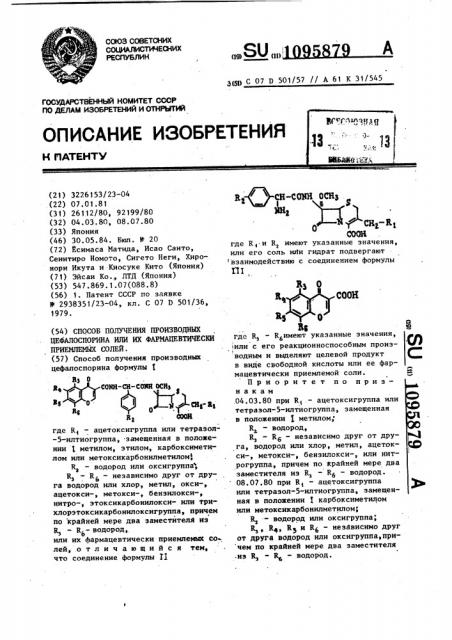
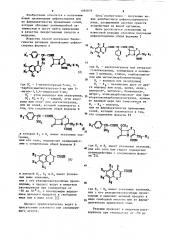
Способ получения производных цефалоспорина формулы I Rj О Я,...СОНЯ-СН-С(ЖН OCHj в.лЛоЛ |Л 1 R}ОООК где R - ацетоксигруппа или тетразол-5-илтиогруппа , -замещенная в положении I метилом, этилом, карбоксимети лом или метоксикарбонш1метилом$ RJ - водород или оксигруппа RJ - R - независимо друг от друга водород или хлор, метил, окси-, ацетокси-, метокси-, бензилокси-, нитро-, этоксикарбонилоксиили трихлорэтоксикарбонилоксигруппа , причем по крайней мере два заместители из Кз - водород, или их фармацевтически приемлемых солей , о тличающийся тем, что соединение формулы II где RJ - RcИмeют указанные значения, СП ( ИЛИ с его реакционноспособным производным и выделяют целевой продукт в виде свободной кислоты или ее фармацевтически приемлемой соли. Приоритет по признакам 04.03.80 при RI - ацетоксигруппа или со сд тетразол-5-илтиогруппа, замещенная в положении I метилом, с Rj - водород, N RJ - Rg - независимо друг от дру Ь га, водород или хлор, метил, ацетокси- , метокси-, бензилокси-, или нитрогруппа , причем по Крайней мере два заместителя из R, - Rg воДОРод. 08.07.80 при R, - ацетоксигруппа или тетразол-5-илтиогруппа, замещенная в положении I карбоксиметилом или метоксикарбонилметилом{ RJ - водород или оксигруппа; RJj R, RJ и R - независимо друг от друге водород или оксигруппа,причем по крайней мере два заместителя из R - R - водород.
СОЮЗ СОВЕТСКИХ
РЕСПУБЛИК (19) (Н) С00Н
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛ ОТКРЫТИЙ (21) 3226153/23-04 (22) 07.01.81 (31) 26112/809 92199/80 (32) 04.03.80, 08.07.80 (33) Япония (46) 30.05.84. Бюл. В 20 (72) Есимаса Матида, Исао Санто, Сеиитиро Номото, Сигето Неги, Хнронори Икута и Киосуке Кито (Япония) (7 1) Эйсаи Ко., ЛТД (Япония) (53) 547.869.1.07(088.8) (56) 1. Патент СССР по заявке
В 2938351/23-04, кл. С 07 D 501/36, 1979, (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
ЦЕФАЛОСПОРИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ
ПРИЕМЛЕМЫХ СОЛЕЙ . (57) Способ получения производных цефалоспорина формулы (в о . а С0МН-СН-СОЕК ОСНОВ
, : ... где К(— ацетоксигруппа или тетразол-5-илтиогруппа, замещенная в положении (метилом, этилом, карбоксиметилом или метоксикарбонилметилом, R — водород или оксигруппа", R — R(, — независимо друг от друга водород или хлор, метил, окси-, ацетокси-, метокси-, бензилокси-, нитро-, этоксикарбонилокси- или трихлорэтоксикарбонилоксигруппа, причем по крайней мере два заместителА из — R — водород, или их фармацевтически приемлемых солей, .отличающийся тем, что соединение формулы П
g(@) С 07 D 501/57 // А 61 К 31/545
R, СЯ-СОЗН ССН . где R,.è R, имеют указанные значения, или его соль или гидрат подвергают взаимодействию с соединением формулы
Э
Eg где R - R имеют указанные значения,,или с его реакционноспособным производным и выделяют целевой продукт в виде свободной кислоты или ее фармацевтически приемлемой соли.
Приоритет по признакам .04.03.80 при R(. — ацетоксигруппа или тетразол-5-клтиогруппа, замещенная в положении ). метилом, R — водород, к — R6 — независимо ppyr от дру- ) га, водород или хлор, метил, ацетокси-., метокси-, бензилокси-, или нитрогруппа, причем по крайней мере два заместителя из R, — R6 — водород.
08.07.80 при К(— ацетоксигруппа или тетразол-5-илтиогруппа, замещенная в положении (карбоксиметилом или метоксикарбонилметилом,"
К вЂ” водород или оксигруппа;
R, R, R и R(, — независимо друг от друга водород или оксигруппа,при чем по крайней мере два заместителя .as В - R - водород.
1095879
R2 (фОЯ
15 сН -сОмн 2
R, СН-CONH ОСН
ОООН . яН
35 в которой R< и К, имеют указанные зна чения, или его соль, подвергают взаимодействию с соединением общей формулы В
СН2-R|
СООН
СООН (в) 45
СООН
Rg где R - R6 имеют укаэанные значения, или с его реакционноспособным произ водным и выделяют целевой продукт в
55 виде свободной кислоты или ее фармацевтически приемлемой соли.
Изобретение относится к получению . l новых производных цефалоспорина или их фармацевтически приемлемых солей, которые обладают антимикробной активностью и могут найти применение в качестве лекарственных средств в медицине.
Известен способ получения биологически активных производных цефалоспорина формулы А где К вЂ” 1-.метилтетразол-5-ил, 1-карбоксиметилтетраэол — 5-ил или 5-метил-1,3,4-тиадиазол-2-ил, <
R — атом водорода или оксигруппа, (I
R, R4 и R5 — каждый, атом водорода или окси- или ацетоксигруппа, или их солей, который заключается в том, что соединение общей формулы Б в которой R, К4 и1 R имеют казанные выше значения, или с его реакционноспособным производным, и процесс ведут в инертном растворителе прп температуре от
-50 до 50 С, с последующим выделением целевого продукта в свободном виде или в виде соли (1) .
Процесс предпочтительно ведут в присутствии основного илн силилирующего агента.
-Цель изобретения — получение но— вых антибиотиков цефалоспоринового ряда, расширяющих арсенал средств воздействия на живой организм.
5 Цель достигается основанным на известной реакции способом получения цефалоспоринов общей формулы
CONN-ÑÍ-CO%1 ОСЯ!
О
М СН2 1 где R — ацетоксигруппа или тетразол-5-илтиогруппа, замещенная в положении 1 метилом, этилом, карбоксиметилом или метоксикарбонилметилом, R — водород или оксигруппа, К вЂ” R 6 — независимо друг от друга водород или хлор, метил, окси-, ацетокси-, метокси-, бенэилокси-, нитро-, этоксикарбонилокси- или трихлорэтоксикарбонилоксигруппа, причем по крайней мере два заместителя иэ
R — R6 — водород, или их фармацевтически приемлемых солей, который заключается в том, ЗО что соединение формулы П где R и R имеют указанные значения, о или его соль или гидрат подвергают взаимодействию с соединением формулы Tjl
Реакцию проводят в инертном растворителе при температуре от -50 до
1095879
5 г/кг для следующих соединений, полученных по изобретению: 7)-(0-2-(6,7-Диоксихромон-3-карбоксамидо)-2-(4-оксифенил)-ацетами5 до) -7 -метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
78-fD-2-(6,7-Диоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо) -7Ж-метокси-3- (5-метил-2-(1,3,4-тиадиазолил)) тиометил-3-цефем-4-карбоновая кислота.
Динатриевая соль 7)-(Р-2-(6,7-диоксихромон-3-карбоксиамидо)-2е
15 -(4-оксифенил)ацетамидо) -7с -метокси-3-(1-карбоксиметил-5-тетразолил)тио,метил-3-цефем-4-карбоновой кислоты.
7 — (0-2-(6,7-Бис(этоксикарбонилокси)хромон-3-карбоксамидо1 -2-(4ас -оксифеимл)ацетамицо -7м;метокси-3-(1-метоксикарбонилметил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
7 -(0-2- f6 7-Бис(2,2,2-трихлор25 этокси-карбонилокси)хромон-3-карбоксиамидо)-2-(4-оксифенил)ацетамицо -7 „-метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
30 7(3-(D-2-(6,7-Диоксихромон)-3-карбоксамидо) -2-(4-окснфенил)ацетамидо -3- f5-карбоксиметил-2-(1,3,4-тиадиазолил)1 тиометил-3-цефем-4-карбоновая кислота.
50 в С, предпочтительно от -20 .до
30 В С в присутствии или в отсутствие основного реагента или силилирующего агента.
Инертными растворителями могут быть ацетон, тетрагидрофуран, диметилацетамид, диметилформамид, диоксан, дихлорметан, хлороформ, бензол, толуол, этилацетат или их смеси.
Основными реагентами могут быть, например, щелочные гидроокиси, такие как гидроокись натрия или калия, I бикарбонаты щелочных металлов, такие как бикарбонат натрия или калия, амины, такие как триэтиламин, пйридин, диметиланилин или N-метилморфолин.
Силидирующими агентами могут быть, например, N,О-бис(триметилсилил)ацетамиц, гексаметилднсилазан или триметилсилилацетамид.
7;3 -fD-2-(6,7-Диоксихромон-3-карбоксамидо)-2-фенилацетамидо) -7а-метокси"3-(1-карбоксиметил-5-тетразоил) тиометил-3-цефем-4-карбоновая кислота.
7Р- (0-2-(6,7-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо)-7а-метокси-3-(1-карбоксиметил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
7)-tD-2-(6,7-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетам
goj -7а-метокси-3- f5-карбоксиметнл-2-(.1 3 4-тиадиазолил)1 -тиометил-3Э У
-цефем-4-карбоновая кислота.
78-(D-2-(6,7-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамиgoj-7а-метокси-3-(5-карбоксиметил-2-(1,3,4-оксадиазолил)) тиометил-3-цефем-4-карбоновая кислота.
Соединения формулы, полученные по предложенному способу, проявляют высокую противомикробную активность и являются эффективными против грам 4 положительных и грамотрицательных .бактерий. Особенно эффективны эти соединения против таких бактерий, как Pseudomonos aeruginosa, Serratia
Фагсевсепз и т.п., которьъз вызывают тяжело протекающие заболевания, а также против бактерий, продуцирующих -лактамазу.
Результаты испытаний приведены в таблице. 55
Величина острой токсичности (доза, вызывающая 507. смертности при пероральном введении мъппам) выще
П Р и м е Р 1. 7)-(Р-2-(6,7-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо| -7о -метокси-3-(1-метил-5-тетразолил)тиометнл-3-цефем-4-карбоновая кислота.
А. 6,7-Диацетоксихромон-3-карбоновая кислота, хлорангидрид.
Смесь 18,4 r 6,7-диацетоксихромон-3-карбоновой кислоты, 450 мл бензола, 8,6 г хлористого тионила и
3 мл диметилформамида кипятят с обратным холодильником в течение 1 ч и затем охлаждают до комнатной температуры. К реакционной смеси добавляют 300 мл гексана и въделившийся осадок въделяют фильтрацией. Таким образом получают 17,6 г целевого продукта °
ИК-спектр поглощения (см, нуджол): 1780, 1755, 1660, 1625.
Б. 7 -fD-2-(6,7-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)аце- тамидо1 -7g-метокси-3-(1-метил-51095879
-тетразолил) тиометил) -3-цефем-4-карбоновая кислота.
Соль 7 -fD-2-амино-/4-оксифенилацетамидо) -7 -метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновой кислоты и трифторуксусной кислоты (150 .мг) суспендируют в зтилацетате .(7,5 мл). К суспензии добавляют при О С и перемешивании
N,О-бис(триметилсилил)ацетамнд
t0 (417 мкл) и после перемешивания s те. чение 15 мин при О., С добавляют
78,2 мг указанного хлорангидрида кислоты (А) н смесь перемешивают при
0 С в течение 1,5 ч. В реакционный раствор добавляют 100 мл этилацетата и смесь последовательно промывают порциями ло 20 мл 0,5 и. соляной кислоты, дважды дистиллированной водой и насыщенным водным раствором хлористого натрия. Выделившийся органический слой отделяют и высушивают над сульфатом магния. Растворитель удаляют перегонкой, остаток растворяют в ацетоне (15 мл) и оставляют вы25 держиваться в течение ночи. Растворитель удаляют перегонкой, остаток растирают в порошок с этиловым эфиром. Образовавшийся таким образом осадок выделяют фильтрацией, получая З0
150 мг неочищенного продукта, который очищают тонкослойной хроматографией на силикагеле, получая 79 мг целевого продукта. Т.пл. 175-185 С
0 (разложение) . 35
Элементный анализ для С,,Н Н 0 8, Вычислено, : 49,81 3,67 . 12 32
Найдено, : 48,25 3,58 11,70
ИК-спектр поглощения, (см 1,нуд- 40 жол): 1770-1790, 1715, 1670, 1620.
ЯЙР-спектр, (млн.доли, диметилсульфоксид — dg): 2,34 (3H, синглет), 2,36 (ЗН, с), 3,40 (ЗН, 5 ), 3,34(1Н, 3, 3 = 18Н ), 3,66 (1Н, (3, Д = 45
18Н ); 3,90 (ЗН,5 ), 4,12 (1Н,3, 7 =. 13Н ); 5,06 (iH,5 ), 5,68 (1H, d,3 = 8Н ), 6,73 (2Н, с3, 3
= 8,5Н ); 7,30 (2Н, (3, Д = 8,5Hz), „7,86 (1Н,5), 8,02 (1Н, 9 ), 9,03 (1Н, 50
5)э 9 03 (1Н 5 ).
Пример 2. 7(3- D-(7,8-Диацетоксихромон-3-карбоксиамино)-2-(4-оксифенил)ацетамидо) -7 -метокси-3-(1-метил-5-тетразолил)-тиометил-355
-цефем-4-карбоновая кислота.
А. 7,8-Диацетоксихромон-Ç-карбонилхлорид.
Элементный анализ для
С, Н,, 1,0„8, С Н
Вычислено, .: 49, 81 3, 67
Найдено, : 49,? 4 3, 89
12,32
10,29
Смесь 9,5 r 7;8-диацетоксихромон-3-карбоновой кислоты, 2,6 мл хлористого тионила, О, 1 мл диметилформамида и 300 мл бензола кипятят 1,5 ч с обратным холодильником, затем дополнительно добавляют 2,6 мл хлористого тионила и О, 1 мл диметилформамида. Весь объем кипятят с обратным холодильником дополнительно в течение 1 ч. После этого растворитель отгоняют при перегонке, остаток растирают в порошок с н-гексаном. Полученный твердый порошок выделяют фильтрацией. Таким образом получают
9,3 г целевого продукта.
ИК-спектр поглощения (см,нуджол): 1780, 1770, 1670, 1620.
Б. 7 -(0-2-(7,8-Диацетоксихромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо)-7,-метокси-З-(1-метил-5-тетразолил)тиометил)-3-цефем-4-карбоновая кислота.
Соль 2P-fD-2-амино-2-(4-оксифенил)ацетамидо-7ф,-метокси-3-(1-метил-5-тетразолил)тнометил-З-цефем-4-.
-карбоновой кислоты и трифторуксусной кислоты (150 мг) суспендируют в
7,5 мл этилацетата, к ней добавляют
N,0-бис(триметилсилил)ацетамид (417 мкл) при Оо С и перемешивании.
К полученной смеси добавляют хлорангидрид кислоты (78,2 мг), который был получен (А), и весь объем перемешивают при ОО С в течение 3 ч.
Реакционный раствор после добавления к.нему 100 мл этилацетата последовательно промывают порциями по 20 мл
0 5 н. соляной кислоты, дважды дистиллированной водой и насыщенным водным раствором хлористого натрия.
Оставшийся осадок после удаления из него растворителя при перегонке растворяют в 15 мл ацетона и оставляют раствор в течение ночи при комнатной температуре. Растворитель отгоняют из раствора, остаток растирают в порошок с этиловым эфиром, получая
98 мг неочищенного продукта, который промывают смесью этилового эфира, ацетона и метанола в соотношении
9:0,5:0,5, получая 69 мг целевого продукта. Т.пл. 175-190 С.
1095879
ИК-спектр поглощения (см 1, нуджол): 1770-1970, 1715, 1670, 1615..
ЯМР-спектр (млн.доли, ДМСΠ— dq ):
2,37 (ЗН, 5 ); 2,43 (ЗН,5 ), 3,40 (ÇH; б), 3,6 (2H, Ь ) 3,89 (ЗН,5 ), 4,16 (1Н, d, J = IÇH z, ), 4,36 (IН., ds3 = 13HZ ), 5,06 (IН,5 ); 5,67. (IН, 3 = 8Н у, ), 6,73 (2Н,3, Д
= 8,5Н ), 7,30 (2Н, d Д 8s5Hz ), 7,55 (IH, d,Д = 9Н ); 8,10 (IН, d,3 = 9Н7.); 8,99 (IН, s ).
Пример 3. 7(3-fD-2-(6,7-Диоксихромон-3-карбоксиамидо)-2-(4-оксифенил)ацетамидо) -70 -метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
А. 6,7-Диоксихромон-Ç-карбонилхлорид.
В течение 1 ч кипятят с обратным холодильником смесь 888 мг 6,7-диоксихромон-3-карбоновой кислоты и
25 мл хлористого тионила. Затем из реакционной смеси удаляют перегонкой весь непрореагировавший хлористый тионил. К остатку добавляют бензол и смесь подвергают перегонке. Остаток растирают в порошок с дихлорметаном, получая 719 мг целевого пррдукта.
ИК-спектр поглощения (см 1, нуджол): 1780, 1765, 1645, 1625.
Б. 7 -(0-2-(6,7-Диоксихромон-. 3-карбоксамидо)-2-(4-оксифенил)ацета.мидо)-7 -метокси-3-(1-метил-5-тетразолил)тиометип)-3-цефем-4-карбоновая кислота.
Соль 7 -(О-2-амино-2-(4-оксифенил)ацетамидо) -73 -метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновой кислоты и трифторуксусной кислоты (150 мг) подвергают суспендированию в 7,5 мп этилацетата и добавляют в суспензию при 0 С и перемешивании 417 мкл N,О-бис(триметилсилил)ацетамида. К образовавшейся смеси добавляют при G С и перео мешивании полученный (А) хлорангидрид диоксихромон-3-карбоновой кислоты (58 мг). Еще раз добавляют 417 мкл
N О-бис(триметилсилил)ацетамида и
s б все количество перемешивают при 0 С .в течение 3 ч. После добавления
150 мл этилацетата к реакционному раствору смесь последовательно промывают порциями по 30 мл 0,5 н.соляноф кислоты, дважды дистиллированной водой и насыщенным раствором соли. Из смеси вьщеляют органический слой, высушивают над сульфатом магния и отгоняют растворитель. Полученный таким образом остаток растворяют в ацетоне (30 мл) и оставляют в течение ночи при комнатной температуре.
После удаления фильтрацией небольшого количества нерастворимого вещества растворитель отгоняют. К остатку добавляют этиловый эфир, чтобы провести растирание в порошок остатка.
Таким образом после фильтрации получают целевое вещество (105 мг).
Т,пл. 160-185 о С (,разложение).
Элементный анализ для
f5
С, Н Н 011 8
С ° Н N
Вычислено,Xf 48,94 3,54 13,78
Найдено,й 46,42 3,38 10,38
ИК-спектр (см 1, нуджол): 17701780, 1710, 1665, 1615, ЯМР-спектр (млн.доли, ДМСΠ— dg ):
3,40 (ÇH, S ); 3,89 (ЗН, 5 ); 4, 11 (IН, d, 3 13HZ ); 4,34 (IН, d sÇ
13Hz, ), 5,04 (IН, 5 ); 5,64 (IН, d, 3 8Н7, ), 6,73 (2Н,d
= 8,5 Н ) у 6,97 (IН, 5), 7,29 (2Н, д, 3 = 8,5ЙЕ); 7,39 (IН,S);
8,95 (IН,б ), Пример 4. 78-(D-2-(7,8-Диоксихромон-3-карбоксиамидо)-2-(4-оксифенил)-ацетамидо1 -7Ы.-метокси-З;(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
А. 7,8-Диоксихромон-Ç-карбонил35 хлорид.
7,8-Диоксихромон-З-карбоновую кислоту (6,6 r) кипятят в смеси с 25 мл хлористого тионила в течение 1 ч.
Оставшийся в реакционной смеси непро40 реагировавший хлористый тионил отгоняют и после добавления к остатку бензола смесь снова подвергают перегонке. К остатку добавляют н-гексан, чтобы провести растирание остатка в
45 порошок. После фильтрации получают 7,2 r целевого продукта.
HK-спектр поглощения (см, нуджол): 17 75, 1660, 1 620.
Б. 78-(Э-(7,8-Диоксихромон-Ç-кар50 боксамидо)-2-(4-оксифенил)ацетамидо1-70L-метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
Соль 7P- fD-2-амино-2-(4-оксифе55 нип) ацетамидо) -7<-меток си-3- (1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновой кислоты и трифторуксусной кислоты (150 мг) подвергают сус-.
1095879
10 пендированию в 7,5 мл этилацетата.
К этой суспензии при О С добавляют при перемешивании 417 мкл N О-бис(триметилсилил)ацетамида и к полученной смеси добавляют при 0 С и перемеши- 5 ванин 58 мг полученного (А) 7,8-диоксихромон-3-карбонилхлорида. Вводят дополнительно 417 мкл N,О-бис(триметилсилил)ацетамида и все количество перемешивают при 0 С в течение
3 ч. К реакционной смеси добавляют
150 мл этилацетата. Смесь последовательно промывают порциями по 30 мл
0,5 н. соляной кислоты, дистиллированной воды (дважды) и насьпценного солевого раствора. Вьделенный органический слой высушивают над сульфатом магния, а затем отгоняют иэ него растворитель при перегонке. Остаток растворяют в 30 мл ацетона и ос- 20 тавляют раствор при комнатной температуре в течение ночи. Небольшое количество вьделившегося нераствори- мого вещества удаляют при фильтрации и растворитель отгоняют из фильтрата. Оставшееся вещество растирают в порошок с этиловым эфиром и получают 88 мг неочищенного продукта.
Последний растворяют в смеси этилового эфира, ацетона и метанола в 30 соотношении 1: 1: 1 по объему. После удаления нерастворенного вещества фильтрацией фильтрат концентрируют и оставшееся вещество растирают в по рошок с этиловым эфиром. Полученное твердое вещество промывают смесью этилового эфира, ацетона и метанола в объемном соотношении 8:1:1. Получают 21 мг целевого продукта. Т.пл.
170-200 С (разложение). 40
Элементный анализ для
С 9 Н 5 Иу 01, Я
С Н N
Вычислено,%: 48,94 3,54 13,78 4
Найдено,%: 43,08 3,26 9,03
ИК-спектр поглощения (см", нуджол): 1770-1780, 1710, 1665, 1615.
ЯМР-спектр (млн.доли, ДИСΠ— —, ):
3,40 (ЗН,5 ); 3,90 (ЗН,G ); 4,13 (2Н, d,3 =13Н ), 4,34 (1й,d,j
1ЗН2 ); 5 05 (1Н,Б ), 5 64 (1Н,д
3 = 7Hz); 6,73 (2Н, d, 3 = 8,5Hz ), 7,04 (1Н, Д, 3 = 9Н ); 7,30 (2Н, 3,5 = 8,5Hz ); 7,51 (1H,J, J =
= 9Hz ); 8,91 (1Н,S ).
Пример 5. 7Р-(0-2-(6,7-Диоксихромон-3-карбоксимидо)-2-фенилацетамидо1 — 7 — метокси-3-ацетоксиметил
-3-цефем-4-карбоновая кислота и ее натриевая соль.
А. 7 -(0-2-(6,7-Диоксихромон-3-карбоксамидо)-2-фенилацетамидо)—
-70 -метокси-3-ацетоксиметил-3-цефем.
-4-карбоновая кислота.
Соль 7P- (D-2-амнно — 2-фенилацетамидо)-Ъ,-метокси-3-ацетоксиметил-3
-цефем-4-карбоновой кислоты и трифторуксусной кислоты (700 Mr) суспендируют в этилацетате (35 мл). К этой суспензии добавляют при 0 о С и перемешивании 2,2 мл N,О-бис(триметилсилил)ацетамид (2,2 мл). Через !
О мин добавляют 305,5 мг полученного (А) 6,7-диоксихромон-3-карбонилхлорида. Смесь перемешивают в течение 1 ч при 0 С и затем в течение о
2 ч при 15 С.
К реакционной смеси добавляют
700 мл .этилацетата и все количество последовательно промывают порциями по 140 мл 0 5 н. соляной кислоты, дистиллированной воды (дважды) и насыщенного водного раствора хлористого натрия. Отделившийся органический слой выделяют и высушивают над сульфатом магния. Затем растворитель отгоняют из смеси и остаток растворяют в ацетоне (70 мл), а раствор оставляют при комнатной температуре в течение ночи. Растворитель отгоняют.из раствора, остаток растирают в порошок с этиловым эфиром. Твердую массу промывают смесью этилового эфира, ацетона и метанола в соотношении 9:0,5:0,5 по объему. Получают
181 мг целевого продукта. Т.пл. 200250 С (разложение).
Элементный анализ для
С Н - 13012 S
С Н N
Вычислено,%: 54, 46 3, 94 6, 57
Найдено,%: 48, 85 3, 73 6, 83
ИК-спектр поглощения (см,нуджол): 1780, 1730, 1710, 1665, 1635.
ЯИР-спектр (млн.доли, ДМСΠ— dg ):
2,00 (ЗН,5 ),,3, 18 (1Н, Д, 3 =18H z );
3, 41 (ЗН,5 ); 3,52 (1Н, d, 3
f8Hg ), 4 60 (1Н 3, 3 = 13Н ),, 4,90 (1Н, d, 3 = 13Ну ); 5,11 (1H, 5); 5,81 (1Н, d,Ë = 7,5 Н» ), 6,98 (1Н, 5 ); 7,1-7,6 (5H, in );
740 (1Н, 5); 886 (1Н, 5 ).
Б. Натриевая соль полученной (А) карбоновой кислоты.
1095879
Полученную (А) карбоновую кислоту (30 мг) растворяют в 1,2 мл тетрагидрофурана. К раствору при перемешивании добавляют 94 мкл 0,5 M раствора натриевой соли 2-этилгексановой 5 кислоты в тетрагидрофуране. Образовавшийся осадок отделяют фильтрацией и промывают тетрагидрофураном. Таким образом получают 24 мг целевого продукта. Т.пл. 200-230 С (разложение) ° о !О
С Н N.
Вычислено,X: 50,95 3,39 6,15
Найдено, : 47, 17 3,78 5,34 ИК-спектр поглощения (см, нуджол): 1765, 1730, 1665» 1610 - 1630.
ЯМР-спектр (млн.доли, ДМСΠ— d ):
1,98 (ЗН, 5 ) 2,92 (1Н, d . З вЂ” 17НХ); 3,38 (1Н, d, J = 17НХ);
3,42 (1Н, Я ); 4,68 (1Н, Д»2
12Н ), 4,82 (1Н, d, 3 = 12Н );
4,92 (1Н, 5 ); 5,84 (1Н, d
= 8Н ); 6,04 (1Н, S ) 6,94 (1Н, 5 );
7,2-7,7 (5Н, tao), 8,54 (1Н, 6 ) .
55
Элементный анализ для
С 9Н24N Na.:qZ
С Н N
Вычислено, : 52,65 3,66 6,35
Найдено,X: 48,84 3,56 5,60
-1
ИК-спектр поглощения (см, нуджол): 1765, 1730, 1665, 1610, 1630.
ЯМР-спектр (млн. доли, ДМСΠ— d g ):
1,99 (ЗН,5 ); 2,96 (1Н, (3,Л = 2О
17Hz); 3,43 (ЗН, 5 ); 3,50 (1Н, 3
17Н ); 4,67 (1Н, d, 3 = 12Н ), 4,86 (1Н, d,3 = 12Н ), 4,95 (1Н, 5); 5,86 (1Н, d,3 = 7,5Н ), 6,97 (1Н, 5 ), 7,37 (1Н, 5 ),,25
7,1-7,7 (5H, rn ); 8,83 (1Н, э ) .
В. Динатриевая соль полученного (А) соединения, т.е. натриевая соль
7 - Ъ-2-(6-окси-7-натрийоксихромон-3-карбоксамидо)-2-фенилацетамидо1—
-7oL-метокси-3-ацетоксиметил-3-цефем-4-карбоновой кислоты.
Полученное (А) соединение (30 мг) растворяют в 0,6 мл диметилформамида ° К полученному раствору при перемешивании добавляют 282 мкл 0,5 М раствора натриевой соли 2-этилгексановой кислоты в диметилформамиде.
Полученный раствор по каплям вводят при перемешивании в 7 мл этилацетата. 4О
Образовавшийся осадок выделяют фильтрацией и промывают этилацетатом.
Получают 20 мг целевого продукта.
Т.пл. 200-230 С (разложение).
Элементный анализ для
С >Hg8N Na2042 S
Соединения по примерам 6-12 получены аналогично примерам 1-5.
Пример 6. 7Р-(0-2-(7,8-Диоксихромон-3-карбоксиамидо)-2-фенилацетамидо) -4й-метокси-3-ацетоксиметил-3-цефем-4-карбоновая кислота.
Выход 18 ., т. пл. 200 240 С (разо ложение) .
Элементный анализ для
С2„Н25И,О12 S
С Н N
Вычислено, Х: 54, 46 3, 96 6, 57
Найдено, : 52, 75 4,01 6, 23
ИК-спектр поглощения (см 1, нуджол): 1775, 1735, 1715, 1670, 1620.
ЯМР-C11eKTp (MJIH. доли, ДМСΠ— d (, ):
2,00 (ЗН, 5 ), 3,19 (1Н, d, Д вЂ” 18Hz) 3,42 (ЗН, 5 ), 3,52 (1Н, d 3 = 18Н ); 4»61 (1Н, d
13HZ) 4,88 (1Н, Д, 3 = 18Н ), 5,11 (1Н, 5 ), 5,81 (1Н, d, J
7,5HZ); 7,03 (1Н, d „3 = 8,5. Hz), 7 1 76 (6Н,m); 893 (1Н,5 ).
Пример 7. 7Р-Р0-2-(5-Метоксихромон-3-карбок сиамидо) -2 — (4-оксифенил)ацетамидо) — 7 -метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
Выход 57Х, т.пл. 170-195в С (разложение).
Элементный анализ для эО 27 7 to 2
С Н N
Вычислено, : 50,77 3,83 13,82
Найдено, Х: 48,78 3,96 11, 13
ИК-спектр поглощения (см 1, нуджол): 1770, 1730, 1670, 1620.
ЯМР-спектр (млн.доли, ДМСО -36 ):
3,40 (ЗН,5 ), 3,90 (6H, 5 ),, 4,10 (1Н, с3, J = 13Н7), 4,36 (1Н, 3, 3 = 13Н ); 5,07 (1Н, 5 ), 5,64 (1Н, Я, 3 = 7»5Н7); 6,75 (2Н, g, J = 85 Н ); 708 (1H, d,Э
8НХ); 7, 20 (1Н, 3, 3 = 8Н );
730 (2Н, d, Д = 85Н ) 776 (1Н, Ь,Д = 8Н2)» 8,85 (1Н, 5 ).
Пример 8. Натриевая соль
78- (П-2-(5-метоксихромон-3-карбоксамидо)-2-(4-оксифенил) ацетамидо)—
-7 -метокси-3-(1-метил-5-тетразолил)тиометил-3-цефем-4-карбоновой кислоты.
Выход 88Х т. пл. 200-230 С (разложение) .
Элементный анализ СЗ„Н24М7Иа 01оБ, С Н N
Вычислено, : 49, 24 3, 58 13, 40
Найдено, Х: 49, 01 3, 64 12, 56
14
1З
1095879
ИК-спектр поглощения (см нуджол)! 1760, 1670, 1610 .
ЯМР-спектр (млн.доли, ДМСΠ— d< ):
3 41 (ÇH б ); 3 89 (ÇH 5 )
3 91 (3H 5 ), 4 25 (2Н Ьг., 9 )", 4,88 (1Н, 5 ); 5,68 (1Н, (3,3
7Н2) 6э 75 (2Ню d, 3 = 8 5Hg)
709 (1Н, (3, Д = 8Hg); 721 (1Нс3
3 = 8Н ), 7,30 (2Н,d,g = 2,5Hg);
7,77 (1Н, 4, Д = 8Н ); 8,85 (1H, 5).
Пример . 9. 7 -(Ъ-2-(Хромон-3-карбоксамйдо)-2-(4-оксифенил)ацетамидо -7 -метокси-3-(1-метил-5 -тетраэолнл)тиометил-3-цефем-4-кар- боновая кислота.
Выход 34%, т. пл. 175-200 С (раз ложение).
Элементный анализ для
С29нisNT09S
С Н N
Вычислено, %: 51, 24 3, 71 14, 73
Найдено,X: 49,3 2 3,90 11,62
ИК-спектр поглощения (см, нуджол): 1770-1790, 710, 1665, 1615.
ЯМР-спектр (млн. доли, ДМСО- д ):
3,40 (ЗН,5 ); 3,90 (ÇH,5 );
4,13 (1Н, d,3 = 13Hg); 4,36 (1Н, d, 3 = 1ЗНу), 5,06 (1Н, 5 ), 5,68 (1Н, d, 3 = 7Н%) i 6,75 (2Н, d, Л = 8 5 Н ), 7,31 (2Н, d
= 8,5Hg ), 7,4-8,1 (ÇH, rn ), 7, 18 (1Н, Ь, d, 3 8Hg), 9,04 (1Н, g ).. .Пример 10. 7P" 0-2-(6-Нитрохромон-3-карбоксамидо) -2-фенилацетамидо) -7 -метокси-3-ацетоксиметил-3-цефем-4-карбоновая кислота.
Выход 56%, т.пл. 140-150 С (разложение).
Элементный анализ для
С28Н Я О 1 $
С Н N
Вычислено, %: 52, 50 3, 78 8 ° 75
Найдено, %: 52,01 3,92 8,62
ИК-спектр поглощения (см 1, нуджол): 1775, 1740, 1720, 1670, 1620.
ЯМР-спектр (млн. доли, ДМСΠ— 86 ):
2 00 (ÇH,Q ); 3 21 (1Н,d,Э
18Н2)", 3,43 (ÇH, Q ), 3,54 (1Н, д, 3 = 18Н ), 4,63 (1Н, d, 3
13Hg), 4,92 (1Н, Д, б = 13H, ), 5,14 (1Н, 5 ), 5,86 (1Н, d, 3 — 7,5H ); 7,2-7,7 (5H, 1п ), 8,05 (1Н, d, Л 9 ), 8,66 (1Н, ЭНЕМ, 2,5 Hg) 8,87. (1Н, Д
Д = 2,5Hg) 9,13 (1Н, б ) ..
Пример 11. 7P-(D-2-(7-Хлорхромон-3-карбоксиамидо) -2-фенилацетоамидо).-7ф.-метокси-3-ацетоксиметил-3-цефем-4-карбоновая кислота.
Выход 41%, т.пл. 150-165 С (раз- ложение), Элементный анализ для
Су н 1С1И, 01оЯ
С Н N
Вычислено, %: 54, 25 3, 77 6, 55
Найдено,7: 53,63 3,73 6,58
ИК-спектр поглощения (см, нуджол): 1770-1790, 1730, 1710, 1700>
5) °
Пример 12. 7P-(D-2-(7-Бензилокси-8-метилхромон-3-карбоксамидо)-2-фенилацетамидо)-7d,-метокси-з-ацетоксиметил-3-цефем-4-карбоновая кислота.
Выход 46%, т. пл. 145-170 С (разложение).
Элементный анализ для
СЗТН ЯН 011 8
С Н N
Вычислено, %: 61,06 4,57 5,77
Найдено, Ж: 60,28 4,48 5,70
ИК-спектр поглощения (см ", нуджол): 1780, 1740, 1725, 1705, 1665, 1615.
ЯМР-спектр (млн. доли, ДМСΠ— d g ):
2,01 (ÇH, 8 ); 2,34 (ÇH, 5 );
3,21 (1Н, d J !8Н ), 3,44 (ÇH, 5 ), 3,54 (1H, 3, 5 = 18Н ), 4,64 (1Н, d, = 1ЗН„); 4,92 (1Н,
1Знт); 5,13 (1Н, 5 ) 5,36 (2Н,5 );
5,84 (1Н, d,3 = 7,5 Н ); 7,27,7 (11Н,щ ), 9,03 (1Н, 5 ): ф5
Пример 13. 7Р-(0-2-(6,7-ДиОксихромон 3-карбоксамидо-2-(4-оксифенил)-ацетамидо -7о -метокси-3-ацеток симетил-3-цефем-4-карбоновая кислота.
Соль 7 -(D-2-амино-.2-(4-оксифе-. нил)ацетамидо -7oL-метокси-3-ацетоксиметил-3-цефем-4-карбоновой кислоты и трифторуксусной кислоты (680 мг) суспендируют.в тетрагидрофуране (25 мл). В эту суспензию добавляют
1,33 мл N,О-бис(триметилсилнл)ацетамида и смесь перемешивают при 0 о С.
Спустя 10 мин в суспензию добавляют
55. 1670, 1605,.
ЯМР-спектр (мпн. доли, ДМСΠ—.d g ):
2,01 (ÇH, 5 )", 3,21 (1Н, d
18Н ), 3,44 (ÇH, 5 ); 3,53 (1Н; d
18ну); 4,64 (1 Н, Д, 3 = 1Знк), 4,92 (1Н, 1, -1 = 1ЗН%); 5,1З (1НД ), 5,84 (1Н, d, = 7,5Hg); 7,1
20 7,9 (6Н, m ); 8,2 (1Н, d, 3 = 2HZ), 8,20 (1й, d, 3 8,5 Н); 9 05 (1Н
16
1095879
1,5
289 мк 6,7-диоксихромон-3-карбонилхлорида, как в примере 3 (А) и суспензию дополнительно перемешивают в течение 2 ч при той же температуре. ,Реакционную смесь концентрируют приблизительно до объема 10 мл и концентрат выливают в 100 мл 0,5 н. соляной кислоты при 0 С. Образовавшийся осадок собирают фильтрацией и промывают водой, растворяют в 100 мл 10 тетрагидрофурана и раствор высушивают над сульфатом магния. Затем концентрируют приблизительно до 10 мл и выливают в 100 этилового эфира.
Образовавшийся осадок собирают фильт-1 рацией и высушивают, получая 294 мг целевого продукта. Из фипьтрата перегонкой удаляют растворитель и добавляют к остатку смесь тетрагидрофурана и этилового эфира (О, 2 : 9,8) 20 для растирания в порошок, получают .102 мг целевого продукта. Всего получают 396 мг целевого продукта. Т.пл.
» " 250 » С (разложение).
Элементный анализ для
СЯ Н25 N O q S
С Н N
Вычислено, Ж: 56, 33 3, 58 5, 97
Найдено, Х: 51,78 3,90 6,22
ИК-спектр поглощения (см, нуд-
)жол): 1770, 1720, 1710, 1615-1650.
ЯМР-спектр (мпн.доли, ДМСО- dg ):
2,01 (3Н, 5 ); 3,21 (1Н, b»,3,3
18Hz); 3,42 (ЗН, 5 ); 3,54 (1Н,Ь», d, 3 = 18Hz), 4,62 (1Н, »3, Л =13Hz),35
4,90 (1H, Д, 3 = 13HZ); 5, 10 (1Н, g )
:5,67 (1Н, 3, 3 = 7,5Н ), 6,74 (2Н, 3 3 = 9Н ),, 6,98 (1Н, б ), 7,31 (2Н, d, 1 = 9Hz); 7,40 (1í, > ); 8,86 (1í, Пример 14. 7P- jD-2-(7,8-Диоксихромон-3-карбоксайидо) -2- (4-оксифенил)ацетамидо) -?ф;метокси-3-ацетоксиметил-3-цефем"4-карбоновая кислота. 45
Соль 7 -(D-2-амино-2-(4-оксифенил)ацетамидо) -7Ы;метокси-3-ацетоксиметил-3-цефем-4-карбоновой кислоты и трифторуксусной кислоты (230 мг) суспендируют в 7 мг тетрагидрофурана 50 и к этой суспензии добавляют 454 мкл
N,О-бис(триметилсилил)ацета»вща при
0 С .и перемешивании. Спустя 10 мйн добавляют 98 мг хлорангидрида кислоты, полученного в примере 4 (А), и перемешивание продолжают дополнительно в течение 2 ч при той же температуре. Реакционную смесь концентрируют приблизительно до 3 мл и концентрат добавляют к 0 5 н. соляной кислоте (30 мл) при 0 С. Образовавшийся осадок собирают фильтрацией, промывают водой и высушивают. Полученный таким .образом порошок промывают смесью тетрагидрофурана и этилового эфира (0,2:9,8), затем этиловым эфиром и высушивают, получая 153 мг целевого продукта. Т.пл. 220-260 С (разложение).
Элементный анализ для
С ЗН25 3 13
С Н N
Вычислено, Х: 56, 33 3, 58 5, 97
Найдено, Х: 55,91 3,52 5,67
ИК-спектр поглощения (см-", нуджол): 1770, 1725, 1710, 1.660, 1615.
ЯМР-спектр (млн. доли, Щ4СΠ— 3< ):
2,00 (ЗН, 9 ); 3,42 (ЗН, 5 );
4,61 (1Н, 3, ".» = 13Н ); 4,90 (1Н,с3
3 = 13Hz); 5,09 (1Н, 5 ), 5,66 (1H, 3,3 =? 5Hz); 6 73 (2Н, d,J
8,5Hz) 7, 4 (1Н, 3, 3 = 8,5H<), 7,30 (2н, d 3 = 8,5Hz) 7,51 (1H, Я,3 = 8,5 Н ).
Пример 15. ?P-tD-2-(6,7-Диоксихромон-3-карбоксамидо)-2-(4-окси фенил)ацетамидо1-7* -метокси-3-(1-метоксикарбонилметил-5-тетразолил)-тиометил-3-цефем-4-карбоновая кислота.
А. 7 -(Р-2-(трет-Бутоксикарбоксамидо)-2-14-(2-тетрагидропиранил)оксифенил (ацетамидо)-3-(1-метоксикарбонилметил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота, бензгидрильный эфир.
Метилат лития (133 мг) растворяют в 4 мл метанола и 14 мл тетрагидрофурана при комнатной температуре в атмосфере аргоиа и полученный раствор охлаждают до -74 о С. 7(3-(D-2-трет-Бутоксикарбоксамидо-2-) 4-(2-тетрагидропиранил)оксифенил (ацетамид)-3-(1-карбоксиметил-5-тетразолил)тиометил-3-цефем-4-карбоновую кислоту, дибензгидрильный эфир (1,009 г) раст; воряют в 3,5 мл .тетрагидрофурана и полученный раствор добавляют к укаэанному раствору метилата лития под аргоном при перемешивании. Компоненты реагируют в течение 15 мин, в это время температура поддерживается при
-74 о С, затем добавляют 1 мл уксусной кислоты. Реакционную смесь до,бавляют к 200 мл хлороформа и 50 мл
57-ного водного раствора бикарбоната
1095879 натрия и перемешивают. Органический слой промывают SX — Hûì водным раствором бикарбоната натрия, затем водой и насыщенным водным раствором хлористого натрия. Этот слой высушивают над 5 сульфатом магния, растворитель удаляют перегонкой. Остаток очищают хроматографически на колонке с силикагелем, используя элюирующий растворитель, включающий этилацетат и бензол в отношении 15:85, получают 549 мг целевого продукта.
ИК-спектр поглощения (см, нуд жол): 1780, 1750, 1680, 1720.
Б, Бензгидрильный эфир 7P-fD-.2-(трет-бутоксикарбоксамидо)-2- 4-(2-тетрагидропиранил)оксифенил (ацЕтамидо)-7п(;метокси-3-(1-метоксикарбонил-5-тетразолил)тиометил-3-цефем-420
-карбоновой кислоты.
Растворяют в 7 мл метанола и 14 мл тетрагидрофурана, 239 мг метилата лития при комнатной температуре в атмосфере аргона. 25
В 4,8 мл тетрагидрофурана растворяют 1,595 г полученного соединения (А) и раствор добавляют в течение
1 мин под аргоном в полученный раствор метилата лития, охлажденный до
-75 С, при перемешивании. Затем по каплям при перемешивании в раствор добавляют 279 мкл трет-бутилгипохлорида. Продолжают перемешивание в течение 15 мин при -75 С, затем доо бавляют 1,5 мл уксуснои кислоты. Реакционную смесь добавляют к 200 мл хлороформа и 50 мл 5Х-ного водного раствора бикарбоната натрия. Органический слой промывают SX-Hûì водным
40 раствором бикарбоната натрия и затем насьпценным водным раствором хлористого натрия. Этот слой высушивают над сульфатом магния и удаляют растворитель при перегонке. Остаток очищают
45 хроматографически на колонке с силикагелем, используя элюирующий раствор, включающий этилацетат и бензол в соотношении 20:80. Получают 872 мг целевого продукта.
ИК-спектр поглощения (см 1, нуджол): 1780, 1750, 1670-1720.
В. Соль 7(†-2 — амино-2-(4-оксифенил)ацетамидо) -7аС-метокси-3-(1-метоксикарбонилметил-5-тетразолил)тиометил-3-пефем-4карбоновой кислоты 55 и трифторуксусной кислоты.
150 мг полученного соединения (Б) добавляют к смеси 2,5 мл трифторуксусной кислоты и 1 мл анизола, охлажденной до 0 С при перемешивании.
Продолжают перемешивание при 0 С в о течение 4 ч и реакционную смесь добавляют к 50 мл смеси этилового эфира и н-гексана (1:1) при перемешивании. Образовавшийся осадок собирают фильтрацией, промывают этиловым эфиром и высушивают, получая 118 мг целевого продукта.
ИК-спектр поглощения (см, нуджол): 1760, 1705, 1690, 1675, 1640, 1610.
Г. 7P-fD-2-(6,7-Диоксихромон-3-карбоксамидо)-2-(4-оксифенил)-.ацета.мидо) — 7п(,-метокси-3-(1-меTQKcHKap6oнилметил-5-тетразолил)-тиометил — 3—
-цефем-4-карбоновая кислота.
Полученное (В) соединение (21 мг) суспендируют в 1 мл тетрагидрофурана и к суспензии добавляют при перемешивании N 0-бис(триметилсилил) ацетамид. . После 10 мин перемешивания добавляют7,5 мг хлорангидрида кислоты, полученного в примере 3 (А), и перемеши— ванне продолжают еще в течение 2 ч прй 0 С. Затем реакционную смесь доР бавляют к 10 мл 0,5 н. соляной кислоты при 0 С. Образовавшийся осадок промывают водой и высушивают. Образовавшийся порошок промывают смесью тетрагидрофурана и этилового эфира (0,2:9,8) и затем этиловым эфиром и высушивают, получая 20 мг целевого продукта. Т.пл. 200-230 С (разложео ние) .
Элементный анализ для
С „Н д 1 1 О ц Б
С Н N
Вычислено, 7: 48, 37 3, 54 12, 74
Найдено, Ж: 48,42 3,48 12,56
ИК-спектр поглощения (см, нуджол): 1765, 1720, 1705, 1666, 16 15, 1609.
ЯМР-спектр (млн. доли, CHICO -d ):
3,40 (ЗНФ 5 ); 3,71 (ЗН, 5 );
4,14 (1Н, d, 3 = 12Н ); 4,42 (1Н, 3,3 = 12Н ), 5,01 (1Н, 5 );
5,44 (2Н, Ъп, 5 ), 5,65 (1Н, Д 3
=- 8Н ); 6,72 (2Н, d, 3 = 8Ну), 6,97 (1Н, S ); 7,28 (?H, J „ J =8 ), 7,39 (1Н, G ), 3,85 (1Н, 5 ).
Пример 16. 7/3-(Е)-2-(6,7-Бис(этоксикарбонилокси)хромон-3-карбоксамидо)-2-(4-оксифенил)ацетамидо)-7 -метокси-3-(1-метоксикарбонилметил-5-тетразолил)тиометил-3-цефем-4-карбоновая кислота.
1095879
А. 6,7-Бис(этоксикарбонилокси)хромон-3-карбонилхлорид.
6,7-Бис(этоксикарбонилокси)хромон-3-карбоновую кислоту (1,1 r) растворяют в 20 мл бенэола и добавляют 2 мл хлористого тионила по каплям при комнатной температуре и перемешивании. Затем смесь кипятят с обратным холодильником при перемешивании.
Реакционную смесь концентрируют и н-гексан добавляют к концентрату для того, чтобы вызвать его кристаллизацию. Образовавшиеся кристаллы собирают фильтрацией, пройывают н-гексаном и высушивают, получая 980 мг целевого продукта. Т.пл. 89-92 С.
Б. 7 -(0-2-(6,7-Бис(этоксикарбонилокси)хромон-3-карбоксдмидо -2-(4-оксифенил)ацетамидо -7aL-метокси-3-(1-метоксикарбонилметил-5-тетраэолил)тиометил-3-цефем-4-карбоновая кислота.
Полученное в примере 15 (В) соединение (34 мг) суспендируют в 1 мл тетрагидрофурана и к этой суспензии добавляют 56 мкл N,О-бис(триметилси лил)ацетамида при 0 С и перемешивао нии. После 10 мин перемешивания при
0 С 19,2 мг полученного (А) хлорангидрида кислоты растворяют в 1 мл тетрагидрофурана и продолжают переа мешивание еще в течение 2 ч при 0 С.
Затем реакционную смесь концентрируют до 0,5 мл и концентрированный раствор выливают в охлажденную льдом
0,5 н. соляную кислоту (10 мл). Образовавшийся осадок выделяют фильтрацией, промывают водой и высушивают.
Образовавшийся материал растворяют в тетрагидрофуране (0,5 мл). Этот раствор добавляют к 20 мл этилового .эфира при перемешивании. Образовавшийся осадок отделяют фильтрацией и промывают смесью (2 ) тетрагидро-, фуран — этиловый эфир и затем этиловым эфиром с последующей сушкой, получая 32 мг (вьмод 73X) целевого про дукта. Т.пл. 140-170 С (раэложео ние) .
ИК-спектр поглощения (см, нуд-1 .жол): 1750-1790, 1665, 1610.
ЯИР-спектр (млн.доли, ДАССО - 34):
1,34 (6Н,, 3 =,Н ), 3,4? (3Н,5 );
3,72 (ЗН, g ), 4,1-4,5 (6H, и| );
5,00 (1Н, 5 ), 5,40 (2Н, Ъ|, 5 )
5,66 (1Н, d, ",| = 6,5Н ; 6,72 (2Н, 3, J = 8HT); 7,29 (2Н, Д, 3 =8Н );
55 вор концентрируют до 3 мл и концентрат выливают в 30 мп 0,5 н. раствора охлажденной льдом соляной кислоты.
Выделившийся осадок отделяют фильтра7,99 (1Н, g ); 8,14 (1H, 5 ), 9,03 (1Н,б)..
Пример 17. Натриевая соль
7 -$33-2-(6,7-бис(этоксикарбонилокси)хромон-3-карбоксиамидо)-2-(4-оксифенил)-ацетамидо -7aL-метокси- 3-(1—
-метоксикарбонилметил-5-тетразолил)-тиометил-3-цефем-4-карбоновой кислоты.
Соединение (13 мг), полученное в примере 16, растворяют в смеси (0,4 мл) тетрагидрофурана и этилацетата в объемном соотношении 1:1. К этому раствору добавляют 28 мкл
0,5 M раствора натриевой соли 2-этилгексановой кислоты в тетрафидрофуране и затем 2 мл этилового эфира. Образовавшийся осадок выделяют фильтрацией и промывают смесью этилацетата и этилового эфира в соотношении
1:1 по объему и этиловым эфиром.
После высушивания получают. 12 мг це левого продукта. Т.пл. 170-210 С (разложение).
ИК-спектр поглощения (см, нуджол): 1730-1790, 1660, 1615.
ЯМР-спектр (млн.доли, ДМСО dg):
1,31 (6Н, t, 3 = 7Н ), 3,42 (3Н, б ), 3,71 (ЗН, 5 ), 4,1-4,5 (6Н, | || ),, 30 4 84 (1Н,5 ), 5,35 (2Н, Ъ|, 5 ), 5,68 (1Н, d,,Э = 7Н ); 6,71 (2H, d
J - 8,5 и ), 7,30 (2Н, d, 3 =8,5Н ), 7,97 (1Н,б ); 8, 14 (1Н, 5 ); 9,02 (1Н, 5) °
35 Пример 18. 7P- fD-2-(6,7-Бис (этоксикарбонилокси) хромон-3-к арбоксамидо)-2-(4-оксифенил)ацетамидо I
-7oL-метокси-.3-ацетоксиметил-3-цефем-4-карбоновая кислота.
Сол