Способ получения производных цефалоспорина
Иллюстрации
Показать всеРеферат
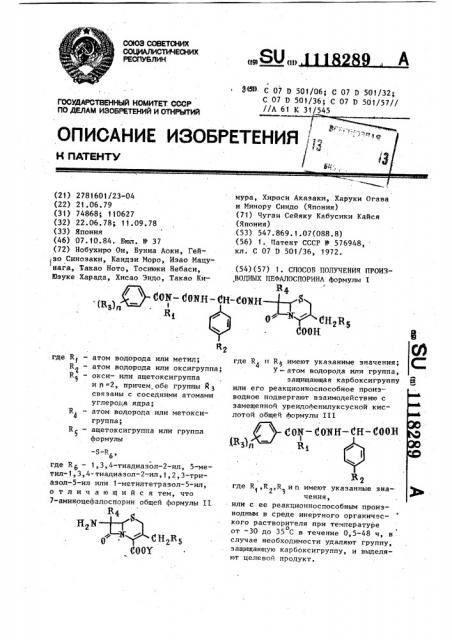
1. СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФАЛОСПОРИНА формулы I «4 (ONH-f-rN 0 y(lH,R, где R. и R имеют указанные значения; У - атом водорода или группа, защищающая карбоксигруппу или его реакционноспособное производное подвергают взаимодействию с замещенной уреидофенилуксусной кислотой общей формулы III /Л-сок-сокн-сн-Соон Ki где R ,R.,R и п имеют указанные значения , или с ее реакционноспособным производным в среде инертного органического растворителя при Температуре от -30 до 35 С в течение 0,5-48 ч, в случае необходимости удаляют группу, защищающую карбоксигруппу, и выделяют целевой продукт.
С0503 СОВЕТСНИХ
СОЦИАЛИС П 5ЧЕСНИХ
РЕСПУБЛИН (1% (11) ® 0®Н — СН-С03Н
/ (В,)„—
Я Н2В
С00Н.где R5
1 р
R
Н2М Р5
600У
-«Ь
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТНРЫТИЙ (21) 2781601/23-04 (22) 21.06.79 (31) 74868; 110627 (32) 22.06.78; 11.09.78 (33) Япония (46) 07.10.84. Бюл. 5(37 (72) Нобухиро Ои, Буниа Аоки, Гей зо Синозаки, Кандзи Моро, Изао Мацунага, Хакао Ното, Тосиюки Небаси, 50зуке Харада, Хисао Эндо, Такао Киатом водорода или метил, атом водорода или оксигруппа; окси- или ацетоксигруппа и и =2, причем„обе группы Й З связаны с соседними атомами углерода ядра; атом водорода или метоксигруппа; ацетоксигруппа или группа формулы
-S-R
6 где R б — 1,3,4"тиадиазол-2-ил, 5-метил-1,3,4-тиадиазол-2-.ил,5,2,3-триазол-5-ил или 1-метилтетразол-5-ил, отличающийся тем, что
7-аминоцефалоспорин общей формулы II
Э(51 С 07 Р 501/061 С 07 D 505/32;
С 07 0 501/36; С 07 D 501/57//
//А 61 К 31/545 мура, Хироси Аказаки, Харуки Огана и Минору Синдо (Япония) (7i) Чугаи Сейяку Кабусики Кайся (Япония) (53) 547.869.1.07(088.8) (Ьб) 1. Патент СССР Р 576948, кл. С 07 D 501/36, 1972. (54) (57) 1. СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФАЛОСПОРИНА формулы Т
В где И4 и R> имеют указанные значения;
У - атом водорода или группа, защищающая карбоксигруппу или его реакционноспособное производное подвергают взаимодействию с замещенной уреидофенилуксусной кислотой общей формулы III (,0К- CONH — СН- 400Н (в,)„— где 5(,К2,R и и имеют указанные значения, или с ее реакционноспособным производным в среде инертного органического растворителя при температуре о от -30 до 35 С в течение 0,5-48 ч, в случае необходимости удаляют группу, защищающую карбоксигруппу, и выделяют целевой продукт.
1118289
-S-К б где R - 1,3,4-тиадиазол-2-ил,5-ме- тил-1,3,4-тиадиазол-2-ил, 1,2,3триазол- 5- ил или 1-метилтетразол
-5 -ил . из водным 2-амико-2- (n-оксифенил) уксусной кислоты И .
Целью изобретения является. получение новых антибиотиков цефалоспори. нового ряда, расширяющих арсенал средств воздействия на живой организм.
Эта цель достигается основанным на известной реакции ацилирования
7-аминоцефалоспоринов предлагаемым способом получения производных цефалоспорина формулы е
СОИ- 49зн - 6н-с63н
Кф
®д .Я !
Oi
Кд
CHER j
С00Е где Кб - 1,3,4-тиадиазол-2-mI 5метил-1,3,4-тиадиаэол-2-ил, 1,2,3триазол-5-ил или 1-метилтетразол-5-ил, заключающимся B "гом, %TO 7-аминоцефалоспорин общей формулы
Eq иНс,е-ф
СИ285 Р
2. Способ по п. 1, о т л и ч аю шийся тем, что в качестве реакционноспосабного производного эамещейной уреидофеннлуксусной кислоты общей формулы III используют ее ангидрид, сложный эфир или амид.
Приоритет по признакам:
22.06.78 при Кф — метил
R — атом водорода нли оксигруппа;
R — оксигруппа н и 2
3 ф оксигруппы находятся в положений 3,4;
К4 атом ВОДОрода3
R, — 1-метилтетразол-5В: илтиометил;
11.09.78 при R — атом водорода или метил;
Изобретение относится к способам получения новых антибиотиков цефалоспоринового ряда, которые могут най" ти применение в качестве лекарственных средств в медицине. 5
Известен способ получения биологически активных производных ?-(2енино. 2- (n-о к сиф енин) сне теннис) -3( (1,2,3-триазол-S-ил)тиометил)-3цефем-4-карбоновой кислоты ацилиро- ®О ванием соответствующего 7-аминоцефалоспорина реакционноспособным про где К вЂ” атом водорода, или метил;
R - атом водорода или окси2 группа;
К,ф — окси- или ацетоксигруппа и п 2, причем обе группы Rq связаны с соседними атомами углерода ядра;
R4 — атом водорода или метоксигруппа;
R — ацетоксигруппа или группа формулы
8 R6
R - атом водорода или оксигруппа;
Rg — окси или ацетоксигруппа и и 2, причем обе группы К,, связаны с соседнйми атомами углерода ядра;
R - атом водорода или метоксигруппа;.
R:. — ацетоксигруппа или
5 группа формулы
1118289
Э где В. и R < имеют указанные значения;
У вЂ” атом водорода или группа защищающая карбоксигруппу или его реакционноспособное производное подвергают взаимодействию с эамещенной уреидофенилуксусной кислотой общей формулы
gpss- щин-6н-600H 1о
<® )п !
1 где 11„,R,,К и а имеют указанные значения, или с ее реакционноспособным производным в среде инертного органического растворителя при температуре 20 от -30 до 35 С в течение 0,5-48 ч, о в случае необходимости удаляют группу, защищающую карбоксигруппу, и выделяют целевой продукт, В качестве реакционноспособного 25 производного замещенной уреидофенилуксусной кислоты общей формулы
LII используют ее ангидрид, сложный эфир или амид., 30
Реакционноспособное производное
7-аминоцефалоспорина формулы Х1 означает производное, в котором 7аминогруппа активирована в реакционноспособную форму, например, .введением триметилсилильной группы в 7аминогруппу.
Когда соединение формулы II имеет защищающую группу У, то примерами такой группы могут быть группы, 40 образующие сложный эфир с карбоксильной группой, такие как триметилсилильная или бензгидрильная группы.
Связанная с карбоксильной группой триметилсилильная группа легко уда- 45 ляевся при обработке водой или спиртом, бензгидрильная группа легко удаляется с помощью трифторуксусной кислоты. Другими примерами защищающей группы У являются органические $0 или неорганические основания, способные образовывать соли с карбок,сильной группой, такие как щелочные, щелочноземельные металлы или третйчные амины, такие как триэтиламин, Й
N"метилпиперидин, N-метилморфолин или пиридин. Основания, образующие соли, удаляются обработкой кислотой.
Реакционноспособное производной замещенной уреидофенилуксусной кислоты формулы III означает производное этой кислоты, в которой карбоксильная группа активирована для реак ции. Примерами таких производных являются ангидрид, реакционноспособный сложный эфир или амид. Ангидрид может быть сметанным ангидридом с алифатическими карбоновыми кислотами, такими как пивалоиловая, трихлоруксусная или пентановая кислоты; с алкилкарбонатом, с фенилфорсфорной кислотой, с ароматической карбоновой кислотой, эфир может быть таким как
1-оксибензотриазолильнь1й, 2,4-динитрофенильный, Н-оксисукцинимидный, N-оксифтапимидный, пентахлорфенильный, фенилазофенильный цианометильный, или метоксиметильный эфиры.
Амид может быть таким, как амид с имидазолом, триазолом или .тетразолоИ
Когда используют соединение. формулы II, в котором У является защищающей группой для карбоксильной группы, реакция образования амида может быть проведена более эффективно при использовании конденсирующего агента, такого как карбодиимид на-!
Э. пример N,N -дициклогексилкарбодиимиц.
N,N --диэтилкарбодиимид, Нциклогек1 сил-N -морофолиноэтилкарбодиимид или N,N-диизопропилкарбодиимид, предварительно не превращая замещенную уреидофенилуксусную кислоту в ее реакционноспособное производное.
Реакция образования амида обычно проводится в среде растворителя, в частности используют инертный орга-. нический растворитель, такой как ацетон, тетрагидрофуран, диметилформамид, пиридин, ацетонитрил, диоксан, хлороформ, дихлорметан или этилацетат.. Смешивающиеся с водой растворители могут использоваться в виде водяных смесей.
Хотя реакцию обычно проводят при охлаждении или при окружающей температуре, ее можно проводить при нагреве, в зависимости от взятых реагентов. Обычно температура изменяется от -30 до 35 С,.предпочтительно о от -20 до 20 С. Хотя время реакции изменяется в зависимости от темпера-, туры, используемых реагентов и растворителя, оно может изменяться от нескольких десятков минут до нескольких десятков часов. Обычно оно
1 18289 составляет от 0,5 до 48 ч, предпочтительно 1-24 ч.
Выделение целевого соеди::ения из реакционной смеси может быть осуществлено, например, экстракцией органи- 5 ческим растворителем (таким, как дихлорметан, хлороформ или этилацетат), хроматографией на силикагеле с помощью ионообмениых смол, сшитых декстринов, высокопористых полимеров стирола или сложного эфира акриловой кислоты.
Оптический изомер, например D- или
L-изомер целевого сбединения формулы L, может быть получен при исполь- È зовании оптически активного исходного соединения, такого как ц -аминофенилуксусная кислота или замещенная уреидофенилуксусная кислота.
Целевые соединения можно смеши- 20 вать в рецептуры с различными фармацевтическими препаратами, приспособлениями для различных вариантов введения фармацевтических композиций для людей или животных. Препараты получают, используя фармацевтические носители, разбавители и/или эксципиенты.
В частности, для инъекции могут смешиваться эмульсии, растворы или суспензии в воде или масле, также используют суппозитории, такие как масло какао или другие глицериды.
Содержание активного соединения
35 изменяется в зависимости от способа введения, но обычно превышает 0,1Х как, например, 5-99Х, предпочтительно 10-60Х.
Вводимое количество для людей обычно составляет 100-3000 кг в день для взрослых. Предпочтительной суточной дозой для взрослых является
500-2000 мг, хотя это количество может изменяться в зависимости от .веса тела, возраста, симптома, способа или частоты введения.
При получении предлагаемых соединений тонкослойную хроматографию производят с использованием в ка честве носителя силикагеля 60F 5q (предварительно покрытые пластйнки производства фирмы "Е.Меркк", г. Дармштадт); в качестве проявителя используют смеси этилацетат-этанол-уксусная кислота (25:5: 1 по объему), этилацетат-этанол-уксусная кислота-вода (10:4.2:1 по объему).
Пример 1, Стадия 1, Раствор 6,04 г триэтиламина в сухом дихлорметане (20 мл) прибавляют по каплям при комнатной температуре к раствору Н-метил-3,4диацетоксибензамида (15,0 r) и триметилсилилхлорида (6,49) в сухом дихлорметане (?О мл). После кипячения смеси с обратным холодильником в течение 30 мин в смесь добавляют раствор (82 мл) фосгена(42-мл) в сухом дихлорметане при температуо ре от -5 до 5 С с последующим постепенным доведением температуры смеси до комнатной. Избыток фосгена и используемого растворителя удаляют выпариванием при пониженном давлении, получая неочищенный N-(3,4-диацетоксибензоил)-N-метилкарбамоилхлорид.
Продукт растворяют в холодном высушенном дихлорметане (50 мл) и, после удаления нерастворимых веществ фильтрацией, раствор готов для последующей реакции.
Стадия 2. N,O-бис-(Триметилсилил)ацетамид (44,3 мл) добавляют к суспензии D/-/феннлглицина (14,0 r) в высушенном дихлорметане (150 мл) при комнатной температуре с последующим перемешиванием смеси до ее однородности. К этой смеси по каплям добавляют при перемешивании раствор
N-(3,4-диацетоксибензоил)-N-метилкарбамоилхлорида в высушенном дихлор-, метане, предварительно полученный на стадии 1. После перемешивания в течение 1,5 ч при 5-10 С смесь упа0 ривают досуха при комнатной температуре при пониженном давлении и после добавления к остатку высушенного метанола смесь снова упаривают досуха при тех же условиях.
Этилацетат (500 мл) и холодный н. раствор соляной кислоты до- . бавляют к остатку, органический слой выделяют. Этот слой промывают. холодным насыщенным водным раствором хлористого натрия (500 мл) и трижды экстрагируют холодным насыщенным водным раствором бикарбоната натрия (общее количество 100 мл). Водный слой вьщеляют, промывают этилацетатом (100 мл). Устанавливают рН водного слоя 2,5 посредством 2 н. раствора соляной кислоты и экстрагируют
500 мл этилацетата. Выделенный органический слой промывают холодным насыщенным водным раствором хлорис1118289 того натрия, высушивают над безводным сульфатом натрия и выпаривают насухо при пониженном давлении, получая
15,0 г D/-/-oL-(3-(3,4-диацетоксибензоил)-3-метил-1-уреидо) -фенил- 5 уксусную кислоту в виде белого порошка. Тонкослойная хроматография (ТСХ):
Rf 0,52, проявитель I.
ИК-спектр: KBrl„д„ см "; 3700,2400, 1775, 3740, 1700, 1510.
Спектр-ЯМР: (DNCO-dg, 60 мГц), g Гмлн.доли): 2,29 (6Н, синглет);
3, 12 (ЗН, синглет); 5,5 (1Н, дуп" лет, Т = 7 Гц); 7,2-7,6 (8Н, муль- 15 типлет); 9,65 (1Н, дуплет, T=7 Гц).
Указанное соединение получают также следующим способом.
К смеси тетрагидрофурана (50 мл), триметилсилилхлорида (7 r) и D/-/- (3- метил-1-óðåèäî)фенилуксусной кислоты (6,4 г), полученной взаимодействием D((-(-фенилглицина и метилизоцианата, по каплям добавляют 6,4 r триэтиламина при температуре ниже
1О С и перемешивают. По окончании о добавления смесь перемешивают при о
40-50 С в течение 1 ч и охлаждают до температуры ниже 10 С. К смеси о по каплям добавляют раствор 7,9 г Зр
3,4-диацетоксибензоилхлорида в 20 мл тетрагидрофурана, а затем смесь перемешивают 2 ч при 50 С. После охо лаждения до температуры ниже 10 С к о смеси добавляют небольшое количество метанола и нерастворимые вещества удаляли фильтрацией. Фильтрат выпаривают насухо при комнатной температуре и пониженном давлении и остаток очищают хроматографически на ко- 4р лонке с силикагелем (Иакоое1 С-200, производство фирмы "Мако Уипуаки К.К.", Япония), используя 3-4 метанола в хлороформе. Получают 5 г продукта в виде белого порошка. 45
Стадия 3. К раствору Dl-/-К-P,4диацетоксибензоил)-3-метил-I-уреидо( фенилуксусной кислоты (2,0 r) в метаноле (20 мл) по каплям добавляют
4 мл 29 -ного водного аммиака при охлаждении ледяной водой. Смесь перемешивают в течение 30 мин ее темР пература постепенно доходит до комнатной, затем смесь концентрируют при комнатной температуре и понижен- ном давлении. К остатку добавляют
100 мл этилацетата и 70 мл холодного насыщенного водного раствора би8 карбоната натрия. рН водного раствора доводят до 8,5. Водный слой отделяют и после доведения его pH до
2,5 с помощью холодного 2 н. раствора соляной кислоты экстрагируют
200 мл этилацетата. Отделенный органический слой промывают холодным насыщенным водным раствором хлористого натрия, высушивают над безводным сульфатом натрия и выпаривают при пониженном давлении, получая (1,3 r) D-/-/ -ф-(3-(3,4-диоксибензоил)-3-метил-1-уреидо) фенилуксусную кислоту в виде белого порошка.
Стадия 4. Э/-/ -gL-(3-(3,4-Чиоксибензоил)-3-метил-1-уреидо) -А-фенилуксусную кислоту (4,0 г), полностью высушенную над пятиокисью фосфора, растворяют в высушенном тетрагидрофуране (60 мл), содержащем 1,57 r
1-оксибензотриазола. К этому раствору по каплям добавляют 20 мл раствора N,N -дициклогексилкарбоксиди1 имида (2,87 г) в высушенном тетрагидрофуране при 0 С на ледяной бане в
0 атмосфере азота. Перемешивание продолжают, в то время как температура смеси постепенно поднимается до комнатной в течение 2 ч и образовавI шийся осадок N,N -циклогексилмочевины отделяют фильтрацией. Фильтрат, содержащий 1-бензотриазольный эфир.
D/-(-g-(3-(3,4-диоксибензоил)-3 метил-1-.уреидо) фенилуксусной кислоты, готов для последующей реакции.
Стадия 5. D,Î-бис(Триметилсилил) ацетамид (11,5 мл) добавляют в атмосфере азота при комнатной температуре к суспензии 7-амино-3-ацетоксиметил-3-цефем-4-карбоновой кислоты (6,32 r) в высушенном дихлор-. метане (100 мл) с последующим перемешиванием смеси до тех пор, пока она станет однородной. К этому раствору по каплям добавляют весь раствор в тетрагидрофуране, предваритель но полученный на стадии 4, в то же время поддерживая температуру смеси между 5 и 10 С, с последующим пео ремешиванием в,течение 8 ч. Затем смесь выпаривают досуха при комнатной температуре, пониженном давлении и после добавления высушенного метанола к остатку снова выпаривают насухо при пониженном давлении.
К остатку добавляют !00 мл этилаце.— тата, холодный насыщенный раствор бикарбоната натрия (150 мл) и смесь
1,118289
10 тщательно перемешивают. После удаления нерастворенных веществ посред. ством фильтрации,рН фильтрата доводят приблизительно до 1 0 холодным
2 н. раствором соляйой кислоты. Оса- 5 док выделяют фильтрацией, промывают водой (100 мл) и растворяют в ацетоне (70 мл). Раствор обрабатывают активированным костным углем и выпаривают .насухо при комнатной температуре и пониженном давлении. К остатку добавляют 5 мл ацетона и смесь обрабатывают 50 мл диэтиловогс эфира, получая 3,5 г 7-(О(-)- -(3(3,4-диоксибензоил)-З-метил-1-уре- 15
anoJo!-фенипвцетвмидо1-3-вцетоксиметил-3-цефем-4-карбоновой кислоты (соединение А) в виде светло-желтых аморфных кристаллов.
- ТСХ: Rf 0,45, проявитель II. 20
ИК-спектр: КВгу „ см . 37002300, 1775, 1675 1520.
Спектр ЯМР (DNCO-d>, 60 мГц), 0 (млн.доли)г 2,02 (ЗН, синглет);
3, 12 (ЗН, синглет); 3,47 (2Н, шир.син25 глет); 4„7-5, 2 (ЗН, мультиплет);
5,5-5,9 (2Н, мультиплет); 6,8-7,6 (8Н, мультиплет).
УФ-спектр (Е ОН) 9 „,„нм: 265, 290 (йлечо).
Цветная реакций с хлорным железом — положительная (темно-зеленое окрашивание). . а) Описанную методику повторяют с тем исключением, что получают про- межуточное соединение — D/-/-Ы- (3(3,4-диацетоксибензоил)-3-метил-1уреидо -g;(4-оксифенил)уксусную кислоту, которая имеет следующие характеристики:
ТСХ: Rf 0,51, проявитель I.
ИК-спектр: КВгу о„ см : 3700- .
2300, 1770, 1740, 1700-1680, 1510.
ЯМР-спектр: (1ЖСО-d, 60 мГц), 45
О (млн.доли): 2,2 (6Н, синглет):
3,12 (ЗН синглет); 5,23 (1Н, дуплет, Т вк 7 Гц); 6,6-7,6 (7Н, мультиплет):
9,50 (1Н, дуплет„ Т = 7 Гц); и в результате получают 7-jD(")-М- (3(3,4-диоксибензоил)-3-метил-1-уре" . идо) 9-(4-оксифенил) ацетамидо Зацетоксиметил-g-3-цефем-4-карбоновую кислоту (соединение Б) в виде светложелтых аморфных кристаллов. 55
ТСХ: Rf 0,42, проявитель II..
ИК-спектр, КВг,1, см : 37002300, 1775, 1675, 1510.
ЯМР-спектр (DNCO-сГ!- 60 мГц), 3(млн.доли): 2,01 (ÇH, синглет);
3,19 (ЗН сйнглет): 3.5 (2Н, шип.синглет); 4,80-5,15 (ÇH, мультиплет);
5,5-6,1 (2Н, мультиплет); 6,7-7,6 (7Н. мультиплет).
УФ-спектр (EtOH) А„д нм.: 267, 292 (плечо).
Цветная реакция с хлорным железом положительная (темно-зеленое окрашивание). б) D/-/-ф- j3-(3,4-Диоксибензоил)3-метил-1-УРецдо1беиилтксрснвв кислота, полф енная на стадии 3, взаимодействует с 7-амино-3-(5-метилi,3,4-тиадиазол-2-илтиометил)-3-цефем-4-карбоновой кислотой по описан» ному способу с образованием 7-(Э(-)g-(З-(З,4-диоксибензол)-3-метил-1уреидо) -с -фенилацетамида 3-(5-метил.
1,3,4-тиадиазол-2-илтиометил)-3-цефем-4-карбоновой кислоты (соединение В) в виде светло-желтых аморф- ных кристаллов.
ТСХ: Rf 0,40, проявитель II.
ИК-спектр, KBr:асмо„„ см : 37002300, 1775, 1680, 1515.
ЯМР-спектр: (РМСО-d6, 60 мГц), о(млн.доли): 2,69 (ÇH, синглет)
3,19 (ÇH; синглет) 3,68 (2Н, шир. синглет); 4,4 (2Н, шир. синглет);
5,04 (1Н, дуплет, Т = 5 Гц); 5,66, 1 (2Н, мультиплет); 6,9-7,7 (8Н, мультиплет)., УФ-спектр {P>OH), Q>>< нм. "272.
Цветная реакция с хлорным железом положительная (темное,окруашивцние). в) По описанной методике D (-j-g3-(3,4-оксибензоил)-З-метил-1-уреидо) -Ф;(4-оксифенил)уксусная кислота взаимодействует с 7-амино-3-(5-метил-1,3,4-тиадиазол-2-илтиометил)3-цефем-4-карбоновой кислотой да1 ввв 7-(б(-)-Ц-(3-/З,б-диоксибензоил/-3-метил-1-уреидо)-ц .- (4-оксифеии) еце твмццо1 -3- (б-метил-!, у, б-т и-: азол-2-илтиометрил)-3-цефем-4-карбо. новую кислоту (соединение Г) в видесветло-желтых аморфных кристаллов.
ТСХ: Rf 0,39, проявитель II.
ИК-спектр, КВг:4 м „, см1: 3700-.
2300,,1775, 1680, 1510.
ЯМР-спектр (DNCO-d ), 8 (млн.доли): 2,70 (ЗН, синглет); 3,18 (ÇH, синглет); 3,7 (2Н, шир. синглет), 4,4 (2Н, шир.); 5,05 (IH, дуплет, Т 5 Гц); 5,5-6,0 (2Н, мультиплет)1
6,7-7,5 (7Н, мультиплет).
1 1.18289
11 уе-спектр (EbOH). t(„„ HM
280 (плечо).
Цветная реакция с хлорным железомположительная (темно-зеленое окрашивзние). 5 г) D(-) —.g-(З-(3,4-Диоксибензоил)3-метилуреидо1 фенилуксусную кислоту подвергают взаимодействию с 7-амино-3-(1-метил-1Н-татразол-5-илтиометил)-3-цефем-4-карбоновой кислотой тем же способом, что и в примере 1, получая 7-(D(-)-Ц-(3-(3,4-диоксибензоил)-3-метил-1-уреидо)-g-фенилацетамидо) -3-(1-метил-1Н-тетразол5-илтиометил)-3-цефем-4-карбоновую кислоту (соединением Д) в виде светло-желтых аморфных кристаллов.
ТСХ: Rf 0,40, проявитель II.
ИК-спектр, KBr: щд„, см : 37002300, 1775, 1680, 1615.
ЯМР-спектр (DMCO-d<),S (млн.доли): 3,10 (ЗН, синглет); 3,6 (2Н, шир.); 3,93 (ЗН, синглет); 4,31 (2Н, шир. синглет); 5,1 (1Н, дуплет, Т = 5 Гц); 5,4-5,8 (2Н, мультиплет);
6,8-7,6 (8Н, мультиплет).
УФ-спектр (Е ОН), 4„,д„с, нм: 265, 285 (плечо).
Цветная реакция с хлорным железом - положительная (темно-зеленое 30 ,окрашивание), д) По методике, изложенной в примере 1, подвергают взаимодействию
D(-)-g.-(З-(3,4-диоксибензоил)-Зметил-1-уреидо) -А-(4-оксифенил) уксусную кислоту с 7-амино-3-(1метил-1Н-тетразол-5-илтиометил)-3цейем-4-карбоновой кислотой, получая
7- jD (-) -а- (3-(3, 4-диск сибекзо ил)3-метил-1-уреидо) -с(;(4-оксифенил) ацетамидо)-3-(1-метил-1Н-тетразол5-илтиометил)-3-цефем-4-карбоновую кислоту (соединение Е) в виде светложелтых аморфных кристаллов.
ТСХ: Rf 0,39, проявитель II.
ИК-спектр, KBr 4 „, см : 37002300, 1770, 1675, 1510.
ЯМР-спектр (DMCO-dg), 3 (млн.доли); 3,11 (ЗН, синглет); 3,6 (2Н, шир.); 3,95 (3H, синглет), 4,31 (2Н, шир. синглет), 5,1 (1Н, дуплет Т = 5 Гц); 5,3-5,9 (2Н, мультиплет): 6.5-7,5 (7Н, мультиплет).
УФ-спектр (Е ОН), д„„, нм: 265, 280 (плечо), 290 (плечо).
Цветная реакция с хлорным железом — положительная (темно-зеленое окрашивание). е) D (-)-ф-(3-(3,4-Диоксибензоил)
3-метил-1-уреидо фенилуксусную кислоту подвергают взаимодействию с 7-: амино-З(1,3,4-тиадиазол-2-илтиометил)-3-цефем-4-карбоновой кислотой таким же образом, как в примере 1, получая 7-(Р (-)-с(- (3-(3,4-диоксибензоил)-3-метил-1-урендо) -а(-фенилацетамидо) -3-(1, 3,4-тиадиазол-2илтиометил)-3-цефем-4-карбоновую кислоту (соединение Х) в виде светло-желтых аморфных кристаллов °
ТСХ: Rf 0,50, проявитель II.
ИК-спектр, KBr, „,, см: 37002300, 1775, 1680, 1520.
ЯМР-спектр (DMCO-d6),(3 (млн.доли): 3,17 (ЗН, синглет); 3,7 (2Н, шир.); 4;5 (2Н, шир.); 5,04 (1Н, дуплет, Т = 5 Гц); 5,6-6,0 (2Н, мультиплет), 6,9-7,7 (ЗН, мультиплет), 9.36 (1Н, синглет).
УФ-спектр (Е ОН) 7(и с, нм. 268.
Цветная реакция с хлорным железом — положительная (темно-зеленое окрашивание). ж) D (-)-(4-(3-(3,4-Диоксибензоил)
3- метил-1-уреидо) -()(,-(4-оксифенил) уксусную Кислоту подвергают взаимодействию, как в примере 1, с 7анно-3 -(1,3,4-тиадиазол-2-илтиометил)-3-цефем-4-карбоновой кислотой, получая 7-f()(-)-g- (3-(3,4-диокси— бензоил)-3-метил-1- реидо) -C, †(4оксифенил)ацетамидо -3-(1,3,4-тиадиазол-2-илтиометил -3-цефем-4-карбоновую кислоту (соединение 3) в виде светло-желтых аморфных кристал,лов.
ТСХ: Rf 0,38, проявитель II.
ИК-спектр, KBr31(„, см: 37002300, 1775, 1680, 1510.
ЯМР-спектр (DMCO-d6),6 (млн.доли): 3, 18 (ЗН, синглет); 3,7 (2H, шир.синглет); 4,5 (2Н, шир.); 5,05 (1Н, дуплет, Т = 5 Гц); 5,5-6,0 (2Н, мультиплет); 6,7-7,5 (7Н, мультиплет); 8,37 (1Н, синглет).
УФ-спектр (Е ОН)((,„, нм . 270, 280 (плечо).
Цветная реакция с хлорным железом положительная (темно-зеленое окрашивание) .
3) D (-)-()(-(3-(3,4-Диоксибензоил)3-метил-1-уреидо) -4-(4-оксифенил) уксусную кислоту подвергают взаимодействию, как в примере 1, с 7-амино-3-(1,2,3-триазол-5-илтиометил)-3цефем-4-карбоновой кислотой, полу89 1а
Стадия: 2. N,О-бис (Триметилсилил) ацетамид (19 мл} по каплям добавляют при комнатной температуре к суспен- . зии D(-)-фенилглицина (5,3 r) в высу1пенном дихлорметане (100 мл) при комнатной температуре с последующим перемешиванием до тех пор, нока смесь не станет однородной."К прозрачному раствору при 5-100Ñ rto каплям до-. бавляют раствор, предварительно полученный на стадии 1. После перемешивания смеси в течение 1,5 ч при той же температуре смесь выпаривают насухо при комнатной температуре и пониженном давлении. К остатку добавляют высушенный метанол и выпаривают насухо при пониженном давлении.
К остатку добавляют холодный разбавленный водный раствор соляной кислоты (200 мл), и смесь перемешивают
5 - 10 мин. Полученный белый осадок собирают фильтрацией и растворяют в холодном насыщенном водном растворе бикарбоната натрия (250 мл). Нерастворимые вещества удаляют фильтрацией.
Фильтрат промывают 250 мл этилацетата после доведения его рН приблизительно до 1,0 с помощью холодной соляной кислоты (2 н. раствор). Образовавшийся белый осадок собирают фильтрацией, промывают водой, затем диэтиловым эфиром и высушивают на воздухе, получая 4,5 D-(-)-p(- (3(2,3-диацетоксибензоил)-1-уреидо)фенилуксусную кислоту в виде белого порошка. T.пл. 200-201 С (разл).
Вычислено, %: С 57,97; Н 4,38
8 6,76 012{8 «1 08
Найдено, %: С 57,64„ H 4,39;
,М 6,65.
Стадия 3. D(-)-К- (3-(",3-) иацетоксибензоил) -1-уреидо) фенилуксусную кислоту (2,0 r) суспендируют в метаноле (20 мл) и к суспензни по каплям добавляют 2,5 мл 29%-ного водного аммиака при охлаждении ледяной водой.
Смесь перемешивают при 5-10 С в тео чение 30 мин и концентрируют при комнатйой температуре и пониженном давлении. К остатку добавляют 50 мл этнлацетата и 100 мл холодного касыщенного раствора бикарбоната натрия в воде. Водный слой отделяют и после удаления нерастворимых веществ фильтрацией доводят его рН приблизительно до 2,5 с помощью холодной 2 н. соляной кислоты. Полученный белый
TIpимер2.
Стадия 1. Оксалилхлорид (5,3 г)
45 прибавляют к раствору 4,0 r 2,3диацетоксибенэамида в 1,2-дихлорэтане (40 мл) при перемешивании и охлаядении. Смесь постепенно нагревают до температуры кипения и оставляют взаимодействовать при кипячении с обратным холодильником в течение 10 ч. Зате(растворитель и избыток оксалилхлорида отгоняют при пониженном давлении и получают 2,3диацетоксибензоилиэоцианат, который растворяют в высушенном дихлорметане (40 мл) для последующей реакции.
13 11182 чая 7-ф}(-)+ (3-(3,4-диоксибензоил)3-метил-1-рреццо) -)е-(е-оисифеиил) . .ацетамило) -3(1,2,3-триаеол-3-илтиометил)-3-цефем-4-карбонавую кислоту {соединение И} в виде светло- 5 желтого порошка.
TCX: Rf 0,39, проявитель II.
ИК-спектр, KBr, {1(ю)кс, см : 3700Л
2300, -1770,, 1680, 1515. 1 щрр спектр (DNCG dg) S (млн доли) . О
3, 11 (ЗН, синглет); 3 3 6 (2Н, шир. синглет 60 МГц); 3,95 (2Н, шир. син-, глет); 5,03 (1Í, дуплет Т = 5 Гц);
5,4-5,9 (2Н, мультиплет); 6,6-7,5 (7Н, мультиплет; 7,95 (1H, синглет).
УФ-спектр (K OH),1)I : нм". 272, 280 (плечо).
Цветная реакция, с хлорным желе зом — положительная (темно-зеленое окрашивание)., 20 н) D (-)-g/3-(3,4-Диацетоксибензоил)-3-метил-1-уреидо) -а-(4-оксифенил)уксусную кислоту подвергают взаимодействию, как в примере 1, с
7-амико-3-(1,2,3-триазол-5-илтиометил)-3-цефем-4-карбоновой кислотой, лоптчая 7-{Ъ (-)-,ql-(3-(3;А-Лиацетоиси бензоил)-3-метил-1-уреидо)-а- (4-ок- . о ифеиил) ацетамипо{ -3- (1, 2, 3-триаеол5-илтиометил)-3-цефем-4-карбоновую 30 кислоту (соединение И) в виде светло.желтого порошка.
ТСХ: Rf 0,40, проявитель II
ИК-спектр, KBr 4 o с см . 37002300, 1770, 1760, 1680, 1510.
ЯМР-спектр (ацетон-d6, 60 МГц)3 (млн.доли): 2,26 (бН, синглет);
3,20 (ЗН, синглет); 3,6 (2Н, шир,);
4,.1 (2Н, шир.); 5,01 (1Н, дуплет, Т = 5 Гц); 5,5-6,0 (2Н, мультиплет); 4б
6,7-7,7 (7Н, мультиплет); 7,86 (1Н, синглет);
УФ-спектр (Е 1Н)Ь„ ц„- нм: 268.
1118289
16 растворенных веществ фильтрацией рН водного слоя доводят приблизительно до 1,0 с помощью холодной 2 н. соляной кислоты. Осадки выделяют фильтрацией, промывают водой (100 мл) и, растворяют в ацетоне {150 мл). Раствор обрабатывают активизированным костным углем и выпаривают насухо при комнатной температуре и пониженном давлении, Остаток обрабатывают 70 мп диэтилового эфира, получая
4,0 r 7-fD(-)-Ф-(3-(2,3-диоксибензоил) -1-уреидо) -д-феииладетамидо —
3-(.1-метил-1Н-тетразол-5-илтиометил) .
3-цефем-4-карбоновой кислоты (вещество К) в виде светло-желтого порошка.
ТСХ: Rf 0,38, проявитель II..
ИК-спектр, КВг,lùä„ см : 37002300,, 1775, 1680, 1530, 1490.
ЯМР-спектр (ацетон-Д ),8 (млн,доли): 3,7 {2Н, шир.); 3,96 (ÇH, синглет); 4,37 (2Н, шир. синглет);
5,05 (1Н, дуплет, Т = 5 Гц); 5,66,0 (2Н, мультиплет); 6,8-7,7 (8Н, мультиплет).
УФ-спектр (FqAH)A „ нм: 256, 280 (плечо), 310 (плечо).
Цветная реакция с хлорным железом — положительная (темно-зеленое окрашивание) . а) Методику, описанную в примере 2 (на стадии 1-4) повторяют с тем отличием, что используют 3,4-диацетокси бензамид вместо 2,3-диацетоксибензамида, использованного в этом при" мере на стадии 1, и получают 1-бензотриазольный эфир D(-)-o,-(3-(3,4диоксибензоил)-1-уреидо) - 6-фенилуксусноч кислоты. Этот эАир подвергают взаимодействию с 7-амино-3-(5метил-1,3,4-тиадиазол-2-илтиометил)3-цефем-4-карбоновой кислотой и обрабатывают, как в примере 2 (на стадии 5), получая 7-fD(-)-î -|3-(3,4диоксибензоил)-1-уреидо) -фениладетамидо)-З-(5метил-1,3.4-тиадиазолил-2-тиометил)-3-цефем-4-карбо- . новую кислоту (соединение Л) в виде светло-желтого порошка.
1614 g. 6
Найдено, Ж: С 55,44; Н 4,38;
N 8,03.
Стадия 4. D(-)-g-(3-(2,3-Диоксибензоил)-1-уреидо фенилуксусную кислоту (4,0 г) и i-оксибензотриа- 15 зол (1,63 г) растворяют в сухом тетрагидрофуране (100 мл) и к раствору по каплям добавляют при 0-5 С расто
l вор N,N -дициклогексилкарбодиимида (2,99 r) в 20 мл сухого тетрагидро- 20 фурана. Смесь перемешивают, в то время, как ее температура постепенно поднимается до комнатной; приблизительно через 2,5 ч осажденную дициклогексилмочевину удаляют фильтра- 25 цией. Фильтрат, содержа ций 1- бензотриазолильный эфир0(-)-(- 3-(2,3диоксибензоил)-1-уреидо)фенилуксусной кислоты, используют для последующей реакции. 30
Стадия.5. N,О-бис(Триметилсилил) ацетамид (7;8 мл) при комнатной температуре прибавляют к суспензии
7-амнно-3-(1-метил-1Н-тетразол-5илтиометил)-3-цефем-5-карбоновой кислоты (5,2 г) в 200 мл сухого
35 дихлорметана с последующим перемешиванием до тех пор, пока смесь не станет однородной. К этой однородной смеси по каплям добавляюг полугЩ ченный предварительно на стадии 4 ,тетрагидрофурановый раствор, поддерживая ее температуру 5-10 С, при о перемешивании, чтобы получился осадоК. Снова добавляют N О-бис(трир 45 метилсилил)ацетамид до тех пор, пока смесь не станет однородной„ затем перемешивание продолжают при той же температуре в течение 8 ч.
Затем смесь выпаривают насухо при
50 . комнатной температуре и пониженном . давлении и после добавления сухого метанола к .достатку, смесь снова . выпаривают насухо при пониженном давлении. К остатку добавляют 200мл этилацетата и 200 мл холодного насыщенного водного раствора бикарбоната натрия с последующим тщательным перемешиванием. После удаления нвосадбк собирают фильтрацией, промывают водой, затем диэтиловым эфиром и высушивают на воздухе, получая
1,4 г D(-)- - (3-(2,3-диоксибензоил)1-уреидо -фенилуксусную кислоту в виде белого порошка. Т.пл. 211-212 С
О (разл.) . .Вычислено, Е: С 55,17; Н 4,63;
0 8,04
С Н N0 НО 10
ТСХ: Rf 0.36, проявитель
ИК-спектр. КВг,Q „„, см : 3700-.
2200, 1770, 1675, 1525.
ЯМР-спектр (ацетон-йб),3 (млн.доли): 2,69 (ЗН, синглет); 3,72 (2Н, шир. синглет); 4.4 (2Н, шир.); 5,13 (1Н, дуплет, Т = 5 Гц); 5,5-5 9 (2Н;
289
1118
17 мультиплет); 6,8-7,7 (8Н, мульти плет);
УФ"спектр (Е,OH) g ., нм: 268, 290 (плечо).
Цветная реакция с хлорным желе- S зом - положительная (темно-зеленое окрашивание). б) D(-)-М- 3"(2,3-Диацетоксибенэоил) — 1-уреидо) -.((;фенйлуксусную кислоту, полученную в примере 2 (на стадии 2), подвергают взаимодействию с 7 амино-3-(1-метил-1Н-тетраэол-5-илтиометил) 3-цефем-4-карбоновой кислотой, как в примере 2 (на стадиях 4 и 5), получая 7-(П(-),Ж- 3-(2,3-диацетоксибензоил)-1-уреидо - ;феиилацетамидо -3-(1-метил1Н-тетразол-5-илтиометил)-3-цефем4-карбоновую кислоту (соединение М) в виде свтло-желтого порошка. 20
ИК-спектр, КВг,4м>„с, см: 37002300, 1775, 1690, 1530, 1490.
ЯМР-спектр (ацетон-d<),6 (млн.доли): 2, 28 (6Н, синглет); 3,75 (2Н, шир. синглет); 3,95 (ЗН, синглет);
4,4 (2Н, шир. синглет); 5,07 (1Н, дуплет, Т = 5 Гц); 5,6-6,0 {2H, мультиплет); 7,2-8,0 мультиплет).
ПримерЗ.
Стадия 1. Триэтиламин (10,2 г) 30 по каплям добавляют к суспензии
7-амино-3-ацетоксиметил-3-цефем-4карбоновой.кислоты (8,2 г) в сухом дихлорметане (80 мл) при комнатной температуре с последующим перемешиванием смеси в течение ЗО мин при той же температуре. Полученную смесь используют для последующих превращений.
Стадия 2. D(-)- -(3-(3,4-Диаце40 токсибензоил)-3-метил-1-уреидо — . фенилуксусную кислоту (8,6 г), полу-,,ченную по примеру 1 (на стадии 2)и пивалоилхлорид (3,0 r) растворяют в .сухом дихлорметане (40 мл), и к это45 му раствору по каплям добавляют триэтиламин (2,4 r) при температуре ниже -15 С. После перемешивания раствора при той же температуре в течение 1 ч к нему по каплям добавляют предварительно приготовлен50 ныч яа стадии 1 дихлорметановый раствор, и при температуре ниже .10 С продолжают перемешивание в течение 1-1,5 ч. Раствор выпаривают насухо при пониженном давлении и к остатку добавляют 200 мл этилацетата и холодный насыщенный водный раствор бикарбоната натрия (200 мл).!
После удаления нерастворенных веществ фильтрацией рН водного раство1 ра доводят приблизительно до 1,0, используя холодный 2 н. раствор соляной кислоты, и экстрагируют.этигацетатом (200 мл). Выделенный органический слой промывают холодным насыщенным водным раствором хлористого натрия, высушивают над безводным сульфатом магния и перегоняют при пониженном давлении, чтобы удалить использованный растворитель.
Остаток подвергают хроматографической очистке на колонке, заполненной смолой "Diaion-HP-20" (торговое наименование смолы, пригодной для фазообращенной хроматографии, производство фирмы "Мицубиси Касей Когио
Кабусики Кайся", Япония). Фракции, элиюрованные смесью метанол-вода (3: 1 по объему), собирают и перегоняют при пониженном давлении, для того чтобы удалить использованный растворителье Получили 7,0 г 7- D (-)-0|- (3-(3,4-диацетоксибензоил7-3метил-1-уреидо(-т(-еeиилацетамидо)—
3-ацетоксиметил-3-цефем-4-карбоновой кислоты (соединение Н) в виде белого порошка.
ТСХ: Rf 0,62, проявитель II.
ИК-спектр, KBr,1ìàêñ, cM" : 37002300, 1780, 1745, 1695, 1510. (ЯМР-спектр (ацетон-с 60 МГц) о -(млн.доли): 2,00 (ЗН, синглет);
2, 28 (6Н, синглет); 3, 15 (ЗН, синглет); 3,5 (2Н, шир, синглет), 4,65 3 (ЗН, мультиплет); 5 5-6,0 (2Н, мультиплет); 7,2-7,7 (8Н, мультиплет). а) По методике примера 3 7-амино-
3-ацетоксиметил-3-цефем-4-карбоновую кислоту, которую использовали после силилирования N,О-бис(триметилсилил) ацетамидом, подвергают взаимодействию с D(-)-Ы-(3-(3,4-диацетоксибензоил)-3-метил-1-уреидо) -Ж-(4-оксифенил)уксусной кислотой, полученной по примеру 1а, и обрабатывают, полу. чая 7-(ц(-)-е(- 3-(З,А-диацетоиоибензоил)-3-метил-1-уреидо)-с(;(4-оксифенил)ацетамидо -3-ацетоксиметил3-цефем-4-карбоновую кислоту (соединение О) в виде белого порошка.
Очистку осуществляют хроматографически с колонкой, заполненной силикагелем. Вместо "Diaion HP-20" элюент — смесь метанола и хлороформа (1:20 по объему).
1118289
ТСХ: Rf 0,54, проявитель II.
ИК-спектр, КВг,Э „ см : 37002300, 1775, 1740-1670, 1510.
HMP-спектр (ацетон-(1 ), S (млн. доли): 2,00 (ЗН, синглет); 2,28 (60, синглет); 3, 16 (ÇH, синглет);
3,5 (2Н, шир. синглет); 4,6-5,3 (ЗН, мультиплет); 5,5-6,1 (2Н, мультиплет); 6,7-7,7 (7Н, мультиплет). б) По методике, описанной в примере 3 (на стадиях 1 и 2), обраба;тывают П(-)-g- j3-(3,4-диацетоксибензоил)-3-метил-f-уреидо)фенилуксусную кислоту и 7-амино-3-(5-метил1,3,4-тиадиазол-2-илтиометил)-3цефем-4-карбоновую кислоту, получая 7-(0(-)-d.- (3-(3,4-диацетоксибензоил)-3-метил-1-урендо) -(С-фенилацетамидо)-3-(5-метил-1,3,4-тиадиазол-2-илтиометил)-3-цефем-4-карбоновую кислоту (соединение П); в виде светло-желтого .порошка..
ТСХ: Rf 0,50, проявитель II.
ИК-спектр: KBr3ô o, см : 37002300, 1775, 1690, 1510.
ЯМР-спектр (ацетон-d, 60 МГц) о(млн.доли): 2,28 (6Н, синглет);
2,67 (ЗН„ синглет); 3,.15 (ЗН, синглет); 3, 74 .(2Н, шир. синглет);
4,44 (2Н, АВ 5, 12 (1Н, дуплет, Т = 5 Гц); 5,6-6,0 (2Н, мультиплет);
7,2-7,7 (8Н, мультиплет). в) По описанной в примере За методике обрабатывают D(-)-g,- (3-(3,4диацетоксибензоил)-3-метил-1-уреидо)
-(4-оксифенил)уксусную кислоту и
7-амино-3-(5-метил-1,3,4-тиадиазол, 2-илтиометил)-3-цефем-4-карбоновую кислоту, получая 7- D(-)-с(- р-(3,4диацетоксибензоил)-3-метил-:I-уреидо)
-(4-оксифенил)ацетамидо)-3-(3-метил-i,3,4-тиадиазол-2-илтиометил)3-цефем-4-карбоновую кислоту (соединение Р) в виде белого порошка,, ТСХ: Rf 0,48, проявитель II.
МК-спектр, KBr,1,)4о,(см- : 37002300, 1775, 1685, 1510.
ЯМР-спектр (ацетон-d 60 МГц) б б (млн.доли): 2,28 (6Н, синглет;
2,68 (ЗН, синглет); 3,14 (ЗН, синглет); 3,65 (2Н, шир. синглет);
4,41 (2Н, АВ); 5,03 (1Н, дуплет,.
Т = 5 Гц)1 ; 5,5-6,0 (2Н, мультиплет)
6,6-7,6 (7Н, мультиплет). г) По методике, описанной в примере 3 (на стадии 1 и 2) D(-)-ос -(3(3,4-диацетоксибензоил)- 3-метил-1уреидо)фенилуксусную кислоту и 745
Н р и м е р 4. Пивалоилхлорид (1,14- r) по каплям добавляют к раствору D(-)- -13-(3,4-диоксибензоил)-3-метил-1-уреидо)-фенилуксусной кислоты (3,25 г), полученной по методике примера 1 (на стадии 3) и сухого пиридина (0,9 г) в сухом этилацетате (100 мл) при температуре от -10 до -15 С. Смесь переме.о шивают в течение 15 мин при той же температуре. К этой смеси по каплям добавляют раствор бензгидрильного эфира 7Д-амино-7-й-метокси-3-(1метил-1Н-тетразол 5-илтиометил)-3цефем-4-карбоновой кислоты (3,3 г) в сухом дихлорметане (35 мл) при температуре от -10 до -15 С. Смесь амин о-3- (1-ме тил-1 Н-тетра зол-5-илтиометил)-3-цефем-4-карбоновую кислоту обрабатывают, чтобы получить
7-(Н(-) -d- (3-(3, 4-диацетоксибенеоил)б 3-метил-1-уреидо1-d-фенилацетамидо)—
3-(1-метил-1Н-тетразол-5-илтиометил)3-цефем-4-карбоновую кислоту (соединение С) в виде белого порошка.
ТСХ: Rf 0,55, проявитель II.
ИК-спектр: KBr,1 А@),с, см : 37002300, 1775, 1690, 1510.
ЯМР-спектр (ацетон-d® 60 МГц)
5 (млн.доли): 2,27 (6Н, синглет);