Способ получения антрациклингликозидов
Иллюстрации
Показать всеРеферат
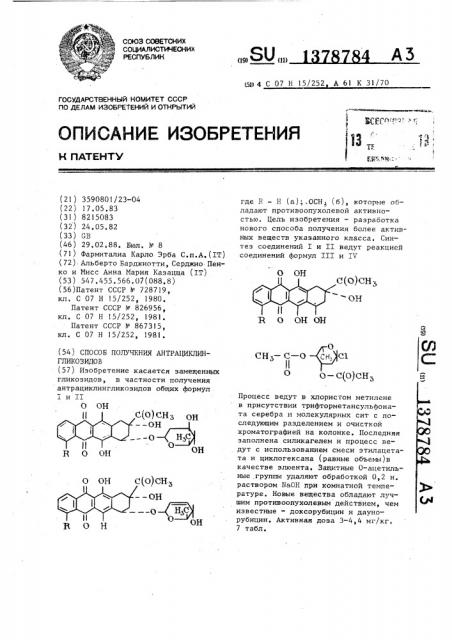
Изобретение касается замещенных гликозидов, в частности получения антрациклингликозидов общих Лормул I и II с(о)снз он --он R ОН вон с(о)снз --он --ш он где R - Н (а);,ОСН (б), которые обладают противоопухолевой активностью . Цель изобретения - разработка нового способа получения более активных веществ указанного класса. Синтез соединений I и II ведут реакцией соединений формул III и IV О ОН R О ОН ОН СНчс-о о Cri,Gl сл о 0-С(0)СНз Процесс ведут в хлористом метилене в присутствии трифторметансульфоната серебра и молекулярных сит с последующим разделением и очисткой хроматографией на колонке. Последняя заполнена силикагелем и процесс ведут с использованием смеси зтилацетата и циклогексана (равные объемы)в качестве элюента. Защитные 0-ацетильные .группы удаляют обработкой 0,2 н. раствором NaOH при комнатной температуре . Новые вещества обладают лучшим противоопухолевым действием, чем известные - доксорубицин и даунорубицин. Активная доза 3-4,4 мг/кг. 7 табл. 00 00 ч 00 4 СМ
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (19) (И) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н flATEHTY
О ОН ((o) (-H q
3, о Он 0Н сн — с — о
li
Cl
Π— С(О)СН, с(о) сн, он — -ОН
--О
ОН
R О ОН
СИ) CHç — — ОН вЂ” -о НЗС он
О OH
Я О Н
ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР пО ДелАм изОБРетений и ОтнРытий (21) 3590801/23-04 (22) 17,05,83 (31) 8215083 (32) 24.05.82 (ЗЗ) GB (46) 29,02.88. Бюл. Р 8 (71) Фармиталиа Карло Эрба С.п.А.(ХТ) (72) Альберто Барджиотти, Серджио Пенко и Мисс Анна Мария Казацца (IT) (53) 547.455.566,07(088,8) (56)Патент СССР Ь 728719, кл, С 07 Н !5/252, 1980.
Патент СССР М 826956, кл. С 07 Н 15/252, 1981, Патент СССР Р 867315 кл. С 07 Н 15/252, 1981. (54) СПОСОБ ПОЛУЧЕНИЯ АНТРАЦИКЛИНГЛИКОЗИДОВ (57) Изобретение касается замещенных гликозидов, в частности получения антрациклингликозидов общих формул и
О OH
151) 4 С 07 Н 15/252 А 61 К 31/70 где B — Н (а);.ОСН > (б), которые обладают противоопухолевой активностью. Цель изобретения — разработка нового способа получения более активных веществ указанного класса, Синтез соединений I u II ведут реакцией соединений формул III и тЧ
Процесс ведут в хлористом метилене в присутствии трифторметансульфоната серебра и молекулярных сит с последующим разделением и очисткой хроматографией на колонке. Последняя заполнена силикагелем и процесс ведут с использованием смеси этилацетата и циклогексана (равные объемы)в качестве элюента. Защитные 0-ацетильные группы удаляют обработкой 0,2 н. раствором Na0H при комнатной температуре. Новые вещества обладают лучшим противоопухолевым действием, чем известные — доксорубицин и даунорубицин. Активная доза 3-4,4 мг/кг.
7 табл.
1378784
Изобретение относится к способу получения новых антрациклингликозидов общих формул I u II
О
Il
С вЂ” CH
0 ОН.В 0 ОН
Яо Ф O
Q где Н - Н (а) и Н вЂ” ОСНз (б),обладающих противоопухолевой активностью, 30
Цель изобретения — разработка способа получения гликозидных производных антрациклина, обладающих улучшенными свойствами по сравнению с противоопухолевыми препаратами-структурными аналогами: даунорубицином и доксорубицином.
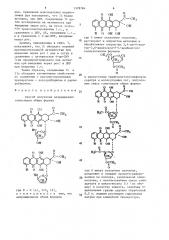
Пример 1, Получение 7-0-(2,6= дидеокси-0 .-L-арабиногексопиранозил)дауномицинона 11а1 и 7-0- (2,3,6-тридеокси-aL- 1 -эритрогекс-2-енопирано, зил)-дауномицинона (ХХа).
К раствору, содержащему 2 г дауномицинона в 200 мл безводного хло" ристого метилена, прибавляют 1,25 г
45 хлорида 3,4-ди-О-ацетил-2,6-дидеокси- -Ь-арабиногексопиранозилла, растворенные в 30 мл хлористого метилена, и 12 г молекулярных сит (4 А
"Мерк"). Смесь обрабатывают 1,28 г трифторметансульфоната серебра, раст- 50 воренными в 30 мл безводного дизтилового эфира. Через 5 мин смесь нейтрализуют прибавлением 0,65 мл безводного коллидина. После выдержки в течение 30 мин при комнатной температуре органический раствор промывают насыщенным водным раствором кислого углекислого натрия, водой, 0;1 н. водным раствором хлористоводородной кислоты и, наконец, водой. Органическую фазу отделяют и упаривают н вакууме до получения сухого остатка.
Полученный остаток подвергают очистке с помощью хроматографии ча колонке, наполненной кремневой кислотой, при применении н качестве элюирующего средства смеси этилового эфира уксусной.кислоты и циклогексана (1:l по объему). В результате порознь получают 0,9 г соединения формулы
Va, т.пл, 117-118 С, IINP (CDC1 ):
inter а1 a около 1,23 8 (d, СН -С-5 );
1,95 3 (Б, СН ГООГ); 2,07 В (S, СН СООС), 2,43 3 (Б, СНз СО); 5,20 3 (СН 7); 5 53 b(CH-1 ) и 0 9 г соединения формулы Ч?а, т.пл. 83-84 С.
Соединение формулы .Va (0,7 г) растноряли н ацетоне (45 мл) и производили обработку 50 мл 0,2 н, водного раствора гидроокиси натрия при комнатной температуре, Через 1 ч значение рН раствора доводили до 7, после чего производили экстрагирование хлороформом, После отгонки органического растворителя в вакууме получали чистое соединение la с количественным выходом, т,пл. 161lá2 С, FD-МС: m/z 528 (М ). .После обработки соединения формулы VIa в основных условиях получали в чистом ниде соединение формулы IIa т,пл.
181-182 С. FD-МС: mjz 510 (М ) II, IP (CDC1>, хп1er а1 . а около 1, 40 Р (d, СН -С-5 ), 2.,428 (S, СН, СО); 5,33 8 (СН-7)", 5,58 5 (СН-1 ) и 5,5-6,0 8 /m;
СН-2 (СН-3 ) .
Пример 2. Получение 4-деметокси-7-0-(2,6-дидеокси- -L-арабиногексопиранозил)-дауномицинона (lв) и 4-деметокси-7-0-(2,3,б-тридеоксиФ;Ь-эритрогекс-2-енопиранозил)-дауномицинона (Ila).
К раствору 0,74 г 4-деметоксидауномицинона (Illa) в безводном хлористом метилена (70 мл) прибавляют
0,65 r галогенида сахара формулы IV, растворенные н 10 мл хлористого метилена, и 5 г молекулярных сит (4 А
"Мерк"). Смесь обрабатывают 0,64 r трифторметансульфоната серебра, растворенными н 15 мл безводного диэтилового эфира. Через 5 мин реакционную смесь нейтрализуют прибавлением
0,4 мл безводного коллидина, После выдержки в течение 1 ч при комнатной температуре органический раствор
13 "Я7Я- промывают насыщенным водным раствором кислого углекислого натрия, водой, водным 0,1 и. раствором хлористоводородной кислоты и снова водой.
Органическую фазу отделяют, после чего раствор упаривали до получения сухого остатка в вакууме. Полученный в результате этого остаток подвергают очистке с помощью хроматографии на колонке, заполненной кремневой кислотой, при применении в качестве элюирующего средства смеси хлороформа и ацетона (96:4 по объему). В результате получают 0,48 г соелинео ния формулы Vb,, т.пл ° 65-66 С, ГЛ-МС: m/z (11 0,45 г соединения формулы ЧТЬ. Соединение Vh растворяют в 20 мл ацетона и производят обработку 20 мл 0,2 н. водного раствора гидроокиси натрия при комнатной температуре. Через 1 ч значение рН раствора доводят до 7 и экстрагируют хлороформом, После отгонки органического растворителя в вакууме получают чистое соединение формулы
ТЬ с количественным выходом, т.пл.
165-166 С, FD-МС: m/z 498 (М ), После обработки соединения формулы Ъ |Ь в основных условиях получали чистое соединение формулы IIh, ПМР (СТ1С1 )
inter alia около 1,39 (СН -С-5 );
2,42 8 (S, С:1з — CO), 3,50-4,00 о (m, С-Н-4 и С-Н-5 ); 4,08 8 (, СН О);
5,33 8 (bs (,"-Н-7), 5,58 б (bs С-1!-1 j, 5,65 (а, С-Н-3 ), 5,93 У(а, С-1.-2 ).
Биологическая активность соединений IIa, ХЬ.
Соединения IIa u Ib были испытаны
f в сравнении с даунорубицином ДНР) и доксорубицином (ДК) в in vitro u
in vivo системах с целью установления их цитотоксичности и противоопухолевой активности.
В табл. 1 приведены активности на
Неlа клетках, размножающихся продуктивно in vitro (обработка 24 ч).
Соединение ТТа примерно в 25 раз менее цитотоксично, чем ДНР, и в
40 раз менее цитотоксично, чем ДК.
Первичные исследования in vitro были проведены на CDF-1 мышах, страдающих асцитической Р388 лейкемией (1О клеток/мышь). Результаты представлены в табл. 2 (обработка i.ð, 1 раз в сутки). Соединения ТХа суспендировали в 10Х-ном Tween 80 и инъицировали внутрибрюшинно. Соединение ITa оказалось менее токсичным и было инертным по отношению к
Р38Я асцитической лейкемие при двухдозном .испытании, включая максимальную переносимую доэ у (МПД) l 00 мг/кт .
Соединение ТЬ было изучено in
v .tro íà Не1,". и РЗ88 лейкемических клеток чувствительных (P388 и устойчивых (РЗЯЯ/ДК) к ДК, à in v trc-10 на РЗЯЯ и Ого"-.s leukemia.. Значения. приведенные в табл. 3, показывают, «То соединения ТЬ, исследованное на
l1elа клетках, размножающихся продуктивно in -кд!;го, в сравнении с известными соединениями ДНР и 4-деметокси-)1НР (4 — дм-ДНР), в 3 и 6 раз ме= нее цитоксично, чем ДНР и 4-дм-ДНГ.
Соединение Ib было изу-чено на
РЗЯЯ/ДК п vi"ro.
Р388 и P388/ДК лейкемические клетки были отобраны из асцитической жидкости мышей и помещены для выращивания в суспензию in i-itro. Те".— ты на питотоксичность осуществляли путем воздействия на клетки препаратов в различных концентрациях в течение 48 ч. В конце экспозиционного периода клетки были подсчитаны с помощью счетчика Соы11.ег клеток, а
ПЗ доза, которая дает 5ОХ-нос уменьшение количества клеток, в сравнении с необработанными контроль11ыми клетками была рассчитана.
Табл. 4 показывает, что соедине— ние ТЬ было приблизительно так.1м же
35 цитотоксичным, как ДНР на Р388 лейкемических клетках, и бь1ло очень активно по отношению к Р388/ДК лейкемическим клеткам, ДНР было приблизи40 тельно в 500 раз менее активно по
oTHopIeHèlJ к устойчивым клеткам, чем к чувствительным клеткам, Результаты первичного исследования и к кo, проведенного на CDF-1 мышах, страдающих асцитической Р388
45 лейкемией и обработанных .р. через сутки после трансплантации опухоли, показаны в табл, 5.
Сравнение на максимальную переносимую дозу показало, что соединение
50 ?Ь менее активно, чем ДНР и 4-дм-ДНР.
Результаты исследований, проведенных на СЗН/Ме мышах с i,v, трансплантированной Gross leukemia., обработанных i ч. через сутки после
55 трансплантации опухоли, приведе 1ы в табл. 6. Соединения ТЬ оказались более токсичными и более сильнодействуюп;ими, чем родственные соедине1378784
It
СН3
0 Ой
OH!
ОССН
И
20
ОН
8 О ОН
1 и
HúC е OО сн
О
Il
С вЂ” СН
О OI) --ОБ оссн
И о
С-СН, 8 О ОН
ОН
Я О ОН
О
П I
К C-C-О О сн3
II — С%
0 ОН
ОН
Я 0 ОН, Ю ния. Сравнение максимальных переносимых доз показывает, что Ib более активно, чем ДНР. Соединение Ib gaлее исследовали на активность при введении через рот, на Gross leukeн 1а трансплантированную 1, г,, в сравнении с ДНР, ДК, вводимыми i. ê., и в сравнении с 4-дм-ДНР, вводимым через рот.
Данные, приведенные в табл. 7, показывают, что ХЬ обладает хорон1ей противоопухолевой активностью при введении через рот 1 раз в сутки в сравнении с активностью 4-дм-ДНР (где продемонстрирована как активная при введении через рот) и ДНР при введении
Таким образом, соединения lb u
IIa. обладают улучшенными свойствами по сравнению с противоопухолевыми препаратами — доксорубицином и даунорубицином. формула изобретения
Способ получения антрациклингликозидов общих формул где  — Н (а), ОГН (б), отличающийся тем, что антрациклинон общей формулы
3 0 ОН ОН где R имеет указанные значения, 10 растворяют в хлористом метилене и обрабатывают хлористым 3,4-ди-()-ацетил-2,6-дидезокси-1.-Ь-арабиногексопиранозилом формулы
СЕРСО 0 С1
1I
0 в присутствии трифторметансульфоната серебра и молекулярных сит, полученную смесь гликозидов общих формул
ОССЕ
И
О где R имеет указанные значения, разделяют и очищают хроматографированием на колонке, заполненной силикагелем, с использованием смеси этилацетата и циклогексана 1:1 (по объему) в качестве элюента, зан(итные ()ацетильные группы удаляют обработкой
0,2 н. водным раствором гидроокиси натрия при комнатной температуре.
1378784
Таблица 1
Соединение Доза, кг/мл
%," 1.1> (кг/мл) 25 12
12,5 74
6,2 106
ДНР
Соединение 400 146
IIa
400
100 !36
25 143
6,2 127
1,5 120
25 24
ДК
12,5 40
6,2 69
» Число колоний, % от необработанных контрольных.
Таблица 2
BIIB»» Toxic йеа
1Ье
Соединение Доза, мг/кг
О/10
О/10
1 60
2,9
ДНР
О/20
О/10
4,4»»»» 165-170
6,6»»»» 150-160
7/20
О/10
О/5
О/5
120
Соединение
IIR
1/10
О/10
100
О/18
2/18
4,4»»»» 220-227
6,6»»»»» 227-305
ДК
О/26
2/26
3/26
6/26
268-610
" Среднее время выживания, % по отношению к необработанным контрольным клеткам;
Выжившие на продолжительное время (>,60 сут);
" 0цененные на основе аутоптических исследований на мертвых мышах;
""""Данные двух экспериментов (range);
"""""Данные трех экспериментов (range).
1378784
Таблица3
Соединение Доза, 7. " 1.Р (мг/мл ) мг/мл
ДНР п 12
12,5
6,2
4-дмн-ДНР 25
12,5 18
6,2 53
3,1 84
6,3
Соединение
ТЪ
100
67
- 35
6,2
1,5
107
12,5.. 7,5
6,2, 59
" Число колоний, Х от необработанных контрольных.
Т а б л и ц а 4
Mr /
Соединение
Р388 " РЗЯЯ/ДК ""
1,7 .800
4?О
ЛНР
Соединение Ih 1,2
25
Доза, приводящая к 50_#_-ному уменьшению количества клеток, в сравнении с необработанными контрольными;
Р388 лейкемические клетки, чувствительные к ДК;
Р388,устойчивые к ДК;
Отношение между LD на Р388/ЦК и LD на РЗЯЯ.
SO ьо l 2
1378784
Таблица 5
Соединение
Toxiс
deaths
Доза, Т/С, 7 ВПВ мг/кг
2,9 159-194 О/18 О/8
4,4 140-184 О/18 7/)8
0,75 163 О/8 О/8
4-дм ДНР
Соединение
140
1,25
163
2,5
220
4,4, ДК
305
6,6
3 610
|
Таблица 6
Соединение Доза, Т/С, 7 Тох с мг/кг deaths
О/8
171
ДНР
О/8
О/7
7/8
4,4
100
О/1G
10 171
13 200
16, 9 207
ДК
О/10
3/10
Таблица 7
° °
T/с, Х
Toxic
deaths
Обработка
О/I0
6/10
О!6
150
ДНР 15
22,5
2-дм-ДНР 3
i ÷, Через рот
О/6
150
22,5 171
Соединение I 2,9 214
Способ График» Соединение Доза, введения мг/кг
О/8, О/8
О/9 3/9
О/10 10/10
1/10 О/10
О/10 О/10
5/10 О/10
1378784
Продолжение табл.7
График" Соединение Доза, мг/кг
Способ введения
4,3 216
2,9 167
4,4 208
6,6 116
О/3
Через рот +1
О/10
Соединение
j:b
О/10
4/9
1/20
171-171
ДК
13 » 200-200
16 9 200-207
1/20
3/13
День после трансплантации опухоли;
« Данные двух экспериментов (randе).
Составитель Г. Коннова
Редактор А. Долинич Техред Л.Олийнык Корректор М.Иарони
Заказ 896/59
Тираж 348 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, r. Ужгород, ул. Проектная, 4