Способ определения качества кулинарных изделий после хранения
Иллюстрации
Показать всеРеферат
„„SU„„1388793
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
Ai (б1) 4 G 01 N 33 00
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АBTOPCKOMV СВИДЕТЕЛЬСТВУ 14
1
О.d
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3790813/28-13 (22) 13. 09. 84 (46) 15.04.88. Бюл, Ô 14 (7 1) Институт питания ANH СССР (72) Н.Л. Гришина, Г.В.Никольская и М.M.Ãànnàðoâ (53) 643.352 (088.8) (56) ГОСТ 21237-75. (54)(57) СПОСОБ ОПРЕДЕЛЕНИЯ КАЧЕСТВА
КУЛИНАРНЫХ ИЗДЕЛИЙ ПОСЛЕ ХРАНЕНИЯ, включающий отбор пробы и ее анализ, отличающийся тем, что, с целью обеспечения возможности определения качества блюд после разогрева при одновременном упрощении способа, предварительно отбирают пробу свежеприготовленного изделия, анализу подвергают обе пробы путем воздействия на них проталитическим ферментом и инкубации, после инкубации через равные промежутки времени определяют количество ароматических аминокислот путем спектрофотометрии и по полученным данным определяют степень протеолиза, а о качестве изделий после разогрева судят по разнице скорости протеолиза.
1388793
Изобретение относится к пищевой промышленности и общественному питанию, а именно к способам контроля качества кулинарных изделий после хранения.
Цель изобретения — обеспечение вОзможности определения качества блюд после разогрева при одновремен-. ном упрощении способа. l0
При определении качества кулинарных изделий известным способом невозможно определить качество кулинарных изделий после разогрева, так как микроорганизмы погибают. . 15
Предложено испольэовать свойства протеолитических ферментов реагировать на малейшие изменения в конф мации (структуре) белковых молекул. Это выражается в различии про- 20 теолиза при различных обработках белков-субстратов, в данном случае белковых продуктов, в нарастании в продуктах свободных аминокислот, Пример 1. Выбирают 5-7 кусоч- 25 ков мяса, отмывают от соуса, тщательно удаляют влагу фильтровальной бумагой и измельчают их в мясорубке.
Навеска фарша для анализа 1 r.
После шести суток хранения гуляш 30 разогревают. Затем отбирают пробы аналогично описанному, после чего навески переносят в колбы и заливают соответствующим буфером: одни, для определения протеолиза ферментомпепсином, 10 мл глицинового буфера (рН 1,5, 0,1 М); другие, для определения протеолиза трипсином, 10 мл фосфатного буфера (рН 8,0, 0,1 М).
Пробы хорошо встряхивают, отбирают 40 из каждой по 1 мл в пробирки с 3 мл
107.-ной трихлоруксусной кислоты (ТХУ) (слепые пробы), а оставшиеся 9 мл помещают в водяной термостат при
37 С на 5 мин. Непосредственно перед 45 употреблением растворяют навески по
10 мг фермента (пепсина или трипсина); в дистиллированной воде пепсин и в 0,001 н.соляной кислоте трипсин.
Трипсин необходимо растворять в очень
50 слабом растворе соляной кислоты для предотвращения автолиза фермента.
Растворы ферментов прогревают в течение 5 мин в водяном термостате.
Предварительно отбирают по 1 мл для слепых проб и смешивают в ранее отобранными слепыми пробами. После прогревания растворы ферментов добавляют к пробам, включают секундомер, перемешивают и термостатируют при 37 С.
Через 5, 10, 15, 30 и 60 мин отбирают по 2 .мл проб в пробирки с 3 мл
107.-ной ТХУ, После отбора последней пробы (через 60 мин после начала гидролиза) пробирки помещают в холодильник при +4 — 6 С на 1 ч (можно на сутки). Затем пробы фильтруют через обычные фильтры для отделения осадка (можно цектрифугировать при
5000-8000 об/мин в течение 30 мин).
Прозрачный фильтрат спектрофотометрируют на спектрофотометре СФ-16 при длине волны 280 нм. Из полученных результатов вычитают величины слепых проб, которые обрабатывались так же, как образцы, только без инкубации.
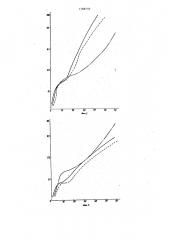
Вычерчивают кривые протеолиза, откладывая по оси абсцисс время в минутах, по оси орДинат поглощение при длине волны 280 нм (на фиг.1 изображены кривые протеолиза пепсином; на фиг.2 — кривые протеолиза трипсином, пунктирной линией обозначена кривая протеолиза после хранения и разогрева).
Пример 2. Треску жареную после ее приготовления, хранения (сплошная линия), хранения и разогрева (пунктирная линия) обрабатывают и исследуют аналогично описанному в примере 1 (на фиг.3 представлены кривые протеолиза пепсином; на фиг.4. — кривые протеолиза трипсином, штрихпунктирной линией показана кривая протеолиэа сразу после приготовления).
Пример 3. Мясо в кисло-сладком соусе обрабатывают и исследуют аналогично описанному в примере 1 (на фиг.5 даны кривые протеолиза пепсином; на фиг.6 — кривые протеолиза трипсином, сплошной линией обозначена кривая протеолиза свежеприготовленного блюда, штрихпунктирной линией — после разогрева, пунктирной линией — после хранения).
Пример 4. Навески каши гречневой рассыпчатой по 1 г не подвергали диалиэу, а сразу же заливали соответствующим буфером: один, для определения протеолиза пепсином, 10 мл глицинового буфера (рН 1,5, 0,1 M), другой, для определения тротеолиза трипсином, 10 мл фосфатного буфера (рН 8,0, 0,1 М).
Далее опыт проводили аналогично описанному в примере 1, 1388793
В примере 4 — из-за присутствия большого количества пептидного материала (высокие слепые пробы) в образце (гречневой каше) не происходило протеолиза. Таким образом, предварительный диализ образца необходим во всех образцах с высоким содержанием пептидного материала.
На фиг.7 представлены кривые ферментативного протеолиза пепсином каши гречневой после диализа; на фиг ° 8кривые протеолиза трипсином, пунктирной линией показана кривая после хранения, сплошной — кривая гидролиза свежеприготовленной каши.
Пример 5. Гуляш из говядины подвергали обработке и воздействию химотрипсина. Опыт проводили анало гично описанному в примере 1 для протеолиза трипсином.
Как видно из фиг.1-4, степень атакуемости белков протеолитическими ферментами охлажденных вторых блюд: мяса в кисло-сладком соусе, рыбы жареной (треска) и гарнира — гречневой каши рассыпчатой, практически не меняется по сравнению со скоростью переваривания белка свежеприготовленного блюда. Это свидетельствует о том, что ни охлаждение, ни разогрев не меняют качества белка этих блюд.
Исключение составляет лишь гуляш из говядины, скорость протеолиза белка которого снижается после трех суток хранения и разогрева, причем г наиболее четко это выражено при ферментативном протеолизе пепсином (фиг.i). Ухудшение перевариваемости
5 белка гуляша обусловлено более жестким режимом его приготовления по сравнению с технологией приготовления мяса в кисло-сладком соусе, что приводит к образованию прочных комплексов белка с липидами и углеводами, перевариваемость которых ухудшается при хранении и разогреве.
Сравнение характера кривых кийетики накопления ароматических аминокислот (фиг.1-4) свидетельствует о тождественности поведения пепсина и трипсина практически на всем участке кривых.
Сравнение скорости переваривания белка всех указанных свежеприготовленных вторых блюд пепсином и трипсином показывает существенное различие в чувствительности этих ферментов для мяса и рыбы. Если скорость nepeg5 варивания белка пепсином заметно различна для мяса в кисло-сладком соусе, гуляша и рыбы жареной, то по трипсину она- одинакова. Растительный белок укаши гречневой переваривается значительно медленнее белка мяса и рыбы.
Как видно из приведенных примеров, предлагаемый способ определения качества белка прост, обеспечивает высокую достоверность результатов и позволяет определить качество кулинарных изделий после разогрева.
1388793 аг
1 3887 93
Фм.б
1 3887 93
02
/
r
1388793
r
r
/
Редактор А.Огар Texðeð М.Моргентал Корректор С.Шекмар
Заказ 955 Тираж 847 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д,4/5
Производственно-полиграфическое предприятие, r.Óæãîðîä, ул.Проектная, 4