Способ определения активности протеолитических ферментов
Иллюстрации
Показать всеРеферат
Изобретение относится к биотехнологии, в частности к способам определения активности ферментов, и может быть использовано для определения активности ферментов и содержания аминного азота в аминокислотном анализе и протеолизе. Целью изобретения является повышение чувствительности способа. Активность протеолитических ферментов определяют следующим образом. Проводят реакцию гидролиза белкового субстрата под действием анализируемого фермента, останавливают реакцию при помощи трихлоруксусной кислоты, центрифугируют реакционную смесь, в супернатанте определяют концентрацию аминогрупп при помощи хромогенной реакции с нингидрином в среде метилцеллозольва с добавлением метабисульфита натрия, тетрафтордибромэтана и триэтилалюминия и фотометрируют окрашенный раствор при длине волны 570 нм. Минимальные, максимальные и оптимальные концентрации равны 0,4, 5 и 2,5 мг/мл для метабисульфита натрия, 0,02, 0,25 и 0,1 мг/мл для тетрафтордибромэтана и 0,6, 4 и 2,5 мг/мл для триэтилалюминия. 3 ил.
СОЮЗ СОВЕТСНИХ
СОЦИАЛИСТИЧЕСНИХ
РЕСПУБЛИН
ÄÄSUÄÄ 1597701 (1) G 01 N 21/75
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К А ВТОРСНОМУ СВИДЕТЕЛЬСТВУ го фермента, останавливают реакцию при помощи трихлоруксусной кислоты, центрифугируют реакционную смесь, в супернатанте определяют концентрацию аминогрупп при помощи хромогенной реI акции с нингидрином в среде метилцеллозольва с добавлением метабисульфита натрия, тетрафтордибромэтана и три— этиламмония и фотометрируют окрашенный раствор при длине волны 570 нм.
Пример.. Для проведения реакции гидролиза используют растворы трипсина 0 5 мг/мл и гемоглобина
i0 мг/мл в 0,05 M ацетатном буфере с
ГОСУДАРСТВЕННЫЙ НОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТНРЫТИЯМ
ПРИ ГКНТ СССР (21) 4422764/31-13 (22) 11. 05. 88 (46) 07. 10. 90. Бюл. ¹ 37 (71) Институт молекулярной биологии и и биохимии АН КазССР (72) И. Б. Беклемишев, О. В. Фурсов и P.Ê.-Г. Каракеева (53) 577.15(088.8) (56) Adams С. А. et. al. Automated
Determination of Proteolytic Enzymes
and Amino Nitrogen by Use of TNBS.
Analytical Biochemistry, 1976, v. 70, № 1 р. 181-186.
Дэвени M. Гергэй Г, Аминокислоты, пептиды, белки. — M.: Мир, 1979, с. 65-66. (54) СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ
ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (57) Изобретение относится к биотехнологии, в частности к способам определения активности ферментов, и может быть использовано для определения активности ферментов и содержания аминИзобретение относится к биотехнологии, в частности к способам определения активности ферментов, и может быть использовано для определения активности ферментов и содержания аминного азота в аминокислотном анализе и протеолизе.
Целью изобретения является повышение чувствительности способа определения.
Активность протеолитических ферментов определяют следующим образом: проводят реакцию гидролиза белкового субстрата под действием анализируемо2 ного азота в аминокислотном анализе и протеолизе. Целью изобретения является повышение чувствительности способа. Активность протеолитических ферментов определяют следующим образом: проводят реакцию гидролиза белкового субстрата под действием анализируемого фермента, останавливают реакцию при помощи трихлоруксусной кислоты, центрифугируют реакционную смесь, в супернатанте определяют концентрацию аминогрупп при помощи хромогенной реакции с нингидрином в среде метилцеллозольва с добавлением метабисульфита натрия, тетрафтордибромэтана и триэтилалюминия и фотометрируют окрашенный раствор при длине волны 570 нм. ®
Минимальные, максимальные и оптималь-1 ные концентрации равны 0,4, 5 и
2,5 мг/мл для метабисульфита натрия, (0,02, 0,25 и О, 1 мг/мл для тетрафтордибромэтана и 0,6, 4 и 2,5 мг/мл для триэтилалюминия. 3 ил.
1597701 рН 4,5. Раствор для гидролиза субстрата содержит 0,2 мл 0,05 М ацетатного буфера, рН 4,5 с 10 мИ ЭДТА, 0,2 мл раствора фермента, 0,1 мл раствора гемоглобина (субстрат). Пбсле инкубации при 30 С в течение бО-120 мин реакцию останавливают добавлением 0,5 мл 10%ного раствора трихлоруксусной кислоты
Реакционную смесь центрифугируют при
10000 об./мин в течение 10 мин. Отбирают 0,1-0,2 мл супернатанта, которые переносят в стеклянные пробирки, куда добавляют среду для определения количества свободных аминокислот, Эта 15 среда содержит 0,18 r нингидрина, растворенного в 4,2 мл ацетатного буфера с рН 5,5, 7,2 мл метилцеллозольва (этот реактив готовят непосредственно перед определением активности), а также метабисульфит натрия, тетрафтордибромэтан и триэтилалюминий. После добавления нингидринового реагента пробирки нрогревают 10 мин при 95 С на водяной бане до получения устойчи- 5 вой фиолетовой окраски. Экстинкцию замеряют при 570 .нм на спектрофотометре. По разнице поглощения опытных и контрольных пробирок судят об активности фермента.
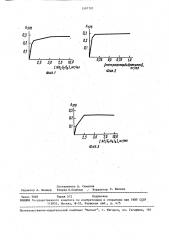
На фиг. 1 приведена кривая изменения протеазной активности в зависимости от добавления к метилцеллозольву различных количеств метабисульфита натрия;,на фиг. 2 - кривая изменения протеазной активности в зависимости от добавления к метилцеллозольву раз- личных количеств тетрафтордибромэтана (ТФБЭ); на фиг. 3 - кривая изменения протеазной активности в зависимости от добавления к метилцеллоэольву различных количеств триэтиламмония.
Как видно из данных, приведенных на фиг. 1, минимальная концентрация, приводящая к эффекту, составляет
0,4 мг/мл, а максимальная - 5 0 мг/мл.
11ри концентрациях, превышающих
5 0 мг/мл, действие этого соединения остается на прежнем уровне, что объясняется количеством связываемых им перекисей, находящихся в метилцеллозольве. Оптимум составляет 2,5 мл/мл.
Минимальная концентрация определяется достоверностью получаемых данных (уровень значимости P (0,2), максимальная — выходом кривой на плато.
Оптимум концентрации — первая точка при входе кривой на плато. Как и в случае с метабисульфитом натрия, определены концентрации тетрафтордибромэтана: минимальная 0,02 мг/мл, максимальная 0 25 мг/мл и оптимальная
0,1 мг/мл (фиг. 2).
Минимальная концентрация алюмоорганического соединения, необходимая для достижения положительного эффекта, составляет О,б мг/мл, максимальная—
4,0 мг/мл и оптимальная — 2,5 мг/мл (фиг. 3).
Чувствительность способа, измеренная по способности достоверно детектировать присутствие аминокислот (на примере глицина) в растворе, составляет 0,1 мкг/мл.
Формула изобретения
Способ определения активности протеолитических ферментов, включающий введение образца исследуемой реакционной смеси в растворитель, содержащий метилцеллозольв, ацетатный буфер с рН 4,5-5,5 и нингидрин при заданном объемном соотношении образец:растворитель, протекание хромогенной реакции и фотометрирование, о т л и ч аю шийся тем, что, с целью nosbr» шения чувствительности способа, растворитель содержит дополнительно мета.бисульфит натрия в концентрации 0,45 мг/мл, тетрафтордибромэтан в концентрации 0,02-0,25 мг/л и триэтилам-. моний в концентрации 0,6-4,0 мг/мл.
1597701
4570 а,з
0,2
О,t
0,2
Составитель А. Семенов
Редактор А. Шандор Техред Л.Олийнык Корректор С. Шекмар
Заказ 3048 Тираж 512 Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-издательский комбинат "Патент", r. Ужгород, ул. Гагарина, 101
10 7Ю 100
ГИОМ33,мГIмЯ
Фиг.!
А570
0,3
0,25 05 075 f д (аетрартрда3роямпан), Н/НЛ
Фиг.2
25 4д 7Я ЩО А((4Н ) 1,иФ фиг. Л