Способ получения производных резоруфина
Иллюстрации
Показать всеРеферат
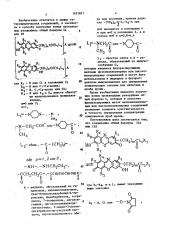
Изобретение относится к гетероциклическим соединениям, в частности к получению производных резоруфина формулы 1а или 16 .СНЛ,С(0)ЦЦ ( где RI- Нили С1 в положении 2; H или С|-Сд-алкил; Кэ - Н, С(-С4-алкил или С1; Кд - Н или R -fR -аннелированное фенильное кольцо; или 2; LI -N-CHu-CHu-N -CHu-CHfc, -N(CHs)-CHft-COO - или -С(0)-СН-СН,г-СНй-К-в свободном виде. 9 ил, -СН4-СНе;1,с-связь, -С(0)-(, где ,2 штиЗ, -NH-NHCHuCH 2-,-C(0)CHaCHe- -С(0)-, -С(0)СН(ОН)СН(ОН)С(0)-; А - радикал, образованный из гидантоина, дифенилгидантоина, трет-бутилоксикарбонил-Ь-тироксина, фенобарбитала , эстрадиола, 7-теофиллина, диг гоксигенина, дигоксигенинмонодигитоксозида, З-амино-3-дезокситетраиодотироуксусной кислоты, тироксинметилового эфира или ксантина, причем радикал - (CH$)m-C(O)-L4-L$-A при находится в положении 4 и при - в положении 2, а в случае и п 0,8-6,4 L Н(СНа)СН«Ј(0) - или -С(О) - CH-CH -CHfc-N-CH -CHfc; Le - простая связь и А - радикал, образованный из иммуноглобулина G, которые являются флуоресцирующими метками низкомолекулярных или высокомолекулярных соединений. Цель - разработка способа получения указанных соединений . Получение ведут из соединения формул 1а и 16, где , вместо заместителя LЈA имеется реакционноспособный радикал , С1 или -О- -N-C(0)-CH$-CH2-C(0), и соединения формулы X4L(jA, где L. jj А - укаэано выше; Х4 - Н или (0)-CHg- (О), причем активные радикалы соединений могут иметь защитные группы , которые при необходимости удаляют с выделением целевого продукта (Л в свободном виде. 9 ил, 1 табл. Од Ю 00 04
СОЮЗ СОВЕТСКИХ
РЕСГЮЬЛИН
ОПИСАНИЕ ИЗОБРЕТЕНИЯ аааа а Ь ji
БИБд
Н IlATKHTV
В 4 Rl (cH ) c(o)l. ., h
В
"з (CHz)C(O)2-,2-, Л
0 0 ОН
ГОСУДАРСТВЕННЫЙ НОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТНЯТИЯМ
ПРИ ГКНТ СССР (21) 4027894-04 (22) 24.07.86 (31) Р 3526565.5 (32) 25.07.85 (33) DE (46) 15.01.92, Бюл. Р 2 (71) Берингер Маннхайм ГмбХ (DR) (72) Кристиан Кляйн, Ханс-Георг Батц и Руперт Херрманн (DH) . (53) 535.426.07(088.8) (56) Landon J. Kernel R.S. - Immunoassays, 80 s., Univ. Park Press, Baltimore. Nd., 1980, Seite 91-112. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
РЕЗОРУФИНА (57) Изобретение относится к гетероциклическим соединениям, в частности к получению производных реэоруфина формулы la или Хб где R - Й или Сl в положении 2; К ьь - Н
Ci -C4-aJIKHJI ó R»> — Нь С -Сд-алкил или Cl; R4 - Н или Кз+К -аннелированное фенильное кольцо; m 0 или 2; а=*1; ь --N-сн -сн -N -сн„-сн, -N(cHy)-CHq-СОΠ— -С(о) -СН-Щ -СН -N„,80„„1621811 A 3 (Я)5 С 07 D 265/38, 413/12, С 07 J 71/00//(С 07 D 265/38
С 07 С 270 20 237 ° 22) 2 -CH<-СНф 1.<-связь, -С(0)-(СЩ -, где
: Р 1 ° 2 или Зь -NH NHCHqCHg C(0)CHgCHy
--С (О) -, -С(О) СН(ОН) СН(ОН) С(0) -;
А радикал, образованный из гидантоина, дифенилгицантоинаь трет-бутилоксикарбонил-Ь-тироксина, фенобарбитала, зстрадиола, 7-теофиллина, ди." гоксигенина, дигоксигенинмонодигитоксозида, З-амико-З-.деэокситетраиодотироуксусной кислоты, тироксинметилового эфира или ксантина, причем радикал — (СН }„,-С(О)-Ь -2.q-А при m 0 находится в положении 4 и при ш2в положении 2, а в случае mW и и= а. .: -.кинвиа)
-с(О) - сн-сн -сн„-N-сн,-сн, 2. простая связь и А — радикал, образованный из иммуноглобулина G, которые являются флуоресцирующнми метками низкомолекулярних или высокомолекулярных соединений. Цель — разработка способа получения укаэанных соединений. Получение ведут из соединения формул Ia и ?б, где и 1, вместо заместителя ЬоА имеется реакцнонноспособный радикал Х =нь Сl или -0-Я-С(О)-СН -СНо-с(О), и соединения форм пи Х 2, A, где 2.ьь и А - указано вине; Хg - Н или -О-N-С(О)-СН12ч % О), причем активные Ваникаиы соединений могут иметь защитные группы, которые при необходимости удаляют с виделением целевого продукта в свободном виде. 9 илеь 1 табл.
1621811
НО
О
Изобретение относится к хиэии гетероциклических соединений, в частности к способу получения новых производных резоруФина общей Формулы Ха . или Хб
В 4 . R1, (сн,) с(оЩ., 8 О
В п
В 4 R1
R (CИ ) иС(О) aй
ОН
Rg . я
1 где R - Н или Cl и полевении 2!
Я или G -(; ф алкил1 °
- я, С1-С4-алкнл или О3
R - Н нли R® u R4 вместе образу ют аннелированное сенильное кольцо, avO или 2;
1е -, -н1
СН3
1 сб зО, С (С Н )р
11
2 р 1, 2 или 8, — ин —,-янсн,сн;, С н;СН2С вЂ”,-CCH(OH) CH(OH) c
)!
О
А - радикал, образованный из гидантоина, ди Ьенилгидантоина, трет-бутилокси кар боннл-Й- тироксина, Аенобарбитала, эстрадисла, 7-теоджллина, дигоксигеннна, дигоксигенинмонодигитоксозида, З-амино-.З-дезокситетрайодотироуксусной кислоты, тироксинметилового эАира или ксантина, причем радикал -(СН )„-L L -А при
m 0 находится в полокении 4 и нри m 2 в полокенин 2, а в случае ш0 и п 0,8-6,4 p — МСН2С или — N С-! I
CHç 0 О
i Ь - простая связь и А - радикал, . образованный из иммуноглобулина G которые являются д луоресцирующими метками низкомолекулярных или высокомолекулярных соединений и могут быть использованы в медицине в Флуорес"., центном иммуноанализе для определения концентрации гаптена или антигена в пробе крови.
Целью изобретания является получение новых производных резору4жна общей формулы Х, которые в качестве
Фиуоресцируияв1х меток низкомолекуляр™
НЫХ ИЛИ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ позволяют повысить чувствительность и точность определения концентрации компонентов проб крови.
Поставленная цель достигается тем, что соединение общей формулы ХХа или ХХб где R -R4, m u Lq имеют указанные виие значения
X(- Í, СХ нли — О—
1621811 подвергают взаимодействию с соединением общей формулы Т1Х
)Xz I-g A имеют указанные выше зна5 где f„z и А ч ения, 10
Xe- H или
О причем активные радикалы соединений
IIa или ТХб и III могут иметь защит- 15 ные группы, которые при необходимости удаляют, с выцелением целевого продукта в свободном виде.
На фиг. 1 " 9 представлены кривые, поясняющие способ. 20
Пример 1. (3-(1-ДиАенилгидантоинил) пронионил1пиперазид резоруфин4-кар боновой кислоты. а.. Реэоруфин-4-карбоновая кислота.
16 г нитрозорезорцнна, 15,5 г 2,6- 25 диоксибензойной кислоты и 8,6 пиролюзита суспендируют в 200 мп метилового спирта, после чего суспензию охлажпают до О С. Затем к суспензии прибавляют по каплям 10,6 мп концентрирован- 30 ной серной кислоты, после чего смесь дополнительно перемешивают в течение
2 ч при комнатной температуре. Выделившуюся в виде окрашенного в красный цвет осадка резапурин-4-карбоновую кислоту отфильтровывают, промыва35 ют метиловым спиртом и сушат.
Производное диаз резорцина раство-. ряют в 200 мл воды и 50 мп 25Х-ного раствора аммиака и раствор Аильтруют.
К окрашенному в голубой цвет Аильтрату при охлаждении льдом прибавляют порциями 50 r цинковой пьши, причем реакционной смеси дают воэможность нагреться до комнатной температуры.
За ходом восстановления легко следить с помощью хроматограАии в тонком слое (элюирующее средство:метиловый спиртэтиловый эфир уксусной кислоты в соотношении 1:1; DC-пластины с силикагелем). Реакционный раствор Аильтруют, а затем фильтрат подкисляют ледяной уксусной кислотой и небольшим количеством концентрированной соляной кислоты. Выделившуюся в осадок Резоруфин4-карбоновую кислоту отфильтровывают и сушат в вакууме над пятиокисью Аосфора.
Выход 16,33 г.
Н (силикагель, элюирующее средст-. во: н-бутиловый спирт — ледяная уксусная кислота — вода в соотношении 4:1:
: 1) =0,4.
N,0,0-ТРиацетилдигидРоРезоРУ фин-4-карбоновая кислота.
12,9 r резоруАин-4-карбоновой кислоты растворяют в 30 мп ледяной уксусной кислоты и 30 мл ангидрида уксусной кислоты, раствор смешивают с 27,6 r хлорида олова (II) ° после чего смесь перемешивают в течение f ч при 80 С. Затем реакционную смесь выливают в 600 мл воды со льдом, производят перемешивание в течение 1 ч, после чего осадок отфильтровывают.
После сушки твердое вещество растворяют в 500 мп ацетона. Раствор фильтруют и фильтрат упаривают, в результате чего получают после сушки
11,3 г продукта. Н-ЯИР((Д)4-ДИСО),Д 2,24, 2,26 и 2,29 (по S, 9Н); 6,94 (dd, J=8,5 и 2,2 Гц, 1Н); 6,98 (d, J=2,2 Гц, 1Н);
7,04 (d, J=9 Гц, 1Н); 7,61 (d, J=
=8,5 Гц, 1Н); 7,67 (d, J=9 Гц, 1Н) млн
gg (силикагель, элюирующее сред-. ство: хлороАорм — метанол — ледяная уксусная кислота в соотношении 9:1:
:0,1)=0,46. в. Хлорангиприд N,О,О-триацетилдигидрорезоруфин-4-карбоновой кислоты.
38,5 r триацетата, описанного в примере 1б, смешивают с 54 мл оксалилхлорида и смесь охлаждают до 0 С.
К охлажденной смеси прибавляют несколько капель диметилАормамида, после чего смеси дают возможность нагреться до комнатной температуры, При этом растворение твердого вещества сопровождается выделением rasa.
Реакционную смесь упаривают в вакууме досуха, по три раза продукт растворяют в 200 мп сухого хлористого метилена и раствор вновь упаривают досуха.
Выход 41 г.
r. N-трет-Бутилоксикарбонил (БОК)пиперазин.
12,61 г N-бензгидрилпиперазина (EMPA-chemic) растворяют в 100 мл смеси 1,4-диоксана и воды, взятых в соотношении 3: 1. К приготовленному раствору прибавляют по каплям раствор
12,0 г ди-трет-бутилдикарбоната в
1621811
50 мл 1,4-диоксана. Смесь перемешивают в течение 0,5 ч, затем прибавляют к ней по каплям 50 мл воды, фильтруют, после чего осадок сушат, Выход 16,2 r N-БОК-N -бензгидрилпиперазина.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:
:0,1)=0 92.
7 г N-БОК-N -бензгидрилпипвразина растворяют в 100 мл этилового эфира уксусной кислоты и 5 мл ледяной уксусной кислоты. Производят гидрирование в присутствии 0,3 r палладия на активированном угле, после чего катализатор отфильтровывают, а фильтрат упаривают. Полученный остаток смешивают со 100 мл воды и 20 мл 1 н.
20 раствора соляной кислоты, фильтруют, фильтрат дважды экстрагируют этиловым эАиром уксусной кислоты, а затем водную Аазу доводят до основной .реакции путем прибавления раствора гидро- 21 окиси натрия. Выделившийся в осадок маслообразный продукт экстрагируют дихлорметаном. После сушки органической фазы над сернокислым натрием и упаривания получают 3,2 г N-БОК-пипе- >0 разина в виде маслообразного вещества, которое спустя несколько суток полностью закристаллизовывается.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
3S
=0,05 с нингидрином становится синим. д. Ы -Бок-пиперазид N,О,О-триацетилцигидрорезоруфин"4-карбоновой кислоты.
К 25 г хлорангидрида кислоты, описанного в примере 1в, и 17,3 мл триэтиламина в 450 мл дихлорметана при
О С прибавляют по каплям раствор
13 8 г N-БОК-пиперазина в 50 мл диЭ 45 хлорметана. Реакционную смесь дополнительно перемешивают в течение 1 ч без охлаждения, затем три раза экстрагируют водой, после чего органическую Аазу упаривают.
Выход 36,0 r.
Rf (силикагель, элюирующее средство: хлороАорм — метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
=0,64.
«э5 е. N -БОК-пиперазнд N-ацетилдигид-, рорезоруАин-4-карбоновой кислоты.
34,3 г триацетата, описанного в примере 1д, и 17,1 r сульфита натрия перемешивают в течение 1 ч при 60 С в 500 мл смеси 1,4-диоксана и воды, B3BTblx B соотношении 1: 1 . После этогс реакционную смесь упаривают, остаток растворяют в этиловом эфире уксусной кислоты, раствор отАильтровывают от нерастворимой соли, после чего фильтрат хроматограАируют на 2 л силикагеля (элюирующее средство:этиловый эфир уксусной кислоты — дихлорметан в соотношении 4:1, как только начинает вымываться продукт, переключаются на чистый этиловый эАир уксусной кислоты).
Выход 14 r, Rf (силикагель, элюирующее средство:этиловый эфир уксусной кислоты— дихлорметан в соотношении 4:1)=0,28.
t ж. N -БОК-пиперазид резоруАин-4карбоновой кислоты.
5 г N-ацетильного соединения, описанного в примере 1е, растворяют в
200 мл метилового спирта и 600 мл воды. К приготовленному раствору прибавляют 1,8 г кислого углекислого натрия и 10,7 мл 1 н. раствора гидроокиси натрия, а затем 14 г калийгексацианоферрата. Реакционную смесь перемешивают в течение 0,5 ч при комнатной температуре, после чего рН смеси доводят до 5. Выделившийся в осадок продукт отфильтровывают с применением вакуума.
Выход 2,72 r, Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9: 1:0,1)=
=0,28. з. Трифторацетат пиперазида реэоруфин-4-карбоновой кислоты.
1 r БОК-производного, описанного в примере 1ж, выдерживают в течение
15 мин в 20 мл триАторуксусной кислоты. Затем реакционную смесь упарива-, ют, остаток обрабатывают диэтиловым эфиром, после чего продукт отфильтровывают.
Выход 0,96 r.
Rf (силикагель, элюирующее средство: хлороАорм — метанол - ледяная уксусная кислота в соотношении 9:1:0,1) =
=0,02. и. Взаимодействие пиперазида резоруфин-4-карбоновой кислоты с N-оксисукцинимидным эАиром 3-(1-дифенилгидантоинил)пропионовой кислоты.
191 мг трифторацетата, описанного в примере 1з, и 210 мг N-оксисукцини1621811!
О мндного эфира 3-(1-дифенилгидантоинил)пропионовой кислоты (получен из натриевой соли дифенилгидантоина и этилового эфира 3-бромпропионовой кислоты) перемешивают в течение 15 ч в 20 мп диоксана и 20 мл О, 1 М калийФосфатного буферного раствора с рН 8,5. Выделившийся в осадок продукт отфильтровывают, фильтрат упаривают к хроматографируют остаток на силккагеле КР 18 (элюирующее средство: изопропиловый спирт), в результате чего получают дополнительное количество продукта. Продукт кристаллизуют из смеси этилового эфира уксусной кислоты и метилового спирта, в результате чего суммарно получают 250 мг сопряженного продукта.
Rf (силикагель, элюирующее средст-20 во: хлороформ-метанол-ледяная уксус1 ная кислота в соотношении 9:1:0,1)=
=0,61. Н-ЯМР{Я -ЛМСО),8: 2,6-2,8 (m, 2H); 3 ° 0-3,8 (mý 1OH)1 ;6э74 (dу J= 25
=2,2 Гц, 1Н); 6,82 (d, J=9.,5 Гц, !Н);
6,91 (dd, J=.9,5 и 2,2 Гц); 7,25-7,33 (ш, 10Н), 7,55 и 7,66 (no d, J=9,5 Гц, 2Н) млн.
УФ/VIS (0,1 М калийфосфатный бу- 30 ферный раствор с рН 7,5): и ц„ =
=576,8 нм.
Эмиссия флуоресценции: "jlщд д =
=592 нм.
П р н м е р 2. Взаимодействие пипе-.5 ! разида резоруфин-4-карбоновой кислоты с N-оксисукцинимидным эфиром 3«(1-дифенилгидантоинил)уксусной кислоты.
По аналогии с описанным в примере
1и из 365 мг трифторацетата пиперази-gp да резоруфин-4-карбоновой кислоты и
339 мг N-оксисукцинимидного эфира
3-(1-дифенилгидантоинил)уксусной кислоты получают 210 мг (2-дифенилгидан-. тоинилметилкарбонил)пиперазида резоруФин-4-карбоновой кислоты.
Ы (силикагель, элюирующее средство: н-бутанол - ледяная уксусная кислота — вода в соотношении 4:1:1)=0,82.
Н ЯМР (ЕОь ТИСО) 8: 3 2 4 5 (ш 5
10Н); 6,60 (d, J=2,4 Гц, 1Н); 6,71 (d, J 9,5 Гц, 1H) 6,80 (dd, J=9,05 и 2,04 Гц, 1H); 7,39 ("S", 10H) 7,52 (d, J=9,5 Гц, 1Н); 7,61.(d, J=9,0 Гц, 1Н); 9,65 (S, 1Н) мпн.
УФ!ЧТ$ (0,1 М калийфосфатный буферный раствор, рН 8,0): р акс =575,4 нм.
Эмиссия флуоресценции: 9 ча„с
592 нм.
Пример 3. Взаимодействие пиперазида резоруфин-4-карбоновой кислоты с N-оксисукцинимидным эфиром N-БОК-L-тироксина.
По аналогии с описанным в примере
1и из 212 мг трифторацетата пиперазкда резофурин-4-карбоновой кислоты и 419 мг N-оксисукцинимидного эфира
N-БОК-L-тироксина получают 320 мг продукта.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:
:0,1) 0,58.
N-Оксисукцкнимидный эфир N-БОК-Lтироксина получают следующим образом. а) N-БОК-тироксин.
Раствор 10 г (12,5 ммоль) натриевой соли L-тироксина Н О в смеси, состоящей из 300 мл смеси диоксана и воды в соотношении 2:1 и 15 мл 1 н. раствора гидроокиси натрия, смешивают с 3 r (13,75 ммоль) ди-трет-бутилдикарбоната (БОК)дО, после чего реак. ционную смесь перемешивают в течение
2 ч при комнатной температуре в усло-. виях, исключающих доступ света.
Прибавлением 2 М раствора КН$0 рН смеси доводят до 2, смесь экстрагируют этиловым эфиром уксуснойкислоты, экстракт, представляющий собой раствор продукта в этиловом эфире уксусной кислоты, промывают водой, сушат над сернокислым натрием и упаривают. Твердый остаток растирают с петролейным эфиром, отфильтровывают продукт с применением вакуума и сушат в эксикаторе.
Выход 9,45 г (86Х от теоретически рассчитанного значения).
Rf (силикагель, элюирующее средство: хлороформ — лигроин - уксусная кислота в соотношении 6:3:1)=0,6. б. N-Оксисукцинимидный эфир N-БОКтирокскна.
К раствору 8,8 r Ь-БОК-тироксина в 200 мп диметилового эфира этиленгликоля прибавляют 1,2 г (9,5 ммоль)
N-оксисукцинимида. Раствор охлаждают до !О С, после чего его смешивают по каплям с раствором 2,3 r (9,9 ммоль) дициклогексилкарбодиимида в 40 мл диметилового эфира этиленгликоля. Реакционную смесь перемешивают в тече-, ние 2 ч при комнатной температуре, вьделившуюся в осадок дициклогексилмочевину отфильтровывают с применением вакуума, после чего фильтрат упарива1621811
12 ют в вакууме .при 40 G. Полученный остаток растирают с изопропиловым спиртом и отфильтровывают с применением вакуума, а затем сушат в эксикаторе при комнатной температуре.
Выход 9, 19 r N-(Н-ВОС-L-тироксин) пиперазида резоруфин-4-карбоновой кислоты (94K от теоретически рассчитанного значения), общий выход по отноше- 0 нию к тироксину 81Х.
М (НРП.С-RP 18; элюирующее средство: нитрометан - этанол в соотношении
9:1) 0,8 или (HPTLC-RP 18; элюирующее средство; ацетонитрил - вода в соот" ношения 8:2)=0,6.
H-ЯМР Щ ЛИСО),8: 1,36 (S, 9Н);
2в81 (Я» 4Н)1 2э9 3 ° 2 (ше 2Н)в 4в54 9 (m, 1Н); 7 08 (S, 2Н); 7 63 (d, J=9 Гц, 1Н); 7,90 (S> 2Н)1 9,2 (8, 1Н) млн
Пример 4, Сопряжение пиперазида реэоруфин-4-карбоновой кислоты с
3-0- 1.3-(N-сукцинимидоксикарбонил)про- пил 3экстрадиолом.
По аналогии с описанным в примере 1и из 212 мг трифторацетата пиперазида реэофурин-4-карбоновой кислоты и
220 мг 3-0- (3-(N-сукцинимидилоксикарбонил)пропил эстрадиола получают 30
295 мг N- (3-0-(3-карбонил)пропил эстрадиолилпиперазида резоруфин-4карбоновой кислоты.
Rf (снликагель, элюирующее средстI во: хлороформ — метанол — ледяная ук35 сусная кислота в соотношении 9:1:0,1)=
=0,58.
3-0- (3-(N-Сукцинимидоксикарбонил) пропигДэстрадиол . получают обычным способом иэ 3-0-карбоксипропилэстра- 40 диола (получен из эстрадиола и броммасляной кислоты).и М-оксисукцинимида в при»утствяи дициклогексилкарбодиимида.
Пример 5. Сопряжение пипераэи-45 да резоруфин-4-карбоновой кислоты с
И- 3-(И-сукцинимидоксикарбонил)пропил фенобарбиталом.
По аналогии с описанным в примере 1и из 212 мг три@торацетата пиперазида резоруфин-4-карбоновой кислоты и
205 мг N- tj-(N-сукцинимидоксикарбо" нил)пропил фенобарбитала получают
220 мг fN-(3-карбонил)пронял1фенобар« битала резоруфин-4-карбоновой кислоты.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9;1:0,1)=
=0,45„
N-13- (N-Сукцинимидоксикарбонип) пропил фенобарбитал получают обычным способом из фенобарбитап-1-масляной кислоты и N-оксисукцинимипа в присутствии дициклогексилкарбодиимнца. . Пример 6. Сопряжение пиперазида резоруфин-4-карбоновой кислоты с N-оксисукцинимидным эфиром теофип" лин-7-пропионовой кислоты.
Из 212 мг трифторацетата пиперазида реэоруфин-4-карбоновой кислоты и
175 мг N-оксисукцинющпного эфира теофкллин-7-пропионовой кислоты получают по аналогии с описанным в примере 1 и 200 мг N-(теофиллин-7-пропионил) пиперазида резоруфин-4-карбоновой кислоты.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:
:0,1)=0,44.
М-0ксисукцинимидный эфир теофиллин-7-пропионовой кислоты получают обычным способом из теофиллин-7-про-. пионовой кислоты и Я-оксисукцинимида в присутствии дициклогексилкарбодиимипа.
Пример 7. Сопряжение N-оксисукцинимнцного эфира N-(4-реэоруфинил-карбонил)саркоэина с 1-(2-амидоэтил)дифенилгидантоииом. а. (трет-Бутоксикарбонилметил)метиламид N,О,О-триацетилдигидрорезоруфин-4-карбоновой кислоты.
10 .г хлорангидрида кислоты, описанного в примере 1в, вводят во взаимодействие по аналогии с описанным в примере 1д с трет-бутиловым эфиром саркозина.
Выход 7,5 г.
Rf (силикагель, элюирующее средство: хлороформ - метанол — ледяная уксусная кислота в соотношении 9:.1:0,1)=
=0,72. б. (трет-Бутоксикарбонклметкл)метилавщц N-ацетилдигидрорезоруфин-4карбоновой кислоты.
7,5 г продукта, описанного в примере 7а, деацетилировали по анлогии с описанным в примере 1ж.
Выход 5,2 r. й: (силикагель, элюирующее средство: хлороформ - метанол - ледяная.уксусная кислота в соотношении 9: 1:0,1)
0,56. в; (трет-Бутоксикарбонилметил)метиламид резору@ин-4"карбоновой кислоты.!
13
1621811
4,5 г продукта, описанного в примере 7б, вводят во взаимодействие по аналогии с описанным в примере 1ж.
Выход 2,6 r.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:О, 1)=
=0,64. г. N-(карбоксиметил)метилами ц резоруфин-4-карбоновой кислоты.
0,55 г продукта, описанного в примере 7в, выдерживают в течение 1 ч при комнатной температуре в 6 мл три фторуксусной кислоты. Затем реакцион- 15 ную смесь упаривают досуха, остаток растирают с диэтиловым эфиром, после чего продукт отфильтровывают.
Выход 0,45 r.
Rf(силикагель,,элюирующее средст- >0 во: хлороформ - метанол - ледяная уксусная кислота в соотношении 9:1:0,1)=
0,11. д. И -оксисукцинимидный эфир N-(4резоруфинилкарбонил)саркозина. 25
200 мг продукта из примера 7 в те:. -чение 14 ч перемешивают с 72 мг N-оксисукцинимида и 138 мг дициклогексилкарбодиимида в 40 мл тетрагидрофурана.
Выделившуюся в осадок мочевину от- 30 фильтровывают, фильтрат упаривают и полученный остаток хроматографируют на силикагеле RP 18 (элюирующее средство: нитрометан - этаиол в соотношении 4:1).
Выход 150 мг.
Rf (силикагель RP-18, элюируннцее средство: нитрометан - этанол в соотношении 4:1)=0,79. е. Сопряжение N -оксисукцинимидного эфира N-(4-резоруфинилкарбонил)саркозина с 1-(2-аминоэтил)дифенилгидантоином, 125 мг К-оксисукцинимидного эфира из примера 7д перемешивают в течение
1 ч с 90 мг 1-(2-аминоэтил)дифенилгидантоина в 40 мл смеси, состоящей
ps диоксана и KBJIHHAOGABTHoro буферного раствора с рН 8,5, взятых в соотношении 1:1. Диоксан отгоняют от реакционной смеси, к остатку прибавляют аммиак до полного изменения цвета, производят Фильтрование, после чего из фильтрата осаждают продукт прибавлением соляной кислоты.
Выход N-(4-реэоруфинкарбонил) саркосинил-1- (2-амино этил) дифенипгидантоина 110 мг.
Rf (силикагель, элюирующее средство: н-бутанол — ледяная уксусная кислота — вода в соотношении 4:1: 1)=0,78.
УФ/VIS (0,1 М калийфосфатный буферный раствор, рН 8,0): я а с =
=575 нм.
Эмиссия флуоресценции: 3 дквп
=572 нм.
Пример 8. 2-(1-Дифенилгидантоинил)этиламид резоруфин-4-карбоновой кислоты. а. 2-(1-Дифенилгидантоинил)этиламид N,О,О-триацеткпцигицрорезоруфин4-карбоновой кислоты.
По аналогии с описанным в примере 1д 1,37 г 1-(2-аминоэтил)дифенилгидантоина вводят во взаимодействие ,с 1,2 г хлорангидрида И,О,О-триацетил-г !
:дигидрорезоруфинкарбоновой кислоты.
В результате получают 1,9 г продукта в виде слабо окрашенного пенообразного вещества., б. 2-(t-Дифенилгидантоинил)этиламид резоруфин-4-карбоновой кислоты.
Полученный в примере 8а продукт окислительно деацетилируют по аналогии с описанным в примерах 1е и 1ж.
Из 1,9 г вещества поЛучают 600 мг
N- 2-.(1-диФеиилгидантоинил)этилЯреэо. руфин-4-карбоновой кислоты.
Rf (силикагель, элюирующее средство: хлороформ — метанол - ледяная уксусная кислота в соотношении 9: 1:
:0,1)=0 68.
1Н-ЯИР ((Lq6 -ДМСО),8: 3,2-4,6 (m, 4Н); 6,73 (d, J 2,2 Гц, 1Н); 6,84 (d, J=9,5 Гц, tH); 6,86 (dd, Я=9,5 и
2,2 Гц, 1Н); 7,2-7,4 (m, 10Н); 7,62 и 7,66 (no d, J 9,5 Гц, 2Н); 8,66 (t, широкий, J=5 Гц 18); 9э58 (Sý
1Н) млн"
УФ/VIS .(О ° 1 М калийфосфатный буферный раствор, рН 8,0): шаг= 575 им.
Эмиссия флуоресценции: $
=591 нм.
Пример 9. Сочетание пиперази да 6-метилрезоруфин-4-карбоиовой кис ,лоты с N-окснсукцинимидним эфиром
2-(1-дифеиилгидантоинил)уксусной кислоты. а. 2-Метил-4-ннтрозорезорцин.
19,8 r 2-метилрезорцина и 13,4 г гидроокиси калия растворяют в 120 мп этилового спирта, после чего раствор осаждают до 5 С. После этого к . охлалценному раствору прибавляют по каплям 24 мп изопентилнитрила, смесь
1621811
16 перемешивают в течение 3 ч, после чего отфильтровывают образовавшийся осадок. Окрашенное в желтый цвет твердое вещество перемешивают в
200 мл 5 н. раствора серной кислоты.
При этом в осадок выделяется окрашенный в светло-желтый цвет продукт.
Выход 22 r.
Rf (силикагель) элюирующее средст- 10 во: хлороформ — метанол - ледяная уксусная кислота в соотношении 9: 1:О, 1)=
0,53. б. 6-Иетилреэапурин-4-карбоновая кислота. 15
15,3 r 2-метил-4-нитрозореэорцина, 15,4 г 2,6«диоксибензойной кислоты, 8,8 r пиролюзита и 11 мп концентрированной серной кислоты вводят во взаимодействие по аналогии с описанным в 20 примере 1а.
Выход 28,7 г.
Rf (силикагель),элюирующее средство: хлороформ — метанол - ледяная уксусная кислота в соотношении 9:1:0,1) 5
-"О, 15. в. К,О,О-Триацетил-б-метилдигидрорезоруфин-4-карбоновая кислота.
Из 10 r 6-метилрезапурин-4-карбоновой кислоты, 19,8 г хлорнда оло". ЗО ва (II), 20 мл ангидрида уксусной кислоты и 150 мл ледяной уксусной кисло» ты получают по аналогии с описанным в примере 1б непосредственно триацетилированное лейкосоединение. Неочищен,5 ный продукт очищают путем обработки кипящим ацетоном.
Выход 7,3 r.
Rf (силикагель) элюирующее средство: хлороформ - метанол - ледяная 40 уксусная кислота в соотношении 9: 1:
:0,1)=0,51.
Н-ЯИР ((Д -ДИСО),8: 2) 10) 2) 25)
2,29; 2.33 (по 12Н); 7,00; 7,09; 7,50 и 7,74 (по d) J 8)8 Гц, 4Н) млн . )5
r. K -BOK-пипераэид N )0,0-триацетнл-6-меткпдигидрорезоруфин-4-карбоновой кислоты.
По аналогии с описанным в примерах
1г и 1д из 5 г N,О,O-триацетил-б-метилдигидрореэоруфин-4-карбоновой кислоты, 10,7 мл оксалилхлорида и 2 r (N-БОК-пиперазина получают 3 г продукта.
М (силикагель) элюирующее средст-55 во: этиловый эфир уксусной кислоты)=
**О, 57. д. Трифторацетат пиперазида 6-метилреэоруфин-4-карбоновой кислоты.
1 г триацетильного производного, описанного в примере 9г, вводят во взаимодействие по аналогии с описанным в примерах 1ж и 1з.
Выход 0,43 r. е, Взаимодействие пипераэида 6-метнлрезоруфин-4-карбоновой кислоты с
К-оксисукцинимндным эфиром 2-(1-дифеннлгндантоинил)уксусной кислоты.
222 мг соединения, полученного в примере .9д, вводят во взаимодействие с 200 мг N-оксисукцинимидного эфира
2-(1-дифенилгидантоинил)уксусной кислоты.
Выход N- ((1-дифенилгидантоинил)метилкарбонил пиперазида 6-метилрезоруфин-4-карбоновой кислоты 250 мг.
УФ/ЧТЯ (О, 1.И калийфосфатный буфер раствор, рН 8, О): $ „с =584 нм.
Эмиссия флуоресценцни: $> << =
=600 нм.
Пример 10. Взаимодействие пиперазида 9-окси-5-беиэо(а) феноксаэон8-карбоновой кислоты с N-оксисукцинимидным эфиром 2-(1"дифеннл-гидантоинил)уксусной кислоты. а. 12-Оксид 9-окси-5-бензо Ea) феноксаэон-8-карбоновой кислоты.
2,84 г 1,3-диокси-4-нитрозонафталина, 2,31 г 7)6-диоксибензойной кисло ты) 1,29 r пиролюзита .и 1,6 мл кон-, центрированной серной кислоты вводят во взаимодействие по аналогии с описанным в примере 1а.
Выход 2,8 r.
Rf (снликагель) элюирующее средство: н-бутанол - ледяная уксусная кислота — вода в соотношении 4:f:1)=0,63. б. 12-Ацетил-5,9-диацетоксибензо(а)феноксазон"8-карбоновая кислота.
По аналогии с описанным в примере 9в из 2,4 r 12-.оксида 9-окси-5бензо (а)феноксазон-8-карбоновой кисло" ты получают 1,8 г триацетилированного дигидросоединения.
Rf (силикагель) элюирующее средство: хлороформ - метанол - ледяная уксусная кислота в соотношении 9:1:
:0,1)=0 31. в. N -БОК-пиперазид 12-ацетил-5,9диацетоксибенэо (а феноксазил-8-карбоновой кислоты.
1,6 г триацетильного соединения, описанного в примере 10б, вводят во взаимодействие по аналогии с примером .9г с оксалилхлоридом и К-БОК-пиперазином.
Выход 1,2 r.
1621811
17
18 H-ЯМР (СВСа,),E: 1,49 (S, 9H):
1,1?, 2,27, 2,46 (по S, 12Н); 3,03,9 (m ЯН); 7,03 (d J 9 Гц, 1Н);
"7,16-7,94 (m, 6Н) млн
I г. N — BOK-пиперазид 9-окси-5-бензо(а феноксазон-8-карбоновой кислоты.
Ло аналогии с примером 1е из
0,93 r триацетильного соединения, полученного в примере 10в, получают 10
0,51 г продукта.
Rf (снликагель, элюирующее средство; хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
=0,69.
5 д. Трифторацетат пипераэида 9-окси-5-бензо(а феноксазон-8-карбоновой кислоты
Из 0,5 г БОК-защищенного соединения, описанного в примере 10r по аналогии с примером 1э получают 0,5 r продукта.
Rf (снликагель, элюирующее средст во: хлороформ - метанол - ледяная ук 5 сусная кислота в соотношении 9: 1:О, 1}=
=0,02. е. Сопряжение пиперазида 9-окси-5бензо(а)феноксазон-8-карбоновой кислоты с N-оксисукцинимидным эфиром
2-(1-дифенилгндантоинил)уксусной кис- 30 .лоты.
Из 50 мг пиперазида, полученного в примере 10д, и 150 мг N-оксисукцннимидного эфира 2-(1-дифенилгидантоинил)уксусной кислоты получают по ано- 35 логии с примером 1и 70 мг N- f(1-дифенилгидантоинил)метнлкарбонил)пиперазида 9-окси-5-бензо jB) феноксазон-8карбоновой кислоты.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:
:0,1)=0,57.
УФ/ЧХБ {О, 1 М калийфосфатный буферный раствор, рН 8э,O): 3юакс=
=560 нм.
Эмиссия флуоресценции: lI я = .=615 нм.
Н-ЯМР ((Д)6-ДИСО),8: 3, 0-4, 5 (ш, 10Н); 6,37 ($, 1Н); 6,80 (d, J=8 Гц, и 1Н); 7,2-7,35 (тп, 10Н); 7,35-8,0 (m, 3Fl); 8,10 (dd, J=8 и 2 Гц, 1Н);
856 (dd, J8 Гц, 1Н); 960 (S, 1Н)
1 мпн
Пример 11. (1-Лифенилгидантоиннлметилкарбонил)пиперазид 8-этилреэоруфин-4-карбоновой кислоты. а. 6-Этил-4"нитрозорезорцин.
По аналогии с описанным в примере
9а из 7,5 г 4-этилрезорцина, 4,5 гидроокиси калия и 8 мл изопентилнитрила получают 6-этил-4-нитрозорезорцин в вине окрашенного в желтый цвет твердого вещества.
Выход 7,5 r °
Rf (силикагель, элюирующее средство: хлороформ — метанол - ледяная уксусная кислота в соотношении 9:1:
: О, 1) =0,37. б. 8-Этилрезоруфин-4-карбоновая кислота.
По аналогии с описанным в примере 1а из 7,4 r 6-этилнитроэореэорцина, 6,8 r 2,6-диоксибенэойной кислоты, 3,9 г двуокиси марганца и 5 мп концентрированной серной кислоты получают после восстановления с применением 8 r цинковой пыли 9,5 r продукта.
Rf (силикагель, элюирующее средст-. во: хлороформ - метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
0,05. в. N -БОК-пиперазид N,О,О-триацетил-8-этилцигидрорезоруфин-4-карбоновой кислоты.
По аналогии с примером 1б из 7,7 г
8-этилреэоруфин-4-карбоновой кислоты, 15,4 г хпорида олова (II), 30 мп ледяной уксусной кислоты и 15,3 мп ан- . гидрида уксусной кислоты получают
N,0,0-триацетил-8-этилрезоруфин-4-карбоновую кислоту, которую в виде неочищенного продукта подвергают дальнейшей переработке по аналогии с примером 1в,непосредственно в хлорангидрид кислоты и по аналогии с приме ром 1д - в БОК-пиперазщ .
Выход 4 r.
Rf (силикагель, .элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
=0,86. г. N -БОК-пипеГазид 8-этилрезоруl» фин-4-карбоновой кислоты.
Из 4 г Nt-БОК-пиперазнда N,О,Отриацетил-8-этилдигидрорезоруфин-4-. карбоновой кислоты получают по аналогии с примерамн 1е и 1ж N -БОК-пипе-! разид соответствующей карбоновой кислоты.
Выход 0,5 г.
Rf (силикагель,,элюирукнцее срадст во: хлороформ — метанол — в соотношении 4:1) 0,67. д. Трифторацетат пиперазида 8-этилрезоруфин"4-карбоновой кислоты.
1671811
30
330 мг соответствующего BOK-пиперазида выдерживают в течение 1,5 ч в 35 мл смеси, состоящей из дихлорметана и трифторуксусной кислоты, взятых в соотношении 6:1. Полученный после упаривания остаток обрабатывают диэтиловым эфиром, продукт отфильтровывают с применением вакуума и сушат.
Выход 350 мг.
Rf (силикагель, элюирукяцее средство: бутанол — ледяная уксусная кислота — вода в соотношении 4:1 1)=0,33. е. Взаимодействие с Я-оксисукцинимидным эфиром 2-(1-дифенилгидантоинил)уксусной кислоты.
По аналогии с примером 1 и иэ
325 мг трифторацетата пиперазида 8этилреэоруфин-4-карбоновой кислоты и 435 мг N-оксисукцинимидного эфира
2-(1-дифенилгидантоинил)уксусной кислоты получают 120 мг продукта.
Rf (силикагель, элюирукяцее средство: хлороформ - метанол - ледяная 25 уксусная кислота в соотношении 9:1:
:0,1)=0,43. и-ЯМР ((Д„Д-ДМСО),о: 1,15 (Е, J=
=7,2 Гц, ЗН); 2,52 d, J 7,2 Гц, 2Н)1
3,1-4,0 (m, 8Н); 4,25-4,45 (m, 2Н);
6,42 (Б, широкий, 1Н); 6,94 (d, J=
=9,0 Гц, 1Н); 7,3-7,5 (S, 11H); 7,68 (d, J=9,0 Гц, 1Н); 9,54 (S, 1Н); 11,2 (S, широкий, 1Н) млн
УФ!ЧТЯ (0,1 М калийфосфатный буфер-З5 ный раствор, рН 8,0): мак =575 нм.
Эмиссия Флуоресценции: g макс =
=598 нм.
Пример 12. (1-Дифенилгидантоинилметилкарбонил)пиперазид 8-xrtop- 40 резоруфин-4-карбоновой кислоты. а. 8-Хлоррезалурин-4-карбоновая кислота.
Иэ 17,3 r 4-хлор-6-нитрозорезорцина, 15,4 r 2,6-диоксибензойной кисло-,45 ты, 8,6 r пиролюзита и 10,7 мл концентрированной серной кислоты получают по аналогии с примером 1а 8-хлоррезапурин-4-карбоновую кислоту.
Выход 17,1 r °
Rf (силикагель, элюирующее средство: бутанол — ледяная уксусная кислота — вода в соотношении 4:1:1)=0,58. б. N,О,О-Триацетил-Я-хлордигидро-. резоруфинкарбоновая кислота.
16,3 r 8-хлоррезалурин-4-карбоновой кислоты и 18,9 r хлорида олова (II) нагревают в течечие 0,5 ч в
100 мл смеси ледяной уксусной кислоты и ангидрида уксусной кислоты, взятых в соотношении 1:1 при 80 С, после чего реакционную смесь выливают в 500 мл води со льдом. Смесь перемешивают в течение 2 ч, осадок отфильтровывают и сушат над Sicapent ". Твердое вещество растворяют в 500 мл ацетона, после чего от раствора отделяют фильтрованием остатки нерастворенного вещества. Фильтрат упаривают, причем после сушки остатка получают 12,3 r продукта.
Rf (силикагель, элюирующее средство: хлороформ - метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
=0 39. Н-HMP (Pg<-ДМСО), : 2 25 (S
3Н); ("$" 6Н); 7, 16 (d, 3=8,8 Гц, I H);
7,30 (S, 1Н); 7,76 (d, J 8 8 Гц» 1Н)»
7,90 (S 1Н) млн . в. N ÁÎÊ-пиперазид 8-хлоррезоруфин-4-карбоновой кислоты.
По аналогии с примерами 1б, 1в, 1д и 1ж из 5 r N,О,О-триацетил-8-хлордигидрореэоруфин-4-карбоновой кислоты получают 0,8 г продукта.
Rf (силикагель,,элюирующее средство: хлороформ — метанол - ледяная уксусная кислота в соотношении 9:1:0,1)=, =0,7.
r. Трифторацетат пиперазида 8-хлоррезоруфин-4-карбоновой кислоты.
По аналогии с примером 1з из 0,8 r
БОК-защищенного соединения, полученного в примере 12в, получают 0,81 г продукта.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
=0,07. д. Сопряжение пиперазида 8-хлорреэоруфин-4-карбоновой кислоты с Nоксисукцинимидным эфиром 2-(1-дифенилгидантоинил)уксусной кислоты.
По аналогии с примером 1и иэ
400 мг трифторацетата пиперазида 8хлоррезоруфин-4-карбоновой кислоты и 410 мг N-оксисукцинимидного эфира
2-(1-дифенилгидантоинил)уксусной кислоты получают желаемый продукт.
Rf (снликагель, элюирующее средство хлороформ — метанол — ледяная уксусная кислота в соотношении 9: 1: О, 1)=
-"0,38.
УФ/VIS (О, 1 И калийфосфатный буФерный раствор, рН 8,0): дакр58! нм.
Эмиссия флуоресценции: Фмакс=
=597 нм.
2!
22
1621811
Пример 13. Сопряжение пипераэида 8-хлоррезоруфин-1-карбоновой кислоты с (2-аминоэтил)амидом теофиллин«
7-пропионовой кислоты. а. 8-Хлорреэоруфин-1-карбоновая кислота.
8,7 r 4-хлор-6-нитрозорезорцина и 7,71 г 3,5-диоксибензойной кислоты растворяют в 200 мп метилового спирта.0
К приготовленному раствору при О С прибавляют 4,8 r пиролюзита и порциями 5 3 мл концентрированной серной кислоты. Реакционную смесь перемеши" . вают в течение 2 ч при комнатной тем- 15 пературе, фильтруют и прибавляют к раствору аммиак до изменения окраски на голубую, а затем 200 мп воды. Раствор фильтруют, фильтрат при охлаждении смешивают с 25 мп концентрирован- 20 ного раствора аммиака и 20 г цинковой пыли, после чего смесь дополнительно перемешивают беэ охлаждения примерно в течение 15 мин. Затем к смеси прибавляют 200 мг активированного угля, 25 производят фильтрование, фильтрат подкисляют до рН 2, после чего выделившееся в осадок производное разоруфина отделяют с помощью центрифугирования.
Выход 3,9 г.
Rf (силикагель, элюирующее средство: н-бутанол — ледяная уксусная кислота — вода в соотношении 4:1:1)=0,88. б. N,O,О-Триацетил-8-хлордигидрореэоруфин-1-карбоновая кислота.
Из 3,5 r 8-хлоррезоруфин-1-карбоновой кислоты по аналогии с примером
1б получают 3,2 г продукта.
Rf (силикагель, элюирующее средст- во: хлороформ — метанол - ледяная уксусная кислота в соотношении 9:1:0,1)=
=0 43. в. Трифторацетат пипераэида 8-хлорреэоруфин-1-карбоновой кислоты.
Из 3 г триацетильного соединения, полученного в примере 11б, по аналогии с примерами is - 1з получают 1,4 r продукта.
Rf (силикагель, элюирующее средство: хлороформ — метанол — ледяная уксусная кислота в соотношении 9:1:0,1)=
=0,08.
r. Взаимодействие пипераэида 8хлоррезоруфин-1-карбоновой кислоты с (2-аминоэтил)амидом теофиллин™7-про55 пиоиовой кислоты.
По аналогии с примером 8 из 420 мг . пиперазида N,О,О-триацетил-8-хлордигидрорезоруфин-1-карбоновой кислоты и 300 мг (2-амнноэтил)ам ща теофиллин-7-пропионовой кислоты получают
190 мг N- ((теофиллин-7-пропионил)2-аминоэтил амида 8-хлоррезоруфин1-карбоновой кислоты.
Пример 14. Мечение иммуноглобулина G N-оксисукцинимидным эфиром
N-(4-реэоруфинилкарбонил)саркозина.
100 мг IgG человека растворяют в
10 мп 0,1 М калийфосфатного буферного раствора с рН 8,0, после чего при